
|
Vorlesungsunterlagen, Spickzettel
Anästhesiologie und Reanimation. Spickzettel: kurz das Wichtigste
Verzeichnis / Vorlesungsunterlagen, Spickzettel Inhaltsverzeichnis
1. Das Konzept der Wiederbelebung Reanimation ist ein Zweig der klinischen Medizin, der die Probleme der Revitalisierung des Körpers untersucht, Prinzipien zur Vorbeugung von Endzuständen, Reanimationsmethoden und Intensivpflege entwickelt. Praktische Methoden zur Revitalisierung des Körpers werden unter dem Begriff „Reanimation“ vereint. Reanimation (vom lateinischen „Wiederbelebung“ oder „Animation“) ist ein Maßnahmensystem, das darauf abzielt, stark beeinträchtigte oder verlorene Vitalfunktionen des Körpers wiederherzustellen und ihn aus einem unheilbaren Zustand und dem klinischen Tod zu entfernen. Effektive Reanimationsmaßnahmen sind indirekte Herzmassage und künstliche Beatmung der Lunge. Bleiben sie innerhalb von 30 Minuten unwirksam, wird der biologische Tod festgestellt. Die Intensivmedizin ist eine Reihe von Maßnahmen zur Behandlung schwerer, lebensbedrohlicher Zustände und beinhaltet je nach Indikation den Einsatz einer breiten Palette therapeutischer Maßnahmen, einschließlich intravenöser Infusionen, verlängerter mechanischer Beatmung, elektrischer Stimulation, Dialysemethoden usw. Ein kritischer Zustand ist die Unmöglichkeit, die Integrität der Körperfunktionen als Folge einer akuten Funktionsstörung eines Organs oder Systems aufrechtzuerhalten, die einen medikamentösen oder apparativen Ersatz erfordert. Der Endzustand ist ein Grenzzustand zwischen Leben und Tod, ein reversibles Aussterben von Körperfunktionen, einschließlich der Stadien Präagonie, Agonie und klinischem Tod. Der klinische Tod ist ein unheilbarer Zustand, in dem es keine Durchblutung und Atmung gibt, die Aktivität der Großhirnrinde aufhört, Stoffwechselprozesse jedoch erhalten bleiben. Bei klinischem Tod bleibt die Möglichkeit einer wirksamen Wiederbelebung bestehen. Die Dauer des klinischen Todes beträgt 5 bis 6 Minuten. Der biologische Tod ist ein irreversibler Stillstand physiologischer Prozesse in Organen und Geweben, bei denen eine Wiederbelebung unmöglich ist. Es wird durch eine Kombination einer Reihe von Anzeichen festgestellt: das Fehlen spontaner Bewegungen, Kontraktionen des Herzens und des Pulses an großen Arterien, Atmung, Reaktionen auf schmerzhafte Reize, Hornhautreflex, maximale Pupillenerweiterung und das Fehlen ihrer Reaktion auf Licht. Zuverlässige Anzeichen für den Beginn des Todes sind eine Abnahme der Körpertemperatur auf 20 ° C, das Auftreten von Leichenflecken und Muskelstarre. 2. Grundlegende Manipulationen in der Intensivpflege Perkutane Punktion und Katheterisierung der Hauptvene (Subclavia). Indikationen: große Mengen Infusions-Transfusionstherapie, parenterale Ernährung, Entgiftungstherapie, intravenöse Antibiotikatherapie, Sondierung und Kontrastierung des Herzens, Messung des ZVD, Implantation eines Schrittmachers, Unmöglichkeit der Katheterisierung peripherer Venen. Kontraindikationen: Verletzung des Blutgerinnungssystems, entzündlicher und eitriger Prozess an der Punktions- und Katheterisierungsstelle, Trauma im Schlüsselbein, Vena-cava-superior-Syndrom, Paget-Schretter-Syndrom. Instrumente und Zubehör für Punktion und Katheterisierung: Punktionsnadel, ein Satz Kunststoffkatheter, ein Satz Leiter, eine 10-ml-Spritze für intramuskuläre Injektionen, eine Schere, ein Nadelhalter, eine chirurgische Nadel und eine Seidenligatur, ein Heftpflaster. Technik: Die Katheterisierung erfolgt unter Einhaltung der Regeln der Asepsis und Antisepsis, Behandlung der Hände des Operateurs, des Operationsfeldes und Verpackung mit sterilem Material. Die Position des Patienten ist horizontal auf dem Rücken, wobei die Arme an den Körper und das Revers des Kopfes in die entgegengesetzte Richtung gebracht werden. Lokalanästhesie wird verwendet - 0,5-1% Novocainlösung. Die Punktion erfolgt am besten rechts, da bei Punktion der linken V. subclavia die Gefahr einer Verletzung des thorakalen Lymphganges besteht. Punktionspunkt - an der Grenze des inneren und mittleren Drittels des Schlüsselbeins 2 cm darunter. Die Nadel wird langsam in einem Winkel von 45 zum Schlüsselbein und 30-40 zur Brustoberfläche zwischen Schlüsselbein und 15. Rippe in Richtung Oberkante des Sternoklavikulargelenks geführt. Beim Passieren der Nadel wird der Spritzenkolben regelmäßig festgezogen, um festzustellen, ob er in die Vene eintritt, und Novocain wird entlang der Nadel injiziert. Beim Durchstechen einer Vene entsteht manchmal ein Gefühl des Versagens. Nach Eintritt in die Vene wird die Spritze von der Nadel getrennt und die Kanüle mit einem Finger verschlossen. Dann wird ein Leiter auf einer Länge von 20-6 cm durch die Nadel eingeführt und die Nadel entfernt. Ein Katheter mit dem entsprechenden Durchmesser wird durch den Leiter geführt und zusammen mit dem Leiter 8-2 cm in die Vene eingeführt, wonach der Leiter vorsichtig entfernt wird. Um die korrekte Position des Katheters zu überprüfen, wird eine Spritze daran befestigt und 3-3 ml Blut hineingezogen, wonach ein Stopfen platziert oder eine Infusionstherapie gestartet wird. Der Katheter wird mit einer Seidenligatur an der Haut fixiert. Dazu wird auf dem Katheter 5-XNUMX mm von der Haut entfernt eine Manschette aus Heftpflaster angebracht, auf die Seide gebunden wird, dann durch die Ohren des Katheters geführt und erneut gebunden. Nach Fixierung des Katheters wird die Punktionsstelle mit einem aseptischen Aufkleber verschlossen. Komplikationen: Punktion der A. subclavia, Luftembolie, Punktion der Pleurahöhle, Schädigung des Plexus brachialis, Schädigung des thorakalen Lymphgangs, Schädigung der Luftröhre, Struma und Schilddrüse, Eiterung an der Einstichstelle. 3. Tracheotomie. Konikostomie Tracheotomie Indikationen: Obstruktion des Kehlkopfes und der oberen Luftröhre durch Verstopfung durch einen Tumor oder Fremdkörper, Lähmung und Spasmen der Stimmbänder, starke Schwellung des Kehlkopfes, akute Atemnot, Aspiration von Erbrochenem, Verhinderung von Asphyxie bei schweren Brustverletzungen. Werkzeuge: 2 Skalpelle, 2 anatomische und chirurgische Pinzetten, mehrere hämostatische Klemmen, ein Elevatorium, eine gerillte Sonde, 2 stumpfe und 1 scharfer Einzahnhaken, Trousseau- oder Deschamps-Dilatator, chirurgische Nadeln mit Nadelhalter. Technik. Der Patient liegt auf dem Rücken, eine Rolle unter den Schultern, der Kopf ist zurückgeworfen. Befindet sich der Patient in einem Zustand der Asphyxie, wird die Rolle erst im letzten Moment vor dem Öffnen der Luftröhre platziert. Die lokale Infiltrationsanästhesie wird mit einer 0,5-1% igen Lösung von Novocain unter Zusatz von Adrenalin durchgeführt. Bei akuter Asphyxie kann ohne Narkose operiert werden. Erkennungspunkte: der Winkel des Schildknorpels und der Tuberkel des Ringknorpelbogens. Ein Einschnitt in die Haut, das subkutane Gewebe und die oberflächliche Faszie wird vom unteren Rand des Schildknorpels bis zur Jugularkerbe genau entlang der Mittellinie des Halses vorgenommen. Die Mittelvene des Halses wird zurückgezogen oder abgebunden, wobei eine weiße Linie gefunden wird, entlang der die Muskeln stumpf auseinandergedrückt und der Isthmus der Schilddrüse freigelegt werden. Die Schnittränder werden mit einem Trousseau-Dilatator auseinander bewegt, Ligaturen am Wundrand angelegt und die Tracheostomiekanüle vorsichtig eingeführt, wobei darauf zu achten ist, dass ihr Ende in das Lumen der Luftröhre eintritt. Die Operationswunde wird vernäht. Der Tubus wird mit einer zuvor am Tubusschild befestigten Mullschiene am Hals des Patienten fixiert. Setzen Sie das Innenrohr in das Außenrohr ein. Konikostomie Der Patient wird mit einer Querrolle auf Höhe der Schulterblätter auf den Rücken gelegt. Der Kopf des Patienten ist nach hinten geneigt. Der Kehlkopf wird mit den Fingern an den Seitenflächen des Schildknorpels fixiert und der Spalt zwischen Schild- und Ringknorpel ertastet, wo sich das kegelförmige Band befindet. Unter örtlicher Infiltrationsanästhesie mit einem spitzen Skalpell wird ein ca. 2 cm langer querer Hautschnitt gesetzt, das kegelförmige Band ertastet und präpariert bzw. perforiert. Eine beliebige Tracheostomiekanüle mit geeignetem Durchmesser wird in das entstandene Loch eingeführt und mit einem Mullstreifen um den Hals fixiert. Wenn keine Kanüle vorhanden ist, kann sie durch ein Stück Gummi- oder Kunststoffschlauch mit geeignetem Durchmesser und geeigneter Länge ersetzt werden. Damit dieser Schlauch nicht in die Trachea rutscht, wird sein äußeres Ende im Abstand von 2 cm vom Rand quer durchstochen und mit einem Mullstreifen fixiert. Conicotome ist eine Tracheostomiekanüle aus Metall mit kleinem Durchmesser und einem darin befindlichen Stechdorn. Nach Präparation der Haut oberhalb des kegelförmigen Bandes wird diese mit einem Konikotom durchstochen, der Dorn entfernt und die Kanüle in eine Position gebracht, die einen freien Luftstrom in die Trachea gewährleistet, und fixiert. 4. Luftröhrenintubation Indikationen: Kehlkopfverengung, pathologische Atmung, akutes Atemversagen, Koma II und III Grad, hohes Aspirationsrisiko bei chirurgischen Eingriffen an den Organen der Brust- und Bauchhöhle, Kopf und Hals, bei Erkrankungen des Rachens, Kehlkopfes und der Luftröhre (akute Entzündung, Krebs, Tuberkulose usw.). Zur Intubation wird ein Laryngoskop verwendet. Es besteht aus einem Griff und einer Klinge. Die am häufigsten verwendeten gebogenen Klingen, da sie physiologischer sind. Gerade Klingen werden mit einem langen Hals verwendet. Die Vorbereitung auf die Intubation umfasst die Überprüfung der Ausrüstung und die korrekte Positionierung des Patienten. Der Endotrachealtubus sollte überprüft werden. Die Manschette wird getestet, indem sie mit einer 10-ml-Spritze aufgeblasen wird. Überprüfen Sie den Kontakt des Spatels mit dem Griff des Laryngoskops und der Glühbirne. Es muss sichergestellt werden, dass die Absaugung im Falle eines plötzlichen Auswurfs, Blutungen oder Erbrechens bereit ist. Eine erfolgreiche Intubation hängt von der korrekten Position des Patienten ab. Der Kopf des Patienten sollte sich auf Höhe des Processus xiphoideus des Intubators befinden. Moderates Anheben des Kopfes bei gleichzeitiger Extension am Atlanto-Occipital-Gelenk schafft eine verbesserte Position für die Intubation. Zur Vorbereitung auf die Intubation gehört auch die obligatorische Präoxygenierung. Das Laryngoskop wird in der nicht dominanten Hand gehalten (bei den meisten Menschen ist dies die linke), und mit der anderen Hand wird der Mund des Patienten weit geöffnet. Die Klinge wird entlang der rechten Seite des Oropharynx eingeführt, um Schäden an den Zähnen zu vermeiden. Die Zunge wird nach links verschoben und die Klinge bis zum Pharynxbogen angehoben. Die Spitze einer gebogenen Klinge wird in die Vallecula (eine Grube an der Vorderfläche der Epiglottis) eingeführt, während die Spitze einer geraden Klinge die Epiglottis direkt anheben sollte. Der Griff des Laryngoskops wird senkrecht zum Unterkiefer nach oben und vorne geschoben, bis die Stimmbänder sichtbar werden. Die Abhängigkeit von Zähnen sollte vermieden werden. Der Endotrachealtubus wird in die rechte Hand genommen und unter Sichtkontrolle durch die offene Glottis geführt. Die Manschette sollte in der oberen Luftröhre, aber unterhalb des Kehlkopfes positioniert werden. Das Laryngoskop wird aus dem Mund entfernt, wobei wiederum eine Beschädigung der Zähne vermieden wird. Unmittelbar nach der Intubation erfolgt die Auskultation beidseitig über der Lunge (da eine Sondenführung in einen Bronchus möglich ist) und im Epigastrium (zum Ausschluss einer ösophagealen Intubation). Befindet sich der Tubus in der Trachea, wird er mit Bändern fixiert und der Cuff aufgeblasen. Die Manschette sollte oberhalb des Niveaus des Ringknorpels positioniert werden, da ihr längeres Stehen im Kehlkopf zu Heiserkeit in der postoperativen Phase führen kann. Komplikationen: Intubation der Speiseröhre, des Bronchus, Lage der Manschette im Kehlkopf, Schädigung der Zähne, Luxation des Unterkiefers, Laryngospasmus, Reflexstörungen (Hypertonie, Tachykardie, erhöhter Hirndruck), Verletzung der Atemwege, Entzündung usw. 5. Punktion und Katheterisierung des Epiduralraums Indikationen: starkes Schmerzsyndrom, chirurgische Eingriffe, postoperative Analgesie. Die Höhe der Epiduralblockierung hängt davon ab, welches Organ anästhesiert werden muss. Ebenen der Wirbelsäule und "Zielorgane" in der Epiduralanästhesie
Instrumentierung: Nadeln für die Anästhesie, eine spezielle Nadel zum Punktieren des Epiduralraums, eine Probenspritze, ein Katheter, ein Stopfen, Filterkugeln, Servietten, Klebeband und sterile Handschuhe. Die Position des Patienten ist auf der Seite sitzend oder liegend. In diesem Fall sollten die Knie und das Kinn so nah wie möglich an die Brust gebracht werden. Dadurch wird eine maximale Beugung der Wirbelsäule erzeugt, bei der der Winkel zwischen den Dornfortsätzen benachbarter Wirbel zunimmt und der Zugang zum gelben Band erleichtert wird. Unter aseptischen Bedingungen und unter örtlicher Betäubung mit einer 0,5%igen Lösung von Novocain wird eine Punktion des Epiduralraums durchgeführt. Die Nadel wird streng senkrecht injiziert, bei Osteochondrose ist jedoch ein Neigungswinkel oder während der Punktion im mittleren Thoraxbereich möglich. Wenn die Nadel in die Dicke der Bänder eintritt, wird der Mandrin daraus entfernt und eine Spritze mit Flüssigkeit angebracht. Der weitere Vorschub der Nadel erfolgt langsam und gleichmäßig mit Druck auf den Spritzenkolben. Aufgrund des erheblichen Widerstands der Bänder kann die Flüssigkeit die Spritze nicht verlassen. Die Spritze wird getrennt und der Katheter 5-7 cm eingeführt, es sollte kein Widerstand vorhanden sein. Die Nadel wird entfernt und der Führungsdraht wird mit Heftpflaster auf der Rückseite fixiert, wodurch er zur Vorderseite der Brust gebracht wird. Der Stecker mit dem Filter wird am Leiter befestigt. Ein Anästhetikum wird gespritzt. Danach wird der Grad der Hautanästhesie bestimmt. Komplikationen: respiratorische und hämodynamische Störungen, Intoxikation, Schädigung der Dura mater, neurologische Komplikationen, Periduritis. 6. Akute Bewusstseinsstörungen Bewusstsein ist die höchste Form der Reflexion der Realität, die eine Reihe von mentalen Prozessen ist, die es einer Person ermöglichen, in der Welt um sie herum, in der Zeit, in ihrer eigenen Persönlichkeit zu navigieren, die ihr Verhalten sicherstellt. Bewusstseinsstörung ist der allgemeine Name für Störungen der integralen Aktivität des Gehirns, die sich in einer Verletzung der Fähigkeit ausdrücken, die Umwelt angemessen wahrzunehmen, zu verstehen und darauf zu reagieren, sich darin zurechtzufinden, sich an aktuelle Ereignisse zu erinnern, Sprachkontakt herzustellen und willkürliche Hilfsmittel auszuführen Verhaltenshandlungen. Es gibt verschiedene Möglichkeiten der Bewusstseinsdepression (Stupor, Benommenheit, Koma unterschiedlicher Tiefe) sowie der akuten Verwirrtheit (deliröse Zustände oder metabolische Enzephalopathie). Der Grad der Bewusstseinsstörung variiert von leichter Verwirrtheit bis zum Koma, und es gibt keine klaren Übergänge zwischen diesen Zuständen. In der Praxis wird der Grad der Bewusstseinsstörung durch die Reaktion des Patienten auf Reize bestimmt. Betäubung ist eine Form von Bewusstseinsstörungen, gekennzeichnet durch Lethargie, Verlangsamung und Schwierigkeiten im Verlauf mentaler Prozesse, schnelle Erschöpfung der Aufmerksamkeit, eine Erhöhung der Schwelle für die Wahrnehmung äußerer Reize, jedoch unter Beibehaltung eines begrenzten verbalen Kontakts. Betäubung beruht auf einer Verletzung der Aufmerksamkeit, d. h. der Fähigkeit, die notwendigen Informationen auszuwählen und Antworten so zu koordinieren, dass die logische Abfolge von Gedanken und Handlungen nicht verletzt wird. Die häufigsten Ursachen für Stupor sind metabolische und toxische Störungen, aber manchmal wird er auch bei fokalen Läsionen des Cortex, insbesondere des rechten Parietallappens, beobachtet. Bei solchen Patienten ist eine einsilbige Antwort oder die Umsetzung einfachster Anweisungen nur nach beharrlichem Appell oder zusätzlicher Stimulation möglich. Bei weiterer Unterdrückung des Bewusstseins geht die Möglichkeit des Sprachkontakts verloren und Sopor entwickelt sich. Sopor ist ein Zustand tiefer Bewusstseinsdepression mit dem Verlust der Kontaktmöglichkeit zum Patienten, aber der Aufrechterhaltung koordinierter Abwehrreaktionen und des Öffnens der Augen des Patienten als Reaktion auf Schmerzen, Geräusche oder andere Reize. Der Patient kann auch mit Hilfe schmerzhafter Reize nicht vollständig geweckt werden, er liegt mit geschlossenen Augen. Die Reaktion auf verbale Anweisungen ist schwach oder fehlt vollständig, es ist unmöglich, vom Patienten ein Antwortwort oder einen Ton zu erhalten. Bei weiterer Unterdrückung des Bewusstseins entwickelt sich ein Koma. Koma ist ein unbewusster Zustand, der durch Unempfindlichkeit gegenüber äußeren Reizen gekennzeichnet ist. Dies ist ein lebensbedrohlicher Zustand der Depression der Funktionen des zentralen Nervensystems und Störungen der Regulation lebenswichtiger Funktionen. Koma kann durch viele verschiedene Stoffwechselstörungen und strukturelle Schäden verursacht werden. 7. Untersuchung eines Patienten im Koma Der Plan der Untersuchung des Patienten ist wie folgt. 1. Beurteilung des Funktionszustands des Atmungs- und Herz-Kreislauf-Systems. 2. Allgemeine klinische Untersuchungen unter Berücksichtigung von Labordaten zur Beurteilung der extrakraniellen Pathologie. 3. Neurologische Untersuchung. Laboruntersuchungen: allgemeiner klinischer Bluttest (Anzeichen einer bakteriellen oder viralen Infektion); Blutchemie: Glukose, Gerinnungsfaktoren (Gerinnungszeit, Prothrombin, Fibrinogen, APTT, Antithrombin III, Parakoagulationstests, Thrombozytenzahl), Harnstoff, Kreatinin, Bilirubin, ALT, AST, Osmolarität, Elektrolyte (K, Na, Mg, Ca); Toxikologisches Screening von Blut, Urin, Mageninhalt. Instrumentelle Studien: Röntgen des Schädels und der Halswirbelsäule. Die Konsultation eines Neuropathologen (Neurochirurgen) bestimmt die weitere Richtung der diagnostischen Suche: Computer- oder Magnetresonanztomographie; EEG; Ultraschall-Dopplerographie. Eine Lumbalpunktion mit Analyse des Liquor cerebrospinalis ist obligatorisch nach: 1) Konsultation eines Augenarztes und Ausschluss von Anzeichen eines erhöhten Hirndrucks - Ödeme und Erhöhung der Papille; 2) Ausschluss von Anzeichen einer Herniation des Gehirns. Folgende Lokalisationen der Herniation des Gehirns werden unterschieden. Dienzephale Herniation, die auftritt, wenn die mediale supratentorielle Lokalisation beschädigt ist und in der Verschiebung des Dienzephalons durch die Kerbe des Kleinhirnzapfens besteht. Dieser Prozess ruft auf: 1) Cheyne-Stokes-Atmung; 2) Verengung der Pupillen unter Beibehaltung ihrer Lichtreaktion; 3) Lähmung des Blicks nach oben; 4) Veränderungen im Geisteszustand. Die Herniation der medialen Teile des Temporallappens, die auftritt, wenn die laterale supratentorielle Lokalisation betroffen ist, besteht in der Verschiebung der medialen Teile des Temporallappens durch die Kerbe des Kleinhirnzapfens. Der daraus resultierende Druck auf die Strukturen des Mittelhirns äußert sich in: 1) Bewusstseinsstörung; 2) eine vergrößerte, nicht reaktive Pupille auf der Seite der Herniation, die mit einer Kompression des III. Hirnnervs verbunden ist; 3) Hemiparese auf der gegenüberliegenden Seite. Die Bewegungen der Augäpfel sind nicht immer gestört. Herniation der Tonsillen des Kleinhirns, die durch Druck verursacht wird, der den unteren Teil des Kleinhirns durch das Foramen magnum drückt, was zu einer Kompression der Medulla oblongata führt. Es verursacht: 1) Bewusstseinsstörung; 2) Verletzungen des Atemrhythmus oder Apnoe. 8. Behandlung von Koma Die Behandlung sollte so aggressiv wie möglich sein und in erster Linie darauf abzielen, eine ausreichende Oxygenierung und Stabilisierung der zentralen Hämodynamik sicherzustellen. Wenn die Spontanatmung aufrechterhalten wird, wird die Insufflation von befeuchtetem Sauerstoff über eine Maske oder einen Nasenkatheter empfohlen. Bei fehlender Spontanatmung oder bei pathologischer Atmung wird eine tracheale Intubation durchgeführt und der Patient in eine künstliche Lungenbeatmung überführt. Bei psychomotorischer Erregung und Reaktion auf mechanische Beatmung ist die Verwendung von Beruhigungsmitteln (Benzodiazepinen, Butyrophenonen) erforderlich. Die Stabilisierung der zentralen Hämodynamik ist die Normalisierung des Blutdrucks. In einem hypertensiven Zustand muss der Blutdruck gesenkt werden, jedoch nicht mehr als 10 % des ursprünglichen Werts pro Stunde. Eine gute Wirkung ist die Verwendung von Natriumnitroprussid oder Magnesiumsulfat. Bei Hypotonie werden Dopamin, Dopamin, Dobutrex und Hormonpräparate eingesetzt. In Ermangelung anamnestischer Daten und unklarer Diagnose wird eine Exjuvantibus-Therapie durchgeführt (eine positive Reaktion auf die Arzneimittelexposition gibt einerseits den Schlüssel zur Diagnose, andererseits hilft es, Zeit zu gewinnen, um irreversible Veränderungen zu vermeiden). : 1) Thiamin - 100 mg intravenös, anschließend - 100 mg intramuskulär (insbesondere bei Alkoholismus in der Vorgeschichte bei der Bestimmung hoher Ethanolkonzentrationen im Blut); 2) Glukose - eine 40% ige Lösung von 60 ml intravenös (mit einem unbekannten Glukosespiegel im Plasma oder auf einem Spiegel von weniger als 3 mmol / l); 3) Naloxon - 0,4-1,2 mg intravenös, fraktioniert, wiederholt, insbesondere bei Vorhandensein von "Opiatzeichen" (Spuren von intravenösen Injektionen, engen Pupillen, zentralen Atemstörungen); 4) Anexat (Flumazenil) - 0,2 mg für 30 Sekunden, in der nächsten Minute weitere 0,3 mg injizieren, in jeder nächsten Minute - 0,5 mg bis zu einer Gesamtdosis von 3 mg. Mangels Wirkung ist davon auszugehen, dass das Koma wahrscheinlich nicht durch Benzodiazepin-Medikamente verursacht wird; 5) Im Falle einer Vergiftung oder Überdosierung mit einem bekannten Medikament oder einer bekannten Substanz muss das entsprechende Gegenmittel verabreicht werden (falls die Möglichkeit einer Gegenmitteltherapie besteht). Die Behandlung wird durchgeführt: 1) Kontrolle des konvulsiven Syndroms; 2) Aufrechterhaltung der Normothermie; 3) Verhinderung der Aspiration von Mageninhalt; 4) urologische Behandlung; 5) Abnahme des intrakraniellen Drucks. 9. Herz-Lungen-Wiederbelebung Die Herz-Lungen-Wiederbelebung (HLW) ist ein Komplex von chirurgischen und therapeutischen Maßnahmen, die ohne lebensbedrohliche Verletzungen durchgeführt werden und auf die Wiederherstellung und Unterstützung der Funktion des kardiorespiratorischen Systems abzielen. Indikationen für die Herz-Lungen-Wiederbelebung: durchgeführt bei Patienten ohne wirksamen Puls an den Halsschlagadern oder mit fadenförmigem, schwachem Puls, die bewusstlos sind und (oder) keine effektiven Atembewegungen haben. Die häufigsten Fälle von primärem Herzstillstand sowie primärem Atemversagen. Kontraindikationen: mit dem Leben unvereinbares Trauma, Endstadium unheilbarer Krankheiten und biologischer Tod. Grundlagen Primäre Bemühungen in der HLW zielen auf: 1) Brustkompression; 2) Luft in die Lunge blasen und belüften; 3) Zubereitung und Verabreichung von Arzneimitteln; 4) Installation und Wartung des intravenösen Zugangs; 5) spezialisierte Aktivitäten (Defibrillation, Schrittmacherinstallation, Trachealintubation). Um den vollen Umfang der Aktivitäten zu vervollständigen, werden also 4 Personen und ein Teamleiter benötigt. Eine Person sollte für die HLW verantwortlich sein. Diese Person sollte alle verfügbaren Informationen integrieren und die Auswirkungen priorisieren. Er muss den EKG-Monitor und die Einnahme von Medikamenten überwachen und sicherstellen, dass die Handlungen anderer Teammitglieder korrigiert werden. Er sollte von der Durchführung von Verfahren, die von der Führungsrolle ablenken, entbunden werden. Seit mehr als 40 Jahren wird das Safar-Reanimationsalphabet für die HLW verwendet. In diesem Komplex wird die Handlungsabfolge des Beatmungsgeräts aufrechterhalten, die nach ihrem englischen Namen mit den entsprechenden Buchstaben gekennzeichnet sind. A – Atemwege – Gewährleistung der Durchgängigkeit der Atemwege. B - Atmung - künstliche Beatmung der Lunge (ALV) auf zugängliche Weise, zum Beispiel bei der Atmung "Mund zu Mund". C - Zirkulation - Gewährleistung der Blutzirkulation - indirekte Herzmassage. D - Drogen - die Einführung von Drogen. E - Elektrokardiographie - EKG-Registrierung. F - Fibrillation - Durchführen, falls erforderlich, elektrischer Defibrillation (Kardioversion). G - Gauging - Bewertung der Primärergebnisse. H - Hypothermie - Kopfkühlung. I - Intensivpflege - Intensivpflege bei postreanimationsbedingten Syndromen. 10. Gewährleistung der Durchgängigkeit der Atemwege. IVL A - Airway - Atemwegsmanagement Der Patient wird horizontal auf den Rücken gelegt. Der Kopf wird so weit wie möglich nach hinten geworfen. Wenn ein Patient mit reduziertem Muskeltonus auf dem Rücken liegt, kann seine Zunge sinken, als würde er den Hals stopfen. Gleichzeitig sinkt die Epiglottis ab und blockiert die Atemwege weiter. Erscheinen: sonores Atmen, dann Verletzungen des Atemrhythmus bis zum vollständigen Stopp. Solche Phänomene entwickeln sich besonders schnell bei bewusstlosen Patienten. Um das Zurückziehen der Zunge zu verhindern und zu beseitigen, sollte der Unterkiefer nach vorne gebracht und gleichzeitig eine Hyperextension im Okzipito-Zervikalgelenk durchgeführt werden. Dazu wird der Unterkiefer des Patienten mit dem Druck der Daumen auf das Kinn nach unten verschoben und dann mit den Fingern an den Kieferwinkeln nach vorne gedrückt, wobei diese Technik durch eine Überdehnung des Kopfes ergänzt wird rückwärts (Triple-Safar-Technik). Bei korrekter und rechtzeitiger Durchführung dieser Manipulationen wird die Durchgängigkeit der Atemwege auf Rachenhöhe schnell wiederhergestellt. Die Ursache für eine Obstruktion der Atemwege können Fremdkörper sein. Sie werden schnell mit improvisierten Materialien (Serviette) entfernt. Wegen der Aspirationsgefahr sollte der Kopf des Patienten zur Seite gedreht werden. Die Wiederherstellung der Durchgängigkeit der oberen Atemwege wird durch die Verwendung verschiedener Luftkanäle erleichtert. Am zweckmäßigsten ist die Verwendung eines S-förmigen Luftkanals. Zur Einführung wird der Mund des Patienten mit gekreuzten Fingern II und I geöffnet und die Röhre bis zur Zungenwurzel vorgeschoben, so dass ihre Öffnung am Gaumen entlang „gleitet“. Es ist darauf zu achten, dass sich der Luftkanal beim Transport nicht bewegt. Wenn alle beschriebenen Verfahren nicht wirksam sind, können wir von einer Obturation der Atemwege in den darunter liegenden Abschnitten ausgehen. In diesen Fällen ist eine direkte Laryngoskopie und aktive Absaugung des pathologischen Sekrets erforderlich, gefolgt von einer 10-15 Sekunden dauernden trachealen Intubation. Es ist ratsam, eine Konikotomie und Tracheotomie durchzuführen. B - Atmung - künstliche Lungenbeatmung (ALV) auf zugängliche Weise Die einfachste und effektivste Methode der künstlichen Beatmung bei der Reanimation ist die Mund-zu-Mund-Methode. Nach 2-3 Lungenblähungen wird das Vorhandensein eines Pulses an der Halsschlagader festgestellt. Wenn er nicht erkannt wird, fahren sie mit der künstlichen Wiederherstellung des Blutkreislaufs fort. Die manuelle Beatmung erfolgt mit einem selbstexpandierenden Ambu-Beutel. Bei Verwendung eines Beatmungsgeräts beträgt die Atemfrequenz 12-15 pro Minute, das Inspirationsvolumen 0,5-1,0 Liter. In einem Krankenhaus wird eine Trachealintubation durchgeführt und der Patient an ein Beatmungsgerät angeschlossen. 11. Indirekte Herzmassage C-Circulation - Gewährleistung der Blutzirkulation - Thoraxkompressionen Die geschlossene Herzmassage ist die einfachste und effizienteste Art der künstlichen Kreislaufunterstützung im Notfall. Mit der geschlossenen Herzmassage sollte sofort begonnen werden, sobald die Diagnose akuter Kreislaufstillstand gestellt wird, ohne deren Ursachen und Mechanismen abzuklären. Bei unwirksamen Herzkontraktionen sollte nicht auf einen vollständigen Herzstillstand oder eine eigenständige Wiederherstellung einer ausreichenden Herztätigkeit gewartet werden. Grundregeln für die Massage am geschlossenen Herzen. 1. Der Patient sollte sich in einer horizontalen Position auf einer festen Unterlage (Boden oder niedrige Couch) befinden, um die Möglichkeit einer Verschiebung seines Körpers unter der Stärkung der massierenden Hände zu vermeiden. 2. Die Anwendungszone der Kraft der Hände des Beatmungsgeräts befindet sich im unteren Drittel des Brustbeins, streng entlang der Mittellinie. Der Beatmungsbeutel kann sich auf beiden Seiten des Patienten befinden. 3. Zur Massage wird eine Handfläche auf die andere gelegt und Druck auf das Brustbein in dem Bereich ausgeübt, der sich 3-4 Querfinger über der Befestigungsstelle am Brustbein des Xiphoid-Prozesses befindet. Die an den Ellbogengelenken gestreckten Hände des Massagegeräts werden so positioniert, dass nur das Handgelenk Druck erzeugt. 4. Die Kompression der Brust des Opfers wird aufgrund der Schwerkraft des Oberkörpers des Arztes durchgeführt. Die Verschiebung des Brustbeins zur Wirbelsäule (d. h. die Tiefe der Durchbiegung des Brustkorbs) sollte 4-6 cm betragen. 5. Die Dauer einer Thoraxkompression beträgt 0,5 s, das Intervall zwischen den einzelnen Kompressionen 0,5-1 s. Massagerate - 60 Massagebewegungen pro Minute. In Intervallen werden die Hände nicht vom Brustbein genommen, die Finger bleiben angehoben, die Arme sind an den Ellbogengelenken vollständig gestreckt. Wenn die Wiederbelebung von einer Person durchgeführt wird, werden nach zwei schnellen Luftinjektionen in die Lunge des Patienten 15 Herzdruckmassagen durchgeführt, d. H. Das Verhältnis "Beatmung: Massage" beträgt 2: 15. Wenn 2 Personen an der Wiederbelebung beteiligt sind, dann dieses Verhältnis ist 1:5, d.h. es gibt 5 Herzdruckmassagen pro Atemzug. Voraussetzung für die Herzmassage ist die ständige Kontrolle ihrer Wirksamkeit. Die Kriterien für die Wirksamkeit der Massage sollten wie folgt berücksichtigt werden. 1. Veränderung der Hautfarbe: Sie wird weniger blass, grau, zyanotisch. 2. Zusammenschnüren der Pupillen, wenn sie erweitert waren, mit Auftreten einer Lichtreaktion. 3. Das Auftreten eines Pulsimpulses an den Halsschlagadern und Oberschenkelarterien und manchmal an der Radialarterie. 4. Bestimmung des Blutdrucks in Höhe von 60-70 mm Hg. Kunst. gemessen an der Schulter. 5. Manchmal das Auftreten unabhängiger Atembewegungen. 12. Die Einführung von Drogen. EKG-Registrierung D - Drogen - die Einführung von Drogen. Bei akutem Kreislaufstillstand sollte möglichst früh mit der Gabe herzstimulierender Mittel begonnen, ggf. während der Reanimation wiederholt werden. Nach Beginn der Herzmassage sollten so schnell wie möglich 0,5-1 ml Adrenalin verabreicht werden (intravenös oder intratracheal). Seine wiederholten Einführungen sind nach 2-5 Minuten möglich (bis zu 5-6 ml insgesamt). Bei Asystolie tonisiert Adrenalin das Myokard und hilft, das Herz zu "starten". Bei Kammerflimmern trägt es zum Übergang von kleinwelligem Fibrillieren zu großwelligem Fibrillieren bei, was die Defibrillation erheblich erleichtert. Adrenalin erleichtert die koronare Durchblutung und erhöht die Kontraktionsfähigkeit des Herzmuskels. Anstelle von Adrenalin kann Isodrin verwendet werden, das in Bezug auf die Wirksamkeit der Wirkung auf das Myokard dreimal wirksamer ist als Adrenalin. Die Anfangsdosis beträgt 3-1 ml durch intravenöse Injektion und die nächsten 2-1 ml in 2 ml einer 250% igen Glucoselösung. Unter Bedingungen einer gestörten Durchblutung nimmt die metabolische Azidose fortschreitend zu, daher wird unmittelbar nach der Infusion von Adrenalin eine 5-4% ige Lösung von Natriumbicarbonat intravenös mit einer Rate von 5 ml / kg des Körpergewichts des Patienten verabreicht. Während des Sterbeprozesses steigt der Tonus des parasympathischen Nervensystems signifikant an, das Gehirn ist erschöpft, daher werden M-Cholinolytika verwendet. Bei Asystolie und Bradykardie wird Atropin intravenös in einer 3% igen Lösung verabreicht - 0,1-0,5 ml, bis zu einer maximalen Dosis von 1-3 ml. Um den Myokardtonus zu erhöhen und die Wirkung einer Hyperkaliämie zu verringern, wird die intravenöse Verabreichung von 4 ml einer 5% igen Calciumchloridlösung empfohlen. Adrenalin, Atropin und Calciumchlorid können zusammen in derselben Spritze verabreicht werden. Bei schwerer Tachykardie und insbesondere bei der Entwicklung von Flimmern ist die Verwendung von Lidocain in einer Dosis von 60-80 mg angezeigt, da es jedoch kurz wirkt, wird es mit einer Geschwindigkeit von 2 mg / min infundiert. Es ist auch angezeigt, Glukokortikoide zu verwenden, die durch Erhöhung der Empfindlichkeit adrenoreaktiver myokardialer Strukturen gegenüber Katecholaminen und Normalisierung der Permeabilität von Zellmembranen zur Wiederherstellung einer angemessenen Herzaktivität beitragen. E - Elektrokardiographie - EKG-Registrierung Mit Hilfe einer EKG-Untersuchung wird die Art der Verletzung der Herzaktivität bestimmt. Meistens kann es Asystolie sein - vollständiges Aufhören von Herzkontraktionen, Flimmern - chaotische unkoordinierte Kontraktion von Myokardfasern mit einer Frequenz von 400-500 Schlägen / min, bei der die Herzleistung praktisch aufhört. Zunächst wird ein großwelliges Flimmern festgestellt, das innerhalb von 1-2 Minuten in ein kleinwelliges Flimmern übergeht, gefolgt von einer Asystolie. Das Vorhandensein eines Rhythmus im EKG ist besser als das völlige Fehlen elektrischer Aktivität des Myokards. Daher besteht die Hauptaufgabe der CPR darin, die elektrische Aktivität des Myokards zu stimulieren und sie anschließend in einen effektiven (Vorhandensein eines Pulses) Rhythmus umzuwandeln. 13. Elektrische Defibrillation F - Fibrillation - ggf. Durchführung einer elektrischen Defibrillation (Kardioversion) Herzflimmern kann durch den Einsatz von elektrischer Defibrillation beseitigt werden. Es ist notwendig, die Elektroden eng an der Brust anzubringen (in der anterolateralen Position befindet sich eine Elektrode im Bereich der Herzspitze, die zweite im subklavischen Bereich rechts vom Brustbein), was die Kraft der erhöht Entladung und dementsprechend die Wirksamkeit der Defibrillation. Bei einer Reihe von Patienten ist die anteroposteriore (Herzspitze – interskapularer Raum) Position der Elektroden effektiver. Bringen Sie keine Elektroden über den Auflagen des EKG-Monitors an. Zu beachten ist, dass die elektrische Defibrillation nur wirksam ist, wenn im EKG großwellige Schwingungen mit einer Amplitude von 0,5 bis 1 mV oder mehr aufgezeichnet werden. Diese Art von Myokardflimmern weist auf die Sicherheit seiner Energieressourcen und die Möglichkeit hin, eine ausreichende Herzaktivität wiederherzustellen. Wenn die Schwingungen niedrig, arrhythmisch und polymorph sind, was bei schwerer myokardialer Hypoxie beobachtet wird, ist die Möglichkeit der Wiederherstellung der Herzaktivität nach der Defibrillation minimal. In diesem Fall ist es mit Hilfe von Herzmassage, mechanischer Beatmung, intravenöser Verabreichung von Adrenalin, Atropin und Calciumchlorid erforderlich, die Übertragung des Flimmerns auf eine große Welle zu erreichen, und erst danach sollte eine Defibrillation durchgeführt werden. Der erste Defibrillationsversuch wird mit einer Entladung von 200 J durchgeführt, bei weiteren Versuchen wird die Ladung auf 360 J erhöht. Die Elektroden müssen angefeuchtet und fest an die Brustoberfläche gedrückt werden. Zu den häufigsten Fehlern während der Defibrillation, die die Unwirksamkeit der letzteren verursachen, gehören die folgenden. 1. Lange Unterbrechungen der Herzmassage oder völliges Fehlen einer Wiederbelebung während der Vorbereitung des Defibrillators für die Entladung. 2. Lockeres Anpressen oder unzureichende Benetzung der Elektroden. 3. Anwendung einer Entladung vor dem Hintergrund von Niederwellenflimmern, ohne Maßnahmen zu ergreifen, die die Energieressourcen des Myokards erhöhen. 4. Anlegen einer Entladung mit niedriger oder übermäßig hoher Spannung. Es sollte beachtet werden, dass die elektrische Defibrillation des Herzens ein wirksames Verfahren zum Korrigieren solcher Herzarrhythmien wie paroxysmaler ventrikulärer Tachykardie, Vorhofflattern, nodaler und supraventrikulärer Tachykardie und Vorhofflimmern ist. Die Indikation zur elektrischen Defibrillation im präklinischen Stadium ist meistens eine paroxysmale ventrikuläre Tachykardie. Ein Merkmal der Defibrillation unter diesen Bedingungen ist das Bewusstsein des Patienten und die Notwendigkeit, die Schmerzreaktion beim Anlegen einer elektrischen Entladung zu beseitigen. 14. Intensivbehandlung von Post-Reanimations-Syndromen I-Intensivpflege - Intensivpflege für Syndrome nach der Wiederbelebung 1. Korrektur von CBS und Wasser-Elektrolyt-Gleichgewicht. Häufig entwickeln sich nach CPR eine metabolische Alkalose, Hypokaliämie, Hypochlorämie und andere Elektrolytstörungen. Es gibt eine Verschiebung des pH-Werts in ein saures oder alkalisches Milieu. Der Schlüssel zur pH-Korrektur ist eine ausreichende Belüftung. Die Verwendung von Bikarbonat sollte unter Kontrolle der Gaszusammensetzung des Blutes erfolgen. In der Regel ist die Einführung von HCO3 mit einer schnellen Wiederherstellung von Blutkreislauf und Atmung nicht erforderlich. Bei einem funktionierenden Herzen ist ein pH-Wert von ~7,15 für das Funktionieren des Herz-Kreislauf-Systems ausreichend. 2. Normalisierung des antioxidativen Abwehrsystems. Die Intensivtherapie umfasst einen Komplex von Antioxidantien mit multidirektionaler Wirkung - Mafusol, Unitiol, Vitamin C, Multibiont, Tocopherol, Probucol usw. 3. Die Verwendung von Antioxidantien hilft, die Intensität von Stoffwechselprozessen zu reduzieren und folglich den Bedarf an Sauerstoff und Energie sowie die maximale Nutzung der reduzierten Menge an Sauerstoff, die während einer Hypoxie verfügbar ist, zu reduzieren. Dies wird durch den Einsatz von neurovegetativen Schutzmitteln und Antihypoxantien (Seduxen, Droperidol, Ganglienblocker, Mexamin, Natriumoxybutyrat, Cytochrom, Gutimin usw.) erreicht. 4. Eine Erhöhung der Energieressourcen wird durch die intravenöse Verabreichung konzentrierter Glukoselösungen mit Insulin und den wichtigsten an der Energieverwertung beteiligten Coenzymen (Vitamin B6, Cocarboxylase, ATP, Riboxin usw.) erreicht. 5. Die Stimulation der Synthese von Proteinen und Nukleinsäuren - Substrate, die für das normale Funktionieren von Zellen, die Synthese von Enzymen, Immunglobulinen und anderen unbedingt erforderlich sind, erfolgt durch die Verwendung von anabolen Hormonen (Retabolil, Nerabolil, Insulin, Retinol ), Folsäure sowie die Einführung von Aminosäurelösungen. 6. Die Aktivierung des aeroben Stoffwechsels wird durch die Einführung einer ausreichenden Menge an Oxidationssubstraten (Glucose) sowie durch die Verwendung einer hyperbolischen Oxygenierung (HBO) erreicht - diese Methode stellt die Versorgung mit der erforderlichen Sauerstoffmenge auch bei starken Verletzungen ihrer Lieferung sicher . 7. Verbesserung von Redoxprozessen (Bernsteinsäure, Riboxin, Tocopherol etc.). 8. Aktive Entgiftungstherapie trägt zur Normalisierung von Stoffwechselvorgängen bei. Dazu kommen verschiedene Methoden der Infusionstherapie (Gelatinol, Albumin, Plasma), forcierte Diurese etc. In schweren Fällen kommen extrakorporale Entgiftungsmethoden zum Einsatz (Hämosorption, Hämodialyse, Plasmapherese). 9. Beseitigung von Verletzungen der Mikrozirkulationsprozesse. Dazu wird eine Heparintherapie durchgeführt. 15. Laryngospasmus Laryngospasmus ist der Verschluss der echten und falschen Stimmbänder. In beiden Fällen werden zwangsläufig Kontrollmittel (Eufillin) eingesetzt. Wenn dies nicht hilft, müssen kurz wirkende Muskelrelaxanzien eingeführt, intubiert und der Patient an eine mechanische Beatmung übergeben werden. Muskelrelaxantien verursachen in der postoperativen Phase Atemstillstand, wenn keine ausreichende Decurarisierung durchgeführt wird. Es wird normalerweise durch Anticholinesterase-Medikamente (Prozerin) produziert. Zum Zeitpunkt der Extubation muss sichergestellt werden, dass sich Kraft und Muskeltonus erholt haben (bitten Sie, eine Hand zu heben, eine Hand zu drücken, einen Kopf zu heben). Bei mehreren Rippenbrüchen sinkt ein Teil der Brust beim Einatmen, es entwickelt sich die sogenannte paradoxe Atmung, daher muss der Brustrahmen wiederhergestellt werden. Bei diesem Patienten ist es notwendig, nach der Einführung von Beruhigungsmitteln mit weiterer Umstellung auf mechanische Beatmung zu intubieren (bis die Unversehrtheit des Brustkorbs wiederhergestellt ist). Folgendes führt zu einer Abnahme des funktionierenden Lungenparenchyms: Atelektase, Lungenkollaps, Lungenentzündung, Operationsfolgen, Pneumo-, Hämo-, Pyothorax. Unterschiede zwischen Atelektase und Kollaps: Atelektase ist eine Obstruktion im aufgerichteten Zustand. Dieser Zustand ist durch das Vorhandensein einer unbelüfteten Lunge gekennzeichnet, durch die die Hälfte des zirkulierenden Blutes fließt, letzteres ist nicht mit Sauerstoff angereichert. Infolgedessen entwickelt sich ein akutes Atemversagen. Wenn die Lunge kollabiert, wird sie durch Luft oder Flüssigkeit in der Pleurahöhle komprimiert. Gleichzeitig nimmt die Durchblutung in der komprimierten Lunge stark ab und die Durchblutung in der gesunden Lunge nimmt zu. Daher ist ein Kollaps keine so gefährliche Komplikation im Hinblick auf die Entwicklung eines akuten respiratorischen Versagens wie eine Atelektase. Vor der Operation sollte die Funktion der intakten Lunge beurteilt werden (separate Spirographie). Je nach Entwicklungsstadium wird das akute respiratorische Versagen unterteilt in: 1) Funktionsstörung; 2) Mangelhaftigkeit; 3) Versagen der prothetischen Funktion. Je nach Entwicklungsgeschwindigkeit wird das akute Atemversagen unterteilt in: 1) blitzschnell (entwickelt sich innerhalb einer Minute); 2) akut (entwickelt sich innerhalb weniger Stunden); 3) subakut (entwickelt sich innerhalb weniger Tage); 4) chronisch (dauert jahrelang). Die wichtigsten Elemente der Intensivmedizin bei akutem Lungenversagen: Sauerstofftherapie, Drainagelage des Patienten, Fibrobronchoskopie, Tracheotomie, Intubation und mechanische Beatmung, Bronchodilatation, Hormontherapie, HBO. 16. Lungenembolie Lungenembolie (PE) ist eine Blockade des Haupt- oder Mittelstammes, kleiner Gefäßstämme der Lungenarterie, was zu einem Druckanstieg im Lungenkreislauf führt, Rechtsherzinsuffizienz. Klinische Klassifikation von PE Form: schwer, mittel und leicht. Stromabwärts: fulminant, akut, rezidivierend. Je nach Schädigungsgrad der Lungenarterie: Stamm- oder Hauptäste, Lappen- (Segment-) Äste, kleine Äste. Der klinische Verlauf der PE ist sehr variabel. Die häufigsten Symptome sind plötzlich einsetzende Atemnot (RR reicht von 30 bis über 50 pro Minute), schnelle Atmung, Blässe, häufiger Zyanose, Schwellung der Jugularvenen, Tachykardie, arterielle Hypotonie (bis zum Schock), retrosternal Schmerzen, Husten und Bluthusten. Die Auskultation bestimmt oft die Verstärkung des II. Tonus über der Pulmonalarterie. Röntgenzeichen - eine Zunahme der Größe der proximalen Lungenarterie, Erschöpfung des peripheren Musters sowie Anheben der Zwerchfellkuppel. Das EKG kann eine Überlastung der rechten Abteilungen (Cor pulmonale) aufzeigen: 1) das Auftreten von Q-Wellen bei gleichzeitiger Zunahme der Amplitude der R- und S-Wellen (QS-Syndrom); 2) Drehung des Herzens um die Längsachse mit dem rechten Ventrikel nach vorne (Verschiebung der Übergangszone zur linken Brust führt); 3) ST-Streckenhebung mit negativer Welle in den Ableitungen III, aUR, V1-V3; 4) das Auftreten oder die Zunahme des Blockadegrades des rechten Beins des His-Bündels; 5) hoher spitzer "pulmonaler" Zahn P mit einer Abweichung seiner elektrischen Achse nach rechts; 6) Sinustachykardie oder tachysystolische Form von Vorhofflimmern. Die Echokardiographie ermöglicht die Erkennung eines akuten Cor pulmonale, die Bestimmung des Schweregrads der Hypertonie im Lungenkreislauf, die Beurteilung des strukturellen und funktionellen Zustands des rechten Ventrikels, die Erkennung von Thromboembolien in den Herzhöhlen und in den Hauptpulmonalarterien, die Visualisierung eines offenen Foramen ovale, das sich auswirken kann die Schwere hämodynamischer Störungen und die Ursache einer paradoxen Embolie sein. Ein negatives echokardiographisches Ergebnis schließt jedoch keineswegs die Diagnose einer Lungenembolie aus. Die aussagekräftigste diagnostische Methode ist die Pulmonalarterienangiographie. Behandlung 1. Antikoagulanzientherapie. 2. Thrombolytische Therapie. 3. Chirurgische Behandlung. 17. Notfallbehandlung des Status asthmaticus Sauerstoff Therapie. Befeuchteter Sauerstoff wird eingeatmet2durch Nasenkatheter oder durch eine Maske mit einer Geschwindigkeit von 1-2 l / min. Adrenalin stimuliert α1-,β., - und β2-adrenerge Rezeptoren, erweitert die Bronchien und verringert den Atemwegswiderstand. Eufillin hemmt die Phosphodiesterase, die zur Akkumulation von zyklischem AMP und zur Beseitigung von Bronchospasmen beiträgt. Bei der Verschreibung von Aminophyllin sollten Kontraindikationen berücksichtigt werden, darunter Rauchen und Kindheit, Herzinsuffizienz und akutes Koronarsyndrom, chronische Erkrankungen der Lunge, Leber und Nieren. Bei AS beträgt die Aufsättigungsdosis von Aminophyllin 3-6 mg/kg, es wird intravenös über 20 Minuten verabreicht. Führen Sie dann eine Erhaltungs-Tropfinfusion des Arzneimittels durch. Die Wirkung einer Kortikosteroidtherapie ist mit der Unterdrückung von Atemwegsentzündungen und einer erhöhten Empfindlichkeit gegenüber β-adrenergen Wirkstoffen verbunden. Je schwerer die AS, desto größer die Indikation für eine sofortige Kortikosteroidtherapie. Zunächst sollte eine hohe Dosis Kortikosteroide verabreicht werden. Wenn die Therapie unwirksam ist, wird die Dosis erhöht. Mindestens alle 6 Stunden werden angemessene äquivalente Dosen dieser Arzneimittel verabreicht. Den meisten Patienten wird eine Inhalationstherapie mit b - Adrenomimetika gezeigt; (Fenoterol, Alupent, Salbutamol). Ausnahmen sind Fälle von Überdosierung von Sympathomimetika. Wenn die laufende Therapie keine Wirkung zeigt, ist die intravenöse Verabreichung von β-adrenergen Agonisten wie Isoproterenol, verdünnt in 5%iger Glucoselösung, indiziert. Kontraindikationen sind Herzerkrankungen (koronare Kardiosklerose, Myokardinfarkt), schwere Tachykardie und Symptome von Tachyphylaxie, hohes Alter. Die Verabreichungsrate von Isoproterenol beträgt 0,1 μg / kg pro 1 Minute bis zum Einsetzen der Tachykardie (HR 130 pro 1 Minute oder mehr). Die Infusionstherapie ist die wichtigste Komponente der Behandlung von AS, die darauf abzielt, Flüssigkeitsmangel aufzufüllen und Hypovolämie zu beseitigen. Das Gesamtvolumen der Infusionstherapie beträgt 3-5 Liter pro Tag. Die Hydratation erfolgt durch Einbringen von Lösungen, die eine ausreichende Menge an freiem Wasser (Glukoselösungen) sowie hypo- und isotonische Elektrolytlösungen enthalten, die Natrium und Chlor enthalten. Indikatoren für eine ausreichende Flüssigkeitszufuhr sind das Aufhören des Durstes, eine feuchte Zunge, die Wiederherstellung der normalen Diurese, eine verbesserte Auswurfevakuierung und eine Abnahme des Hämatokrits auf 0,30 bis 0,40. Die Halothan-Anästhesie kann zur Behandlung eines schweren Asthmaanfalls eingesetzt werden, der einer konventionellen Therapie nicht zugänglich ist. Künstliche Beatmung der Lunge. Die Indikationen für die Übertragung von Patienten mit AS auf eine mechanische Beatmung sollten sehr streng sein, da sie in diesem Zustand häufig Komplikationen verursacht und durch eine hohe Mortalität gekennzeichnet ist. Gleichzeitig ist die maschinelle Beatmung, wenn sie streng indikationsgerecht durchgeführt wird, die einzige Methode, die ein weiteres Fortschreiten der Hypoxie und Hyperkapnie verhindern kann. 18. Myokardinfarkt Ein Myokardinfarkt ist eine Diskrepanz zwischen myokardialem Sauerstoffbedarf und seiner Abgabe, was zu einer begrenzten Nekrose des Herzmuskels führt. Die häufigste Ursache ist ein Thrombus, seltener eine Embolie, seltener ein Krampf der Herzkranzgefäße. Thrombose wird am häufigsten vor dem Hintergrund einer atherosklerotischen Schädigung der Koronararterien beobachtet. Klassischerweise beginnt ein Herzinfarkt mit zunehmenden Schmerzen hinter dem Brustbein, die von brennender und drückender Natur sind. Gekennzeichnet durch ausgedehnte Bestrahlung von Schmerzen in den Armen (normalerweise links), Rücken, Bauch, Kopf, unter dem linken Schulterblatt, im linken Unterkiefer usw. Die Patienten sind unruhig, ängstlich, manchmal bemerken sie ein Gefühl der Angst vor Tod. Es gibt Anzeichen von Herz- und Gefäßinsuffizienz - kalte Extremitäten, feuchter Schweiß usw. Das Schmerzsyndrom ist verlängert und wird durch Nitroglycerin für 30 Minuten oder länger nicht gelindert. Es gibt verschiedene Störungen des Herzrhythmus, einen Blutdruckabfall oder dessen Anstieg. Patienten bemerken subjektiv das Gefühl von Luftmangel. Die oben genannten Anzeichen sind typisch für Periode I - schmerzhaft oder ischämisch, deren Dauer von mehreren Stunden bis zu 2 Tagen reicht. Objektiv eine Erhöhung des Blutdrucks (dann eine Senkung); erhöhte Herzfrequenz oder Rhythmusstörung; bei der Auskultation ist ein abnormaler IV-Ton zu hören; Herzgeräusche sind gedämpft; auf dem Aorta-Akzent-II-Ton; es gibt praktisch keine biochemischen Veränderungen im Blut, charakteristische Anzeichen im EKG. Die zweite Periode ist akut (fieberhaft, entzündlich), gekennzeichnet durch das Auftreten einer Nekrose des Herzmuskels an der Stelle der Ischämie. Der Schmerz vergeht normalerweise. Die Dauer der akuten Phase beträgt bis zu 2 Wochen. Das Wohlbefinden des Patienten verbessert sich allmählich, allgemeine Schwäche, Unwohlsein und Tachykardie bleiben jedoch bestehen. Herztöne sind gedämpft. Der durch den Entzündungsprozess im Myokard verursachte Anstieg der Körpertemperatur, meist gering, bis zu 38 °C, tritt meist am 3. Krankheitstag auf. Am Ende der ersten Woche normalisiert sich die Temperatur normalerweise wieder. Die dritte Periode (subakute oder vernarbende Periode) dauert 4-6 Wochen. Charakteristisch dafür ist die Normalisierung der Blutparameter (Enzyme), die Körpertemperatur normalisiert sich, alle anderen Anzeichen eines akuten Prozesses verschwinden: das EKG verändert sich, an der Nekrosestelle entsteht eine Bindegewebsnarbe. Die vierte Periode (Rehabilitationsphase, Genesung) dauert 6 Monate bis 1 Jahr. Es gibt keine klinischen Anzeichen. Während dieser Zeit tritt eine kompensatorische Hypertrophie intakter myokardialer Muskelfasern auf, und andere kompensatorische Mechanismen entwickeln sich. Es gibt eine allmähliche Wiederherstellung der Myokardfunktion. Aber die pathologische Q-Zacke bleibt im EKG bestehen. Die Behandlung zielt darauf ab, Komplikationen zu verhindern, die Infarktzone zu begrenzen, Schmerzen zu lindern und Hypoxie zu korrigieren. 19. Kardiogener Schock Der kardiogene Schock ist eine kritische Durchblutungsstörung mit arterieller Hypotonie und Anzeichen einer akuten Verschlechterung der Durchblutung von Organen und Geweben. Das wichtigste diagnostische Zeichen ist ein signifikanter Abfall des systolischen Blutdrucks, der unter 90 mm Hg liegt. Kunst. Der Unterschied zwischen systolischem und diastolischem Druck (Pulsdruck) beträgt 20 mm Hg. Kunst. oder noch kleiner werden. Darüber hinaus entwickelt sich eine Klinik mit einer starken Verschlechterung der Durchblutung von Organen und Geweben: 1) Bewusstseinsstörungen von leichter Lethargie bis hin zu Psychosen oder Koma, fokale neurologische Symptome können auftreten; 2) Diurese weniger als 20 ml/h. Symptome einer Verschlechterung der peripheren Durchblutung: blasse zyanotische, marmorierte, ziegelrote, feuchte Haut; kollabierte periphere Venen, ein starker Temperaturabfall der Haut der Hände und Füße; Abnahme des Blutflusses. Der Wert des CVP kann unterschiedlich sein. Normale Indikatoren für CVP sind 5-8 cm Wasser. Kunst.; Anzeige unter 5 cm Wasser. Kunst. zeigt Hypovolämie und niedrigen Blutdruck an und über 8 cm Wasser. Kunst. deutet auf eine rechtsventrikuläre Insuffizienz hin. Behandlung Eine Sauerstofftherapie mit befeuchtetem Sauerstoff über eine Maske oder Nasenkatheter ist indiziert. Schmerzhaft verabreichte Antikoagulanzien in einer Dosis von 10 IE, gefolgt von intravenösem Infusomat 000 IE pro Stunde. Es ist notwendig, Analgetika zu verabreichen: Morphin 1000% 1 ml subkutan oder intravenös als Bolus; Analgin 1,0% 50 ml intramuskulär, intravenös. Gefäßtonika: Cordiamin 1-4 ml intravenös; Mezaton 1 % 1,0 g subkutan, intravenös, in Kochsalzlösung; Norepinephrin 0,2 % 1,0 g intravenös. Ein echter kardiogener Schock wird wie folgt behandelt. Zur Steigerung der kontraktilen Aktivität des Myokards wird verwendet: Strophanthin 0,05% 0,5-0,75 g intravenös langsam pro 20,0 isotonische Lösung, Korglucon 0,01 g intravenös, auch in isotonischer Lösung oder in einer polarisierenden Mischung, Glucagon 2-4 mg intravenös Tropfen auf eine polarisierende Lösung. Normalisierung des Blutdrucks: Norepinephrin 0,2% 2-4 ml pro 1 Liter 5% ige Glucoselösung oder isotonische Lösung. Der Blutdruck wird bei 100 mm Hg gehalten. Art., Mezaton 1 % 1,0 g intravenös; Cordiamin 2-4 ml, Dopamin 200 mg in 400 ml Rheopolyglucin oder 5 % Glucose. Bei einer instabilen Wirkung der oben genannten Medikamente werden Hydrocortison 200 mg, Prednisolon 90-120 mg verwendet. Normalisierung der rheologischen Eigenschaften des Blutes. Beseitigung von Hypovolämie, da der flüssige Teil des Blutes schwitzt: Reopoliglyukin, Polyglukin - in einem Volumen von bis zu 100 ml mit einer Geschwindigkeit von 50,0 ml pro Minute. Korrektur des Säure-Basen-Gleichgewichts (Bekämpfung der Azidose): Natriumbicarbonat 5 % auf 200,0 ml. Wiedereinführung von Schmerzmitteln. Wiederherstellung von Rhythmus- und Leitungsstörungen. 20. Hypertensive Krise Eine hypertensive Krise ist ein plötzlicher Anstieg des Blutdrucks auf ein für diesen Patienten normalerweise nicht charakteristisches Niveau, der zu akuten regionalen Durchblutungsstörungen und einer Schädigung von Zielorganen (Herz, Gehirn, Nieren, Darm) führt. Externe Faktoren, die eine Krise auslösen, können sein: 1) psycho-emotionaler Stress; 2) meteorologische Einflüsse; 3) übermäßiger Verzehr von Speisesalz. Klinische Symptome einer Krise äußern sich durch Lärm in den Ohren, aufblitzende Fliegen vor den Augen, platzender Kopfschmerz in der Hinterkopfgegend, verschlimmert durch Bücken, Pressen, Husten, Übelkeit, Erbrechen, Herzrhythmusstörungen. Während einer Krise kommt es zu gefährlichen Verletzungen des zerebralen Koronars, seltener des Nieren- und Bauchkreislaufs, was zu Schlaganfall, Herzinfarkt und anderen schwerwiegenden Komplikationen führt. Das EKG zeigt eine linksventrikuläre Hypertrophie. Die Röntgenaufnahme des Brustkorbs zeigt ein vergrößertes Herz, eine Aortendeformität in Form der Zahl "3", einen Wucher der Rippen infolge eines erhöhten kollateralen Blutflusses durch die Interkostalarterien. Aortographie bestätigt die Diagnose. Die neurovegetative Form der Krise ist gekennzeichnet durch einen plötzlichen Beginn, Erregung, Hyperämie und Feuchtigkeit der Haut, Tachykardie, häufiges starkes Wasserlassen, einen vorherrschenden Anstieg des systolischen Drucks mit einem Anstieg der Pulsamplitude. Solche Krisen werden auch Nebennieren- oder Typ-I-Krisen genannt. Typ-I-Krisen verlaufen meist relativ gutartig, können aber zu paroxysmalen Arrhythmien oder Angina pectoris und in schweren Fällen zum Herzinfarkt führen. Bei der Wasser-Salz-Form der Krise verschlechtert sich der Zustand allmählich, Schläfrigkeit, Schwäche, Lethargie, Orientierungslosigkeit, Blässe und Schwellungen des Gesichts sowie Schwellungen werden festgestellt. Systolischer und diastolischer Druck steigen gleichmäßig oder mit Überwiegen des letzteren und Abnahme des Pulsdrucks. Solche Krisen werden Typ-II-Krisen genannt. Krisen vom Typ II sind in der Regel schwerwiegend und können durch Myokardinfarkt, Schlaganfall, akutes linksventrikuläres Versagen kompliziert werden. Es ist notwendig, hypertensive Krisen hervorzuheben, die sich als Folge einer abrupten Beendigung einer dauerhaften antihypertensiven Therapie entwickeln, insbesondere der Einnahme von B-Blockern, Nifedipin, Sympatholytika und insbesondere Clonidin. Die Behandlung einer hypertensiven Krise besteht in einer dringenden Senkung des Blutdrucks auf ein normales Niveau, das notwendig ist, um Schäden an Zielorganen bei Bluthochdruck zu verhindern oder zu begrenzen, um Komplikationen bis zum Tod in den schwersten Fällen oder einer dauerhaften Behinderung bei der Entwicklung eines Schlaganfalls zu verhindern , Herzinfarkt. 21. Arrhythmie. Paroxysmus von Vorhofflimmern Eine Arrhythmie ist ein anderer Herzrhythmus als Sinus. Klassifizierung von Arrhythmien 1. Verletzung der Impulsbildung: 1) im Sinusknoten: a) Sinustachykardie; b) Sinusbradykardie; c) Sinusarrhythmie; d) Sick-Sinus-Syndrom (SSS); 2) ektopische Arrhythmien: a) Extrasystole; b) paroxysmale Tachykardie; c) Vorhofflimmern und -flattern; d) Flackern und Flattern der Ventrikel. 2. Verletzung der Impulsleitung: 1) zusätzliche Pfade (Kent-Bündel); 2) Herzblock: a) atrial (intraatrial); b) atrioventrikulär; c) intraventrikulär. Mechanismen von Arrhythmien Eine Abnahme des Ruhepotentials, der Erregungsschwelle, tritt nur auf Grund eines Mangels an zellulärem Kalium auf, dem Verhältnis "Plasma - Zelle" (normalerweise befinden sich 80 mÄq Kalium in der Zelle und 5 mÄq im Plasma). Asymmetrie des elektrophysiologisch-metabolischen Fokus des Myokards durch Ischämie, Entzündung, Reperfusion während der Thrombolyse. Elektrophysiologische Schwäche des überlegenen Schrittmachers. Angeborene akzessorische Leitungsbahnen. Die paroxysmale supraventrikuläre Tachykardie ist ein plötzlicher Herzschlaganfall mit einer Frequenz von 150-250 Schlägen pro Minute. Es gibt 3 Formen: 1) Vorhof; 2) Knoten; 3) Ventrikel. Die Ätiologie der supraventrikulären paroxysmalen Tachykardie ist häufiger mit einer Zunahme der Aktivität des sympathischen Nervensystems verbunden. Es äußert sich klinisch durch einen plötzlichen Anfall des Herzschlags, die Gefäße des Halses pulsieren, die Herzaktivität wechselt in einen anderen Rhythmus. Die Dauer des Angriffs beträgt einige Minuten bis zu mehreren Tagen. Die Anzahl der Herzschläge in der ventrikulären Form liegt normalerweise im Bereich von 150-180 Schlägen pro Minute, bei supraventrikulären Formen - 180-240 Schlägen pro Minute. Während eines Anfalls ist ein pendelartiger Rhythmus charakteristisch auskultatorisch, es gibt keinen Unterschied zwischen I- und II-Ton. Es erhöht den myokardialen Sauerstoffbedarf und kann einen Anfall von akuter Koronarinsuffizienz hervorrufen. EKG-Zeichen 1. QRS-Komplexe werden nicht verändert. 2. In der supraventrikulären Form verschmilzt die P-Welle mit T. 22. Ventrikuläre Extrasystole. AV-Überleitungsstörung Eine ventrikuläre Extrasystole ist das Auftreten eines außergewöhnlich breiten, deformierten QRS-Komplexes, einer diskordanten ST- und T-Verschiebung, einer vollständigen kompensatorischen Pause (das Intervall zwischen der prä- und post-extrasystolischen P-Welle ist gleich dem Doppelten des normalen RR-Intervalls). Das Mittel der Wahl ist Lidocain, das nach obigem Schema verabreicht wird. Vielleicht die Verwendung von Cordaron in einer Dosis von 300-450 mg intravenös tropfen. Verletzung der AV-Überleitung mit der Entwicklung einer Synkope (Morgagni-Adams-Stokes-Syndrom) Wenn die Leitung gestört ist, treten verschiedene Arten von Herzblöcken auf, es kommt zu einer Verlangsamung oder vollständigen Unterbrechung der Impulsleitung durch das Leitungssystem des Herzens. Die sinoaurikuläre Blockade ist durch eine Dysfunktion der T-Zellen und eine gestörte Reizleitung vom Sinusknoten zu den Vorhöfen gekennzeichnet. Es gibt 3 Grad. Ich grad - Verlangsamung des Impulses. Auf dem EKG - Verlängerung des PQ-Intervalls um mehr als 0,20 s. Prolaps des QRS-Komplexes. Das RR-Intervall ist stabil. Grad II - Verlust eines Teils der Impulse, unvollständige Leitung. Mobitz Typ I - Während die Impulse ausgeführt werden, verlängert sich das PQ-Intervall allmählich bis zum vollständigen Verlust der Pulswelle. QRS wird nicht geändert. An der Stelle des QRS-Prolaps ist die größte Distanz RR. Prognostisch ist dieser Typ relativ günstig. Mobitz Typ II mit konstantem PQ-Intervall und unverändertem QRS-Komplex. Gleichzeitig erreichen nicht alle Impulse die Ventrikel - in einigen Fällen wird jeder zweite Impuls ausgeführt, in anderen - jeder dritte usw., d. H. Es kommt zu einem periodischen Prolaps des QRS-Komplexes 3: 2, 4: 3 , 5: 6 usw. d. Grad III - vollständige Leitungsblockade. Gleichzeitig hört die Impulsleitung zu den Ventrikeln vollständig auf, in den Ventrikeln entsteht ein eigener heterotopischer Fokus des idioventrikulären Rhythmus, und je niedriger der Automatismus, desto schwieriger die Klinik. Es wird eine vollständige Dissoziation beobachtet: Der atriale Rhythmus ist nahezu normal und die Ventrikel haben ihre eigene Frequenz - 40 Schläge pro Minute oder weniger. Letzteres hängt von der Höhe des Schadens ab: Wenn der AV-Knoten leidet, 40-50 Schläge pro 1 Minute, wenn das Bein des His-Bündels 20 Schläge pro 1 Minute oder weniger beträgt. Das Ausmaß der Schädigung wird auch durch den Deformationsgrad des QRS-Komplexes angezeigt. Die Herztöne sind geschwächt, periodisch ertönt ein "Kanonen" -I-Ton, wenn die Systole der Vorhöfe und Ventrikel zeitlich fast zusammenfällt. Kann III zusätzlicher Ton sein. An der Herzbasis können systolische Auswurfgeräusche auftreten. Oft wird ein Pulsieren der Venen im Zusammenhang mit Vorhofkontraktionen gefunden, besonders ausgeprägt bei Strazheskos Kanonentonus. Клиника Versagen des Herzens, wenn ein Impuls ausfällt. Schwindel, wenn mehrere Impulse ausfallen. Morgagni-Adams-Stokes-Syndrom (Bewusstlosigkeit), wenn 6-8 Komplexe herausfallen. Behandlung Um einen angemessenen Rhythmus wiederherzustellen, wird Atropin in einer Dosis von 0,5-1 mg bis 3 mg verabreicht. Alle 3 Minuten 1 mg bis zu einer Gesamtdosis von 0,4 mg/kg. Calciumantagonisten – Isoptin 0,04 mg/kg. Bei häufigem Bewusstseinsverlust wird der Patient auf eine dauerhafte Elektropulstherapie umgestellt. Aber häufiger muss das Pacing "on demand" erfolgen. 23. Ursachen des akuten Nierenversagens Akute Niereninsuffizienz (ARF) ist eine Komplikation einer Reihe von Nieren- und extrarenalen Erkrankungen, die durch eine starke Verschlechterung oder Einstellung der Nierenfunktion gekennzeichnet ist und sich durch den folgenden Symptomenkomplex manifestiert: Oligoanurie, Azotämie, Hyperhydratation, Beeinträchtigung des CBS und des Wasser- und Elektrolythaushalts. Zu den OOP-Formen gehören: 1) prärenal (hämodynamisch); 2) renal (parenchymal); 3) postrenal (obstruktiv); 4) Arenen. Gründe für die Entwicklung des prärenalen akuten Nierenversagens. 1. Verringertes Herzzeitvolumen (kardiogener Schock, paroxysmale Arrhythmie, Herztamponade, Lungenembolie, dekompensierte Herzinsuffizienz). 2. Reduzierter Gefäßtonus (Sepsis, infektiös-toxischer Schock, anaphylaktischer Schock, Überdosierung von Antihypertensiva). 3. Verringertes effektives intravaskuläres Volumen (Blutverlust, Plasmaverlust, Dehydratation - Verlust von 7-10% des Körpergewichts). 4. Verletzung der intrarenalen Hämodynamik (Einnahme von NSAIDs, ACE-Hemmern, röntgendichten Medikamenten, Sandimmun). 5. Wasservergiftung - Hyperhydratation (unkontrollierte Produktion von ADH bei bösartigen Tumoren, entzündlichen Erkrankungen des Zentralnervensystems, Überdosierung von Medikamenten - Medikamente, Barbiturate, antidiabetische Sulfanilamid-Medikamente, Indomethacin, Amitriptylin, Cyclophosphamid). Gründe für die Entwicklung von renalem akutem Nierenversagen. 1. Ischämie der Niere. 2. Nephrotoxische Schädigung durch Exposition gegenüber: 1) Medikamente (Aminoglykoside, NSAIDs, röntgendichte Medikamente usw.); 2) industrielle Nephrotoxine (Schwermetallsalze); 3) Haushalts-Nephrotoxine (Ethylenglykol, Methylalkohol, Dichlorethan, Tetrachlorkohlenstoff). 3. Intratubuläre Obstruktion durch Pigmente: 1) Hämoglobin; 2) Urate; 3) Myoglobin; 4) entzündliche Prozesse; 5) nekrotische Papillitis (Diabetes mellitus, Analgetikum, alkoholische Nephropathie); 6) Gefäßpathologie. Gründe für die Entwicklung des postrenalen akuten Nierenversagens. 1. Pathologie der Harnleiter: 1) Behinderung; 2) Kompression. 2. Pathologie der Blase. 3. Harnröhrenstriktur. 24. Klinik und Behandlung des akuten Nierenversagens Es gibt fünf Stadien im klinischen Verlauf des akuten Nierenversagens. Stadium I des akuten Nierenversagens ist initial und dauert vom Zeitpunkt des Auftretens des ätiologischen Faktors bis zum Auftreten der ersten Anzeichen. In diesem Stadium zielen therapeutische Taktiken darauf ab, die Auswirkungen des ätiologischen Faktors zu beseitigen oder zu mildern: Anti-Schock-Therapie, Auffüllen des BCC, Bekämpfung von Herzinsuffizienz, alkalisierende Therapie für intravaskuläre Hämolyse, Bekämpfung von Schmerzen, Behandlung von septischen Zuständen usw. Zusammen mit ätiologischen Therapie wird der Krampf der Nierengefäße unter der Kontrolle der stündlichen Diurese beseitigt. Je früher mit der Diuresestimulation begonnen wird, desto besser ist die Prognose. Das Stadium II des akuten Nierenversagens oder oligoanurischen Versagens ist durch eine Funktionsstörung von 70 % der Nephrone gekennzeichnet. Eine Urinausscheidung von weniger als 500 ml pro Tag weist auf die Entwicklung einer Oligurie hin, und ein Rückgang auf 50 ml pro Tag oder weniger weist auf eine Anurie hin. Neben der eingeschränkten Wasserausscheidungsfähigkeit der Nieren leiden auch die Konzentrations- und Stickstoffausscheidungsfunktionen. Die Menge an Elektrolyten und Stickstoff im Urin nimmt stark ab. In diesem Stadium treten die stärksten Veränderungen der Blutstillung auf. Die Behandlung sollte auf die Konstanz des inneren Milieus abzielen, um dem Nierenepithel Zeit und Gelegenheit zu geben, sich zu regenerieren. Durch den Elektrolytverlust bei Erbrechen und Durchfall entsteht ein Zustand der Hyperhydratation. Daher ist es notwendig, die Diurese zu stimulieren, aber nur unter der Kontrolle des CVP. Verbesserung der Nierendurchblutung. Da eine strenge Kontrolle der Diurese erforderlich ist, wird eine Blasenkatheterisierung durchgeführt. Eine Verletzung der Stickstoffausscheidungsfunktion der Nieren führt zu Azotämie. Um den Proteinabbau im Körper zu maximieren, ist es daher erforderlich, eine ausreichende Menge an Kohlenhydraten einzuführen. Bei schwerem und nicht behandelbarem Verlauf werden Hämodialysesitzungen durchgeführt. Wenn der ätiologische Faktor entfernt wird, beginnt die Diurese nach 5-7 Behandlungstagen zuzunehmen. Die maximale Dauer dieser Phase beträgt bis zu 2 Wochen. III. Stadium des akuten Nierenversagens - frühe Polyurik. Es zeichnet sich durch eine progressive Erhöhung der Diurese (um 200-300 ml pro Tag) auf bis zu 3 Liter aus. Die Stickstoffausscheidungs- und Konzentrationsfunktionen der Nieren haben sich noch nicht vollständig erholt, aber die Konzentration von Kalium, Magnesium und Phosphaten normalisiert sich allmählich. Die Intensivtherapie im frühen polyurischen Stadium sollte die gleichen Maßnahmen wie im vorangegangenen beinhalten, mit Ausnahme der Stimulierung der Diurese. Oft ist eine Hämodialyse erforderlich. Es besteht ein hohes Risiko der Austrocknung. IV Stadium des akuten Nierenversagens - späte Polyurie. Die tägliche Zunahme des Urins erreicht 500-1000 ml und die Diurese kann 8-10 Liter pro Tag oder mehr erreichen. In den Nieren beginnen sich die Ionenaustauschprozesse zu erholen. Die Verluste an Kalium, Magnesium, Phosphor und anderen Elektrolyten nehmen stark zu, die Patienten sind von Dehydration und Demineralisierung bedroht. Daher werden in diesem Stadium Elektrolyte und Flüssigkeit intravenös verabreicht. Stufe V OPN oder Erholungsphase. Die Konzentrationsfunktion der Nieren wird wiederhergestellt. Die Diurese beginnt allmählich auf normal zu sinken (2-3 Liter pro Tag) und die Urindichte nimmt zu (1008-1028). 25. Akute Leberinsuffizienz Akutes Leberversagen ist ein Symptomkomplex, der durch eine Verletzung einer oder mehrerer Leberfunktionen aufgrund einer akuten oder chronischen Schädigung seines Parenchyms gekennzeichnet ist. Die klinischen Manifestationen von ARF sind wie folgt. 1. Koagulopathie wird durch einen Mangel an Gerinnungsfaktoren und eine Zunahme der fibrinolytischen Aktivität verursacht. Es prädisponiert zu spontanen Blutungen aus den Schleimhäuten: Magen-Darm-, Uterus- und Nasenblutungen können beobachtet werden. Hirnblutungen sind möglich. Um den Zustand des Hämostasesystems zu beurteilen, wird die Prothrombinzeit bestimmt. 2. Hypoglykämie ist durch einen hohen Insulinspiegel im Plasma gekennzeichnet, der auf eine verminderte Aufnahme durch die Leber zurückzuführen ist. Es führt zu einer raschen Verschlechterung des neurologischen Status und zum Tod der Patienten. 3. Verletzungen des Wasser-Elektrolyt- und Säure-Basen-Gleichgewichts. Akutes Nierenversagen im Endstadium ist durch Hyponatriämie, Hypophosphatämie, Hypokalzämie und Hypomagnesiämie gekennzeichnet. Die Änderung des Säure-Base-Zustandes hat keine eindeutige Richtung. Eine respiratorische Alkalose, die mit einer Stimulation des Atemzentrums durch toxische Substanzen einhergeht, kann aufgrund eines erhöhten intrakraniellen Drucks und einer Unterdrückung der Atemaktivität durch eine respiratorische Azidose ersetzt werden. Bei der Entwicklung des hepatischen Komas als schwerem Krankheitsverlauf werden die Stadien Präkoma, drohendes Koma und eigentliches Koma unterschieden. Es gibt auch hepatozelluläres (endogenes) Koma, das aus einer massiven Nekrose des Parenchyms resultiert, portokaval (Bypass, Shunt, exogen), aufgrund eines signifikanten Ausschlusses der Leber von Stoffwechselprozessen aufgrund des Vorhandenseins ausgeprägter portokavaler Anastomosen, und gemischtes Koma, das hauptsächlich bei Leberzirrhose auftritt. In der präkomatösen Phase entwickeln sich fortschreitende Anorexie, Übelkeit, eine Abnahme der Lebergröße, eine Zunahme der Gelbsucht, Hyperbilirubinämie und eine Zunahme des Gehalts an Gallensäuren im Blut. In Zukunft nehmen neuropsychische Störungen, Denkverlangsamung, Depression und manchmal Euphorie zu. Gekennzeichnet durch Stimmungsschwankungen, Reizbarkeit, Gedächtnisstörungen, Schlafstörungen. Sehnenreflexe nehmen zu, ein leichtes Zittern der Gliedmaßen ist charakteristisch. Azotämie entwickelt sich. Bei rechtzeitiger Therapie können Patienten aus diesem Zustand herauskommen, aber häufiger kommt es bei schweren irreversiblen Veränderungen in der Leber zu Koma. Während der Zeit des Komas ist eine Erregung möglich, die dann durch Depression (Stupor) und eine fortschreitende Bewusstseinsstörung bis hin zum vollständigen Verlust abgelöst wird. Es entwickeln sich meningeale Phänomene, pathologische Reflexe, motorische Unruhe, Krämpfe. Die Atmung ist gestört (wie Kussmaul, Cheyne-Stokes); der Puls ist klein, arrhythmisch; es liegt Unterkühlung vor. Das Gesicht des Patienten ist hager, die Extremitäten sind kalt, ein charakteristischer süßer Lebergeruch kommt aus Mund und Haut, hämorrhagische Phänomene verstärken sich (Hautblutungen, Blutungen aus der Nase, Zahnfleisch, Krampfadern der Speiseröhre usw.). 26. Behandlung von akutem Leberversagen Eine rechtzeitige inotrope Unterstützung ist ein wesentlicher Bestandteil der Intensivmedizin. Prävention von infektiösen Komplikationen - die Ernennung von Cephalosporin-Antibiotika in Kombination mit Antimykotika (Amphotericin-B). Hepatoprotektoren und membranstabilisierende Medikamente: Prednisolon bis zu 300 mg, Vitamin C 500 mg, Troxevasin 5 ml, Natriumetamsylat 750 mg, Essentiale 30 ml, Tocopherol 4 ml intramuskulär, Cytomak 35 mg, Cocarboxylase 300 mg, Nicotinsäure 30-40 mg, Com-Plamin 900 mg, Sirepar 5-10 ml, Glutaminsäure 1% 400 ml, Vikasol 10 ml intravenös, B-Vitamine. Protease-Inhibitoren, die Cortri-cal 100 Einheiten, Trasylol 400 Einheiten, Antagonosan, Go-Dox enthalten. Stimulierung der Diurese: Reogluman 400 ml, Mannitol, Lasix bis zu 200 mg intravenös, Eufillin 240 mg. Zur Korrektur der Koagulopathie wird die intravenöse Verabreichung von Vitamin K (10 mg pro Tag für 3 Tage) verwendet. Die Wirkung tritt nach 3 Stunden ein.In diesem Fall die Beseitigung der Hypoprothrombinämie, die mit einer gestörten Aufnahme von Vitamin K verbunden ist, die aus einem Mangel an Gallensäuren resultiert. Bei Blutungen oder Verdacht auf invasive Eingriffe (Gefäßkatheterisierung, Peritonealdialyse) wird Thrombozytenmasse oder gefrorenes Frischplasma intravenös verabreicht. Ein Hirnödem ist eine häufige Todesursache. Mannitol wird in einer Menge von 1 g/kg Körpergewicht verabreicht. Bei Patienten mit Niereninsuffizienz wird Mannit in Kombination mit Ultrafiltration verschrieben, um Hyperosmolarität und Überwässerung zu vermeiden. Mit der Entwicklung von Leberkoma wird Kaliumchlorid (0,4-0,5% ige Lösung in einer 5% igen Glucoselösung mit einem Volumen von 500 ml intravenös tropfen) oder Natriumbicarbonatlösung (mit metabolischer Azidose) verschrieben; Patienten atmen befeuchteten Sauerstoff durch einen Nasenkatheter ein. Bei einer Abnahme sowohl des arteriellen als auch des venösen Drucks werden Polyglucin und Albumin intravenös verabreicht. Bei massiven Blutungen werden geeignete Maßnahmen ergriffen, um sie zu stoppen, Blut einer Gruppe transfundiert und Medikamente verabreicht, die Blutgerinnungsfaktoren enthalten. Bei deutlichen Anzeichen einer disseminierten intravaskulären Gerinnung wird Heparin intravenös in einer Dosis von 10–000 IE Bolus verabreicht. Bei Nierenversagen werden Peritonealhämodialyse und Plasmapherese durchgeführt, die ein gutes Ergebnis liefern, aber vor der Durchführung dieser Manipulationen ist die Einführung von Heparin kontraindiziert. Um psychomotorische Unruhe und Krampfanfälle zu stoppen, werden Diprazin, Haloperidol und Natriumoxybutyrat verschrieben. In schweren Fällen auf Intubation und mechanische Beatmung zurückgreifen. Es ist wichtig, sich daran zu erinnern, dass das Blutungsrisiko hoch ist, daher müssen alle Manipulationen mit äußerster Vorsicht durchgeführt werden. Wenn der Patient aus dem Koma geholt wird, ist der nächste Schritt eine intensive Therapie der Grunderkrankung. 27. Schock Der Schock ist eine Form eines kritischen Zustands des Körpers, der sich durch multiple Organfunktionsstörungen äußert, sich kaskadenartig auf der Grundlage einer generalisierten Kreislaufkrise entwickelt und in der Regel ohne Behandlung zum Tode führt. Ein Schockfaktor ist jede Wirkung auf den Körper, die adaptive Mechanismen in ihrer Stärke übersteigt. Im Schock verändern sich die Funktionen der Atmung, des Herz-Kreislauf-Systems und der Nieren, die Prozesse der Mikrozirkulation von Organen und Geweben und Stoffwechselvorgänge werden gestört. Der Schock ist eine Krankheit polyätiologischer Natur. Je nach Ätiologie des Auftretens können die Arten des Schocks unterschiedlich sein. 1. Traumatischer Schock: 1) bei mechanischen Verletzungen - Knochenbrüche, Wunden, Kompression von Weichteilen usw.; 2) mit Brandverletzungen (thermische und chemische Verbrennungen); 3) unter dem Einfluss niedriger Temperatur - Kälteschock; 4) bei elektrischen Verletzungen - elektrischer Schlag. 2. Hämorrhagischer oder hypovolämischer Schock: 1) entwickelt sich als Folge von Blutungen, akutem Blutverlust; 2) Infolge einer akuten Verletzung des Wasserhaushalts kommt es zu einer Austrocknung des Körpers. 3. Septischer (bakteriell-toxischer) Schock (generalisierte eitrige Prozesse, die durch gramnegative oder grampositive Mikroflora verursacht werden). 4. Anaphylaktischer Schock. 5. Kardiogener Schock (Myokardinfarkt, akute Herzinsuffizienz). Berücksichtigt im Abschnitt Notfallbedingungen in der Kardiologie. Bei allen Arten von Schock ist der Hauptmechanismus der Entwicklung die Vasodilatation, und infolgedessen nimmt die Kapazität des Gefäßbetts zu, Hypovolämie - das Volumen des zirkulierenden Blutes (BCC) nimmt ab, da es verschiedene Faktoren gibt: Blutverlust, Umverteilung von Flüssigkeit zwischen Blut und Gewebe oder eine Fehlanpassung des normalen Blutvolumens, wodurch die Gefäßkapazität erhöht wird. Die daraus resultierende Diskrepanz zwischen BZK und Kapazität des Gefäßbettes liegt der Abnahme des Herzzeitvolumens und Störungen der Mikrozirkulation zugrunde. Letzteres führt zu gravierenden Veränderungen im Körper, da hier die Hauptfunktion des Blutkreislaufs ausgeübt wird - der Stoff- und Sauerstoffaustausch zwischen Zelle und Blut. Es kommt zu einer Verdickung des Blutes, einer Erhöhung seiner Viskosität und einer intrakapillären Mikrothrombose. Anschließend werden Zellfunktionen bis zu ihrem Tod gestört. In Geweben beginnen anaerobe Prozesse gegenüber aeroben zu überwiegen, was zur Entwicklung einer metabolischen Azidose führt. Die Ansammlung von Stoffwechselprodukten, hauptsächlich Milchsäure, verstärkt die Azidose. 28. Anaphylaktischer Schock Anaphylaktischer Schock ist ein Komplex verschiedener allergischer Reaktionen vom Soforttyp, die einen extremen Schweregrad erreichen. Es gibt folgende Formen des anaphylaktischen Schocks: 1) kardiovaskuläre Form, bei der sich ein akutes Kreislaufversagen entwickelt, das sich durch Tachykardie manifestiert, oft mit Herzrhythmusstörungen, Kammer- und Vorhofflimmern und Blutdruckabfall; 2) Atmungsform, begleitet von akutem Atemversagen: Atemnot, Zyanose, Stridor, sprudelnde Atmung, feuchte Rasseln in der Lunge. Dies ist auf eine Verletzung der Kapillarzirkulation, eine Schwellung des Lungengewebes, des Kehlkopfes, der Epiglottis zurückzuführen; 3) zerebrale Form aufgrund von Hypoxie, gestörter Mikrozirkulation und Hirnödem. Je nach Schwere des Verlaufs werden 4 Grade des anaphylaktischen Schocks unterschieden. I Grad (leicht) ist gekennzeichnet durch Juckreiz der Haut, das Auftreten eines Hautausschlags, Kopfschmerzen, Schwindel, ein Gefühl der Kopfrötung. Grad II (mäßig) - Quincke-Ödem, Tachykardie, Senkung des arteriellen Drucks, Erhöhung des Algover-Index gesellen sich zu den zuvor angegebenen Symptomen. Grad III (schwer) manifestiert sich durch Bewusstlosigkeit, akutes respiratorisches und kardiovaskuläres Versagen (Atemnot, Zyanose, Stridoratmung, kleiner schneller Puls, starker Blutdruckabfall, hoher Algover-Index). Grad IV (extrem schwer) wird begleitet von Bewusstlosigkeit, schwerer Herz-Kreislauf-Insuffizienz: Der Puls wird nicht bestimmt, der Blutdruck ist niedrig. Behandlung 1. Intravenöse Adrenalininfusion bis zur hämodynamischen Stabilisierung. Sie können Dopmin 10-15 mcg / kg / min und mit Symptomen von Bronchospasmus und b - Adrenomimetika verwenden: Alupent, Brikanil-Tropf intravenös. 2. Infusionstherapie in einem Volumen von 2500-3000 ml unter Einbeziehung von Polyglucin und Rheopolyglucin, es sei denn, die Reaktion wird durch diese Arzneimittel verursacht. Natriumbicarbonat 4% 400 ml, Glukoselösungen zur Wiederherstellung von BCC und Hämodynamik. 3. Membranstabilisatoren intravenös: Prednisolon bis zu 600 mg, Ascorbinsäure 500 mg, Troxevasin 5 ml, Natriumetamsylat 750 mg, Cytochrom C 30 mg (Tagesdosen sind angegeben). 4. Bronchodilatatoren: Eufillin 240-480 mg, Noshpa 2 ml, Alupent (Brikanil) 0,5 mg Tropf. 5. Antihistaminika: Diphenhydramin 40 mg (Suprastin 60 mg, Tavegil 6 ml), Cimetidin 200-400 mg intravenös (Tagesdosen sind angegeben). 6. Protease-Inhibitoren: Trasylol 400 U, Contrical 100 U. 29. Traumatischer Schock Traumatischer Schock ist ein pathologischer und kritischer Zustand des Körpers, der als Reaktion auf eine Verletzung entstanden ist und bei dem die Funktionen lebenswichtiger Systeme und Organe beeinträchtigt und gehemmt sind. Beim Traumaschock werden torpide und erektile Phasen unterschieden. Zum Zeitpunkt des Auftretens kann der Schock primär (1-2 Stunden) und sekundär (mehr als 2 Stunden nach der Verletzung) sein. Erektile Phase oder Phase des Auftretens. Das Bewusstsein bleibt, der Patient ist blass, unruhig, euphorisch, unzureichend, kann schreien, irgendwohin rennen, ausbrechen usw. In diesem Stadium wird Adrenalin freigesetzt, wodurch Druck und Puls einige Zeit normal bleiben können. Die Dauer dieser Phase beträgt einige Minuten und Stunden bis zu mehreren Tagen. Aber in den meisten Fällen ist es kurz. Die torpide Phase ersetzt die erektile Phase, wenn der Patient lethargisch und adynamisch wird, der Blutdruck sinkt und eine Tachykardie auftritt. Schätzungen zur Schwere der Verletzung sind in der Tabelle angegeben. Beurteilung des Ausmaßes der Verletzungsschwere
Nach der Berechnung der Punkte wird die resultierende Zahl mit einem Koeffizienten (von 1,2 bis 2,0) multipliziert. Behandlung. Die Hauptrichtungen in der Behandlung. 1. Eliminierung der Wirkung des traumatischen Agens. 2. Beseitigung von Hypovolämie. 3. Beseitigung von Hypoxie. 30. Hämorrhagischer Schock Der hämorrhagische Schock ist ein Zustand akuter kardiovaskulärer Insuffizienz, der sich nach einem erheblichen Blutverlust entwickelt und zu einer Abnahme der Durchblutung lebenswichtiger Organe führt. Ätiologie: Verletzungen mit Schäden an großen Gefäßen, akute Magen- und Zwölffingerdarmgeschwüre, Ruptur eines Aortenaneurysmas, hämorrhagische Pankreatitis, Ruptur der Milz oder Leber, Ruptur der Eileiter oder Eileiterschwangerschaft, Vorhandensein von Plazenta-Läppchen in der Gebärmutter usw. Je nach klinischen Daten und der Größe des Blutvolumenmangels werden folgende Schweregrade unterschieden. 1. Nicht ausgedrückt - es gibt keine klinischen Daten, der Blutdruck ist normal. Das Blutverlustvolumen beträgt bis zu 10% (500 ml). 2. Schwach - minimale Tachykardie, leichter Blutdruckabfall, einige Anzeichen einer peripheren Vasokonstriktion (kalte Hände und Füße). Das Blutverlustvolumen beträgt 15 bis 25% (750-1200 ml). 3. Moderat - Tachykardie bis zu 100-120 Schlägen pro Minute, Abnahme des Pulsdrucks, systolischer Druck 1-90 mm Hg. Art., Angst, Schwitzen, Blässe, Oligurie. Das Blutverlustvolumen beträgt 100 bis 25% (35-1250 ml). 4. Schwer - Tachykardie mehr als 120 Schläge pro Minute, systolischer Druck unter 60 mm Hg. Art., oft nicht durch das Tonometer bestimmt, Benommenheit, extreme Blässe, kalte Extremitäten, Anurie. Das Blutverlustvolumen beträgt mehr als 35% (mehr als 1750 ml). Labor in der allgemeinen Analyse von Blut, eine Abnahme des Hämoglobinspiegels, der Erythrozyten und des Hämatokrits. Das EKG zeigt unspezifische Veränderungen der ST-Strecke und der T-Welle, die auf eine unzureichende Koronardurchblutung zurückzuführen sind. Die Behandlung des hämorrhagischen Schocks umfasst je nach Situation das Stillen von Blutungen, die Anwendung einer Infusionstherapie zur Wiederherstellung des BCC, die Anwendung von Vasokonstriktoren oder Vasodilatatoren. Die Infusionstherapie beinhaltet die intravenöse Verabreichung von Flüssigkeit und Elektrolyten in einem Volumen von 4 Litern (Kochsalzlösung, Glucose, Albumin, Polyglucin). Bei Blutungen ist eine Transfusion von Blut und Plasma einer einzelnen Gruppe in einem Gesamtvolumen von mindestens 4 Dosen (1 Dosis = 250 ml) indiziert. Die Einführung von Hormonarzneimitteln wie Membranstabilisatoren (Prednisolon 90-120 mg) wird gezeigt. Je nach Ätiologie wird eine spezifische Therapie durchgeführt. 31. Septischer Schock Unter septischem Schock versteht man das Eindringen eines Infektionserregers von seiner ursprünglichen Quelle in das Blutsystem und seine Ausbreitung im gesamten Körper. Die Erreger können sein: Staphylokokken, Streptokokken, Pneumokokken, Meningokokken und Enterokokken sowie Escherichia, Salmonella und Pseudomonas aeruginosa usw. Der septische Schock geht mit einer Funktionsstörung des Lungen-, Leber- und Nierensystems einher, einer Verletzung der Blutgerinnung System, das zum Auftreten eines thrombohämorrhagischen Syndroms (Machabeli-Syndrom) führt, das sich in allen Fällen einer Sepsis entwickelt. Der Verlauf einer Sepsis wird von der Art des Erregers beeinflusst, was bei modernen Behandlungsmethoden besonders wichtig ist. Laborbefunde deuten auf eine fortschreitende Anämie hin (aufgrund von Hämolyse und Hemmung der Hämatopoese). Leukozytose bis 12 χ 109/lIn schweren Fällen kann jedoch auch eine Leukopenie beobachtet werden, da sich eine starke Depression der hämatopoetischen Organe bildet. Klinische Symptome des bakteriellen Schocks: Schüttelfrost, hohes Fieber, Hypotonie, trockene warme Haut - zuerst und später - kalt und nass, Blässe, Zyanose, psychische Störung, Erbrechen, Durchfall, Oligurie. Gekennzeichnet durch Neutrophilie mit Verschiebung der Leukozytenformel nach links bis hin zu Myelozyten; ESR steigt auf 30-60 mm/h oder mehr. Der Bilirubinspiegel im Blut ist erhöht (bis 35-85 µmol/l), was auch für den Gehalt an Reststickstoff im Blut gilt. Blutgerinnung und Prothrombinindex werden gesenkt (bis zu 50-70%), der Gehalt an Calcium und Chloriden wird reduziert. Das Gesamtblutprotein wird reduziert, was auf Albumin zurückzuführen ist, und der Gehalt an Globulinen (Alpha-Globulinen und β-Globulinen) steigt an. Im Urin Protein, Leukozyten, Erythrozyten und Zylinder. Der Chloridspiegel im Urin ist reduziert, Harnstoff und Harnsäure sind erhöht. Die Behandlung ist in erster Linie ätiologischer Natur. Daher ist es vor der Verschreibung einer antibakteriellen Therapie erforderlich, den Erreger und seine Empfindlichkeit gegenüber Antibiotika zu bestimmen. Antimikrobielle Wirkstoffe sollten in maximaler Dosierung eingesetzt werden. Zur Behandlung des septischen Schocks ist der Einsatz von Antibiotika erforderlich, die das gesamte Spektrum gramnegativer Mikroorganismen abdecken. Am sinnvollsten ist die Kombination von Ceftazidim und Impinem, die sich gegen Pseudomonas aeruginosa als wirksam erwiesen hat. Medikamente der Wahl beim Auftreten eines resistenten Erregers sind Medikamente wie Clindamycin, Metronidazol, Ticarcillin oder Imipinem. Wenn Staphylokokken aus dem Blut kultiviert werden, muss unbedingt mit der Behandlung mit Penicillin-Medikamenten begonnen werden. Die Behandlung von Hypotonie besteht in der ersten Behandlungsstufe in der Angemessenheit des intravaskulären Flüssigkeitsvolumens. Verwenden Sie kristalloide Lösungen (isotonische Natriumchloridlösung, Ringerlactat) oder Kolloide (Albumin, Dextran, Polyvinylpyrrolidon). Der Vorteil von Kolloiden besteht darin, dass beim Einbringen die erforderlichen Fülldrücke am schnellsten erreicht werden und lange anhalten. Wenn keine Wirkung eintritt, werden inotrope unterstützende und (oder) vasoaktive Medikamente eingesetzt. 32. Methylalkoholvergiftung Methylalkohol wird auf allen Wegen absorbiert – über die Atemwege, den Verdauungstrakt und transdermal. Die tödliche Methanoldosis liegt bei oraler Einnahme zwischen 40 und 250 ml, aber schon die Einnahme von 10 bis 20 ml kann zur Erblindung führen. Vergiftungen treten auch nach der Einnahme verschiedener alkoholischer Mischungen mit 1,5 bis 2,5 % Methanol auf. Nach der Absorption verteilt sich Methanol aufgrund seiner Wasserlöslichkeit im gesamten Gewebe. Die größte Menge reichert sich in den Nieren und im Magen-Darm-Trakt an, die kleinste im Gehirn, in der Muskulatur und im Fettgewebe. Pathologische anatomische Läsionen umfassen zerebrale Ödeme und Schäden an der anfänglich entzündlichen und später dystrophischen Natur der retinalen Ganglienzellen. In einigen Fällen werden neben einer Schädigung des Nervensystems degenerative Läsionen der Leber, der Nieren, der Lunge und des Herzmuskels gefunden. Bei der toxischen Wirkung von Methanol ist eine Zweiphasenwirkung zu unterscheiden. In der Anfangsphase (Phase I) wirkt Methanol als ganzes Molekül auf den Körper und hat eine überwiegend narkotische Wirkung, jedoch schwächer als die von Ethylalkohol. Anschließend (Phase II) zeigt sich die schädliche Wirkung von Oxidationsprodukten. Im Krankheitsbild werden Perioden unterschieden: Intoxikation, latentes oder relatives Wohlbefinden (mehrere Stunden bis 1-2 Tage), die Hauptmanifestationen der Intoxikation und bei günstigem Ausgang die umgekehrte Entwicklung. Je nach Schweregrad wird zwischen leicht, mittelschwer (oder ophthalmisch) und schwer (oder generalisiert) unterschieden. Bei leichter Vergiftung werden schnelle Ermüdung, Kopfschmerzen, Übelkeit und ein leichter Rauschzustand festgestellt, die nach einer Latenzzeit von 30 Minuten bis zu mehreren Stunden auftreten. Die gleichzeitige Aufnahme von Ethyl- und Methylalkohol verlängert die Latenzzeit und verringert die Schwere der Vergiftung. Behandlung 1. Stoppen des Eindringens von Gift in den Körper. Einstellung der Verwendung von Gift, Entfernung aus der kontaminierten Atmosphäre, Entfernung von Gift von der Haut. 2. Entfernung von nicht resorbiertem Gift (aus dem Magen-Darm-Trakt): 1) Sondenmagenspülung; 2) die Verwendung von Adsorptionsmitteln oder salzhaltigen Abführmitteln; 3) Reinigung oder Siphon-Einlauf. 3. Entfernung von absorbiertem Gift: 1) Erzwingen der Diurese; 2) Methoden der extrakorporalen Entgiftung (Hämosorption, Hämodialyse, Peritonealdialyse, Blutersatzchirurgie). 4. Antidottherapie, d.h. Neutralisation des Giftes durch physikalische oder chemische Neutralisation, sowie Konkurrenz mit dem Gift um Applikationspunkte. 5. Aufrechterhaltung der lebenswichtigen Funktionen des Körpers. 6. Normalisierung des Wasser-Elektrolyt-Säure-Basen-Zustands des Körpers. 7. Behandlung von Spätfolgen und Komplikationen. 33. Ethylalkohol- und Ethylenglykolvergiftung Bei Einnahme toxischer Dosen - Erregung, Ataxie, Benommenheit, Koma mit Hemmung der Reflexe, Alkoholgeruch aus dem Mund, Gesichtsrötung, Konjunktivitis, "Spielen" der Pupillen, Erbrechen, unfreiwilliges Wasserlassen, Tachykardie, "heisere" Atmung , Kollaps, Erbrechen mit möglicher Aspiration von Brechmittel wt. Behandlung Magenspülung durch eine dicke Sonde, gefolgt von der Einführung eines salzhaltigen Abführmittels, Siphoneinlauf. Subkutan 1 ml einer 0,1% igen Atropinlösung, 2 ml Cordiamin, 1 ml einer 20% igen Koffeinlösung, mit Kollaps - intramuskulär 1 ml einer 1% igen Lösung von Mezaton. In Abwesenheit von Pharynxreflexen - tracheale Intubation und mechanische Beatmung. Erzwingen der Diurese bei gleichzeitiger Verabreichung einer 4% igen Natriumbicarbonatlösung in einem nach der Astrup-Formel berechneten Volumen, hypertonischen (10 und 20%) Glucoselösungen mit Insulin, B- und C-Vitaminen, Cocarboxylase, Nikotinsäure. Bei Atemdepression - langsam intravenös 3-5 ml einer 1,5% igen Lösung von Etimizol, 10 ml einer 2,4% igen Lösung von Aminophyllin, 1 ml einer 5% igen Lösung von Ephedrin, Sauerstoffinhalation. Mit Aspiration - Notfallsanierungsbronchoskopie. Parenterale Antibiotika. Vergiftung durch Ethylenglykol (Frostschutzmittel). Die mittlere tödliche Dosis beträgt etwa 100 ml. Es wird schnell im Verdauungstrakt absorbiert und in allen Geweben verteilt, wodurch eine maximale Konzentration im Gehirn erreicht wird. Die hauptsächliche toxische Wirkung wird im Nierenparenchym beobachtet, wo sich eine Nekrose des tubulären Epithels, ein interstitielles Ödem und hämorrhagische Nekroseherde in der kortikalen Schicht entwickeln. Ödem wird im Gehirn gefunden. In der Intoxikationsklinik werden 3 Perioden unterschieden: 1) initial - Dauer bis zu 12 Stunden, Symptome einer ZNS-Schädigung durch die Art der Alkoholvergiftung überwiegen; 2) neurotoxisch – wenn die Symptome einer ZNS-Schädigung fortschreiten und Erkrankungen des Atmungs- und Herz-Kreislauf-Systems hinzukommen; 3) nephrotoxisch - am 2.-5. Tag überwiegt im klinischen Bild der Intoxikation die Nierenschädigung. Behandlung Magenspülung mit Wasser oder 2%iger Natriumbicarbonatlösung, gefolgt von der Einführung von 30 g Magnesiumsulfat in 200 ml Wasser. In 200 ml einer 30% igen Lösung von Ethylalkohol. 3-5 g Natriumbicarbonat in 100 ml Wasser. Reichlich trinken. Intramuskulär 1-2 ml Cordiamin, 1 ml einer 20%igen Koffeinlösung. Intravenös 400 ml 5%ige Glucoselösung mit 5 ml 5%iger Ascorbinsäurelösung und 8 IE Insulin, Glucoson-Vokain-Mischung, 400 ml Polyglucin, 400 ml Hemodez, 80-120 g Furosemid, 60-100 mg Prednisolon. 34. Dichlorethan-Vergiftung Die Haupteintrittswege sind der Verdauungstrakt, die Atemwege und die Haut. Die tödliche Dosis von DCE für Menschen bei oraler Verabreichung beträgt 10-20 ml. Die toxische Wirkung von DCE beruht auf der narkotischen Wirkung auf das Zentralnervensystem, einer Schädigung von Leber, Nieren, Magen-Darm-Trakt und einer ausgeprägten Wirkung auf das Herz-Kreislauf-System. Im klinischen Bild sind die führenden Symptome: toxische Enzephalopathie, akute toxische Gastritis und Gastroenteritis, gestörte äußere Atmung, toxische Hepatitis, eingeschränkte Nierenfunktion. In den ersten Stunden nach der Verabreichung treten Schwindel, Ataxie, psychomotorische Erregung, klonisch-tonische Krämpfe, Bewusstseinsdepression bis hin zum Koma auf. Eines der frühen Anzeichen einer Vergiftung sind Magen-Darm-Störungen in Form von Übelkeit, wiederholtes Erbrechen mit einer Beimischung von Galle. Eine Verletzung der Funktion der äußeren Atmung tritt häufig nach dem obstruktiven Aspirationstyp auf und ist mit erhöhtem Speichelfluss, Bronchorrhoe und Aspiration verbunden. Es werden eine Hemmung der Funktion des Atemzentrums, die Entwicklung einer Hypertonie der Atemmuskulatur und eine Steifheit der Brust festgestellt. Behandlung Bei Vergiftung mit Dämpfen - Entfernung des Opfers aus dem betroffenen Bereich, mit Atemdepression IVL. Wenn das Gift eindringt - Magenspülung durch eine dicke Sonde, gefolgt von der Einführung von 3-4 Esslöffeln Aktivkohlepulver in 200 ml Wasser und 150-200 ml Vaselineöl, Siphoneinlauf. Intravenös 20-40 ml 30%ige Natriumthiosulfatlösung, intramuskulär 5 ml 5%ige Unitiol-Lösung. intravenös 400 ml Polyglucin, 400 ml Hemodez, 400 ml 5% ige Glucoselösung, 80-120 mg Furosemid (Lasix), 6-8 ml 5% ige Ascorbinsäurelösung. Intramuskulär 2 ml Cordiamin, mit Kollaps - 1 ml einer 1% igen Lösung von Mezaton, 1 ml einer 20% igen Koffeinlösung, 100-150 mg Prednisolon. Mit zunehmendem Leber-Nierenversagen wird eine spezifische Therapie durchgeführt. Intravenöser Bolus 400 ml Polyglucin, 400 ml Hämodez, 400 ml 5 % Glucose, 80–120 mg Furosemid, 6–8 ml 5 % Ascorbinsäure, 100–150 mg Prednisolon, zum Kollaps 1 ml 1 % Mesaton. Intramuskulär 2–4 ml 6 %iges Thiaminbromid und 2–4 ml 5 %iges Pyridoxin. Bei psychomotorischer Erregung 1 ml 3%ige Phenozepam-Lösung. Einatmen von Sauerstoff bei Atemdepression – mechanische Beatmung durch einen Atemschlauch. Am ersten Tag ist die Peritonealdialyse die effektivste und schonendste Methode. Die Zusammensetzung der Standard-Dialyselösung umfasst: Kaliumchlorid 0,3 g, Natriumchlorid 8,3 g, Magnesiumchlorid 0,1 g, Calciumchlorid 0,3 g, Glucose 6 g pro 1 Liter Wasser. Gleichzeitig werden bis zu 2 Liter Elektrolytlösung mit Zusatz von 500 Einheiten Penicillin und 1000 Einheiten Heparin in die Bauchhöhle des Patienten injiziert. 35. Vergiftung mit Pilzgift und Schlangengift Nach einer Latenzzeit von 1-2 bis 36 Stunden treten krampfartige Bauchschmerzen, Speichelfluss, Übelkeit, unbeugsames Erbrechen, Durchfall, Dehydratation, Kollaps, Delirium, Halluzinationen, Krämpfe auf. Am 2-3. Tag - die Phänomene der Nieren-Leber-Insuffizienz mit Anurie, Azotämie, Gelbsucht. Bei schweren Vergiftungen mit Leinen und Morcheln ist eine Hämolyse möglich. Behandlung Magenspülung durch eine dicke Sonde, gefolgt von der Einführung von 3-4 Esslöffeln pulverisierter Aktivkohle in 200 ml Wasser und 30 g Magnesiumsulfat (Natrium) in 100 ml Wasser, Siphoneinlauf. Subkutan 1 ml einer 0,1% igen Atropinlösung, 2 ml Cordiamin. Bei einer Morchelvergiftung wird Atropin nicht als Gegenmittel eingesetzt. Intravenös 400 ml Polyglucin, 400 ml Gemodez, 400 ml 5%ige Glucoselösung mit 4-6 ml 5%iger Ascorbinsäurelösung, 80-120 mg Furosemid (Lasix). Intramuskulär 1-2 ml einer 6%igen Lösung von Thiaminbromid und 2 ml einer 5%igen Lösung von Pyridoxinhydrochlorid (nicht in einer Spritze injizieren). Linderung des Schmerzsyndroms intramuskulär mit der Einführung von 1 ml einer 0,2% igen Lösung von Platifillin, 2 ml einer 2% igen Lösung von Papaverin. Bei Krämpfen, psychomotorischer Erregung - intramuskulär 1-2 ml einer 3% igen Lösung von Fenozepam oder einer lytischen Mischung (1-2 ml einer 2,5% igen Lösung von Chlorpromazin, 1-2 ml einer 1% igen Lösung von Diphenhydramin, 5-10 ml 25 % Magnesiumsulfatlösung) unter Blutdruckkontrolle. Erzwingen der Diurese. In schweren Fällen - Hämosorption, frühe Hämodialyse. Symptomatische Therapie. Vergiftung durch Schlangengift Schmerzen und sich schnell ausbreitende Schwellung an der Bissstelle, Schläfrigkeit, Atemdepression, Kollaps, intravasale Hämolyse mit Hämoglobinurie, schwere subkutane Blutungen, manchmal Krämpfe. Möglicherweise Nierenversagen. Bei einem Kobrabiss sind lokale Veränderungen weniger stark ausgeprägt, bulbäre Störungen (Sprech- und Schluckstörungen, Ptosis, Lähmungen der motorischen Muskulatur) und Atemdepression überwiegen. Behandlung Absaugen von Blut und Lymphe aus der an der Bissstelle gebildeten Wunde (spätestens 30-60 Minuten nach dem Biss) mit einem Blutsaugbecher. Spülen der Wunde mit einer 1%igen Kaliumpermanganatlösung. Injektion von 0,3–0,5 ml einer 0,1 %igen Adrenalinlösung in die Wunde. Wenn möglich, dringende Gabe eines spezifischen mono- oder polyvalenten Anti-Schlangen-Serums nach vorheriger intravenöser Gabe von 100–150 ml Hydrocortison oder 50–100 ml Prednisolon. Bei Kobrabissen - intravenöses Anticobra-Serum in einer Dosis von 300 ml in Kombination mit 1 ml einer 0,05% igen Prozerinlösung und wiederholte Verabreichung alle 30 Minuten mit 1 ml einer 0,1% igen Atropinlösung. 36. Säure- und Arsenvergiftung Einatmen von Dämpfen verursacht Reizungen der Augen und der oberen Atemwege (Tränenfluss, laufende Nase, Husten, Atemnot). Ein reflektorischer Atemstillstand ist möglich. Nach einer Latenzzeit (von 2 bis 24 Stunden) bildet sich eine toxische Lungenentzündung oder ein toxisches Lungenödem. Beim Schlag ins Auge, auf der Haut - Verätzungen. Bei Verschlucken - Verätzung der Mundhöhle, des Rachens, der Speiseröhre, des Magens, mögliche Schwellung des Kehlkopfes mit Atemversagen. Wiederholtes Erbrechen mit Blut, Peritonealreizung und gelegentlich Perforation der Speiseröhre oder des Magens. Kollaps, Schock, hämorrhagisches Syndrom. Mögliche intravaskuläre Hämolyse, hämoglobinurische Nephrose mit akuter Niereninsuffizienz (Nieren-Leber-Insuffizienz). Schlauchlose Magenspülung und künstliches Erbrechen sind wegen der Möglichkeit einer erneuten Verbrennung der Speiseröhre und einer Säureaspiration gefährlich. Keine salzhaltigen Abführmittel und alkalischen Lösungen verabreichen. Behandlung Magenspülung durch eine dicke Sonde mit kaltem Wasser nach einer vorläufigen intravenösen oder intramuskulären Injektion von 1-2 ml einer 2% igen Promedol-Lösung. In Eisstücken Almagel A 15-20 ml jede Stunde. Intravenös 800 ml Polyglucin, 400 ml Hemodez, Glucoson-Vocain-Mischung (400 ml 5% ige Glucoselösung mit 25 ml 2% Novocain-Lösung), 50-150 mg Prednisolon oder 150-250 mg Hydrocortison, 10 Einheiten von Heparin, 80–120 mg Furosemid (Lasix). Eine Schmerzlinderung wird durch intravenöse Injektion von 1–2 ml 0,005 %iger Fentanyllösung und 2–4 ml 0,25 %iger Droperidollösung erreicht, bei anhaltenden Bauchschmerzen – intramuskuläre Injektion von 1–2 ml 0,2 %iger Platyphyllinlösung, 2 ml 2 % Papaverinlösung. Sauerstoffinhalation mit Antischaummittel. Mit zunehmender Schwellung des Kehlkopfes - intravenös 200–400 mg Prednisolon, 1–2 ml einer 1 %igen Diphenhydraminlösung, 10–20 ml einer 2,4 %igen Aminophyllinlösung, 1–2 ml einer 5 %igen Ephedrinlösung . Wenn keine Wirkung eintritt, Tracheotomie, Sauerstoffinhalation und ggf. mechanische Beatmung. Vergiftung mit Arsen und seinen Verbindungen: metallischer Geschmack im Mund, Bauchschmerzen, Erbrechen, weicher Stuhl, starke Dehydrierung, Krämpfe, Tachykardie, verminderter Blutdruck, Koma, akutes Nierenversagen. Bei einer Arsenwasserstoffvergiftung kommt es zu intravaskulärer Hämolyse und Hämoglobinurie. Behandlung Magenspülung durch eine dicke Sonde (2-3 mal täglich) mit der Einführung am Anfang und am Ende des Waschens von 50 ml einer 5% igen Lösung von Unithiol, wiederholte Siphon-Einläufe mit Zusatz von Unithiol. Fortsetzung der Antidottherapie intravenös oder intramuskulär mit der Einführung einer 5% igen Lösung von Unitiol (bis zu 300 ml pro Tag), intravenöser Tropf von 20 ml 10% Calciumtetacin (ED1A) in 400 ml einer 5% Glukoselösung. 37. Vergiftung mit Alkali, Atropin, Cannabis Alkalivergiftung Bei Einnahme kommt es zu einer Verätzung der Schleimhaut der Mundhöhle, der Speiseröhre und des Magens. Schmerzen entlang der Speiseröhre und im Unterleib, Erbrechen mit Blutbeimengung, Speiseröhren-Magen-Blutungen. Mögliche Perforation der Speiseröhre, Magen mit der Entwicklung von Mediastinitis, Peritonitis. Mit einer Verbrennung des Kehlkopfes - Heiserkeit der Stimme, Aphonie, Atembeschwerden (Stridor). In schweren Fällen - Brandschock, Oligurie. Hautkontakt verursacht Verätzungen. Behandlung wie bei Säurevergiftung. Atropinvergiftung Mundtrockenheit, Heiserkeit, trockene, hyperämische Haut, erweiterte Pupillen, Kurzatmigkeit, Herzklopfen, Tachykardie, Durst, Übelkeit, Schwierigkeiten beim Wasserlassen. Bei schwerer Vergiftung - psychomotorische Erregung, Delirium, Halluzinationen, Krämpfe, Herzrhythmusstörungen, Koma, Kollaps sind möglich. Behandlung Bei Bedarf - Magenspülung durch eine dicke Sonde, reichlich mit Vaselineöl geschmiert, die Einführung von 3-4 EL. l. Pulveraktivkohle in 200 ml Wasser und 30 mg Magnesiumsulfat in 100 ml Wasser. intravenös 2-4 ml 0,05% Proserinlösung, 400-800 ml 5% Glukoselösung, 40-80 mg Furosemid (Lasix). Reichlich trinken. Linderung psychomotorischer Unruhe und Anfälle durch intramuskuläre Verabreichung von 1–2 ml einer 3 %igen Lösung von Phenozepam oder einer lytischen Mischung (2 ml einer 2,5 %igen Lösung von Aminazin, 2 ml einer 1 %igen Lösung von Diphenhydramin und 10 ml einer 25 %ige Magnesiumsulfatlösung) oder 1-2 g Chloralhydrat in einem Einlauf mit 1-2 g Stärke pro 25-50 ml Wasser, intravenös 10-15 ml einer 20%igen Natriumhydroxybutyratlösung, 2-4 ml einer 0,5%igen Seduxenlösung. Bei schwerer Tachykardie, Extrasystole - intravenös Anaprilin (1-2 ml einer 0,25% igen Lösung) oder eine Anaprilin-Tablette (40 mg) unter der Zunge. Mit Kollaps - intravenös 1 ml einer 1% igen Lösung von Mezaton in 10 ml einer 0,9% igen Natriumchloridlösung. Mit einer scharfen Hyperthermie - intramuskulär 2 ml einer 50% igen Lösung von Analgin, Eispackungen auf großen Gefäßen und dem Kopf, feuchten Wickeln. Cannabisvergiftung (Haschisch, Marihuana, Marihuana, Plan) Es gibt Euphorie, psychomotorische Erregung, lebhafte visuelle Halluzinationen, erweiterte Pupillen, Tinnitus. Anschließend Schwäche, Lethargie, Stimmungstief, Schläfrigkeit, Bradykardie, Unterkühlung. Behandlung Bei oraler Vergiftung - Magenspülung durch eine dicke Sonde, gefolgt von der Einführung von 3-4 EL. l. Pulveraktivkohle in 200 ml Wasser. Intravenös 400-800 ml einer 5% igen Glucoselösung mit 5-10 ml einer 5% igen Ascorbinsäurelösung und 8-16 Einheiten Insulin, 40-80 mg Furosemid (Lasix), intramuskulär 2 ml einer 6% igen Lösung von Thiaminbromid. 38. Vergiftung mit Kokain, Dicain, narkotischen Analgetika Kokainvergiftung Es äußert sich klinisch durch allgemeine Unruhe, Kopfschmerzen, Gesichtsrötung, erweiterte Pupillen, Tachykardie, gesteigerte Atmung, erhöhten Blutdruck, Halluzinationen. In schweren Fällen - Krämpfe, Koma, Atemlähmung, Kollaps. Wiederholte Magenspülung durch eine dicke Sonde mit einer 0,1% igen Lösung von Kaliumpermanganat, gefolgt von der Einführung von 3-4 EL. l. Pulveraktivkohle in 200 ml Wasser und 30 g Magnesiumsulfat in 100 ml Wasser. Intravenös 400 ml Gemodez, 400 ml 5%ige Glucoselösung mit 5-10 ml 5%iger Ascorbinsäurelösung, 40-80 mg Furosemid (Lasix). Bei Erregung - Fixierung des Opfers intramuskulär 1-2 ml einer 3% igen Lösung von Fenozepam oder einer lytischen Mischung (1-2 ml einer 2,5% igen Lösung von Chlorpromazin, 2 ml einer 1% igen Lösung von Diphenhydramin und 5-10 ml von 25% - eine Lösung von Magnesiumsulfat) unter der Kontrolle des Blutdrucks. Bei Krämpfen werden 1-2 g Chloralhydrat in einem Einlauf mit 1-2 g Stärke in 25-50 ml Wasser verabreicht, intravenös langsam 15-20 ml einer 20% igen Natriumoxybutyratlösung, wenn keine Wirkung eintritt, langsam intramuskulär bis zu 20 ml einer 2,5% igen Lösung von Natriumthiopental oder Hexenal. Mit der Entwicklung eines Komas - ein Eisbeutel auf dem Kopf, intravenös 40 ml einer 40% igen Glucoselösung mit 4-6 ml einer 5% igen Ascorbinsäurelösung und 8 Einheiten Insulin, intravenös langsam oder intramuskulär 2-4 ml einer 6%igen Lösung von Thiaminbromid und 2–4 ml einer 5%igen Lösung von Pyridoxinhydrochlorid, 80–120 mg Furosemid. Bei schwerer Atemdepression wird eine mechanische Beatmung durchgeführt, intravenös langsam 2 ml Cordiamin, Sauerstoffinhalation. Vergiftung mit narkotischen Analgetika (Morphin, Omnopon, Droperidol) Benommenheit oder Bewusstlosigkeit, Pupillenverengung, Muskelhypertonus (manchmal Krämpfe), Atemdepression, Bradykardie, Kollaps. Eine Atemlähmung ist bei erhaltenem Bewusstsein des Patienten möglich. Magenspülung durch eine dicke Sonde (unter Aufrechterhaltung des Bewusstseins), gefolgt von der Einführung von 3-4 EL. l. Pulveraktivkohle und 30 g Natriumsulfat, Siphon-Einlauf. Intravenös 400 ml Gemodez, 400 ml Polyglucin, 400 ml 5% ige Glucoselösung, 60-80 mg Furosemid (Lasix). Subkutan 1-2 ml einer 0,1% igen Atropinlösung, 1-2 ml Cordiamin, 1 ml einer 20% igen Koffeinlösung. Mit der Entwicklung eines Komas - ein Eisbeutel auf dem Kopf, intravenös 40 ml einer 40% igen Glucoselösung mit 5-10 ml einer 5% igen Ascorbinsäurelösung und 8 Einheiten Insulin, intravenös langsam oder intramuskulär 2-4 ml einer 6%igen Lösung von Thiaminbromid und 2–4 ml einer 5%igen Lösung von Pyridoxinhydrochlorid, 80–120 mg Furosemid (Lasix). Bei Bedarf - Blasenkatheterisierung und Urinabsaugung. Mit Atemdepression - IVL, Sauerstoffinhalation. Hämosorption (2-3 mal täglich bis zur Wiederherstellung des Bewusstseins). 39. Schmerz Schmerz ist ein unangenehmer sensorischer und emotionaler Zustand, der durch reale oder potentielle pathologische Wirkungen auf Gewebe verursacht wird. Im ZNS werden Schmerzen entlang zweier Hauptwege geleitet. Spezifischer Pfad - die hinteren Hörner des Rückenmarks, spezifische Kerne des Thalamus, der Kortex des hinteren zentralen Gyrus. Dieser Weg ist niedrig-neuronal, schnell, leitet Schwellenschmerz, emotional ungefärbten, genau lokalisierten Schmerz (epikritischer Schmerz). Unspezifischer Weg - die Hinterhörner des Rückenmarks, unspezifische Kerne des Thalamus, die Rinde der Stirn- und Scheitellappen diffus. Leitet unterschwelligen, emotional gefärbten, schlecht lokalisierten Schmerz. Es ist langsam, multineuronal, da es zahlreiche Kollateralen zur Medulla oblongata, der Formatio reticularis, dem limbischen System und dem Hippocampus bildet. Unterschwellige Schmerzimpulse werden im Thalamus summiert. Impulse, die entlang der unspezifischen Schmerzbahn geleitet werden, erregen die emotionalen Zentren des limbischen Systems, die autonomen Zentren des Hypothalamus und die Medulla oblongata. Daher wird der Schmerz von Angst, schmerzhaften Erfahrungen, erhöhter Atmung, Puls, Blutdruckanstieg, Pupillenerweiterung, dyspeptischen Störungen begleitet. Der Wirkung des nozizeptiven Schmerzsystems wird durch das antinozezeptive System entgegengewirkt, dessen Hauptneuronen in der periaquäduktalen grauen Substanz lokalisiert sind (das Sylvius-Aquädukt verbindet die III- und IV-Ventrikel). Ihre Axone bilden absteigende Bahnen zur Medulla oblongata und zum Rückenmark und aufsteigende Bahnen zur Formatio reticularis, Thalamus, Hypothalamus, limbisches System, Basalganglien und Cortex. Die Mediatoren dieser Neuronen sind Pentapeptide: Methenkephalin und Leuenkephalin, die Methionin bzw. Leucin als endständige Aminosäuren haben. Enkephaline regen Opiatrezeptoren an. In enkephalinergen Synapsen befinden sich Opiatrezeptoren auf der postsynaptischen Membran, aber dieselbe Membran ist präsynaptisch für andere Synapsen. Opiatrezeptoren sind mit der Adenylatcyclase assoziiert und bewirken deren Hemmung, indem sie die cAMP-Synthese in Neuronen stören. Infolgedessen sinkt der Kalziumeintrag und die Freisetzung von Mediatoren, einschließlich Schmerzmediatoren - Peptiden: Substanz P, Cholecystokinin, Somatostatin, Glutaminsäure. Opiatrezeptoren werden nicht nur durch Mediatoren - Enkephaline - erregt, sondern auch durch andere Komponenten des antinozeptiven Systems - Gehirnhormone (Endorphine). Peptidagonisten von Opiatrezeptoren werden während der Proteolyse der Peptidsubstanzen des Gehirns gebildet: Proopiocortin, Proenkephaline A und B. Alle diese Peptide werden im Hypothalamus gebildet. Opiatrezeptoren regen Rezeptoren in allen Gehirnstrukturen an, die an der Weiterleitung und Wahrnehmung von Schmerz beteiligt sind, die Bildung von emotional gefärbten Reaktionen auf Schmerz. Gleichzeitig nimmt die Ausschüttung von Schmerzmediatoren ab und alle schmerzbegleitenden Reaktionen werden abgeschwächt. 40. Schmerzmittel Ein Analgetikum (Acetylsalicylsäure, Paracetamol, Morphin) ist ein Medikament, das Schmerzen verschiedener Herkunft lindert. Arzneimittel, die nur durch einen bestimmten ursächlichen Faktor hervorgerufene Schmerzen lindern oder ein bestimmtes Schmerzsyndrom beseitigen, z. B. Antazida, Ergotamin (Migräne), Carbamazepin (Neuralgie), Nitroglycerin (Angina pectoris), gehören nicht zu den klassischen Analgetika. Kortikosteroide unterdrücken die Entzündungsreaktion und den daraus resultierenden Schmerz, stellen aber trotz ihrer weiten Verbreitung für diese Zwecke auch keine klassischen Analgetika dar. Analgetika werden in narkotische, die auf ZNS-Strukturen wirken und Schläfrigkeit verursachen, wie Opioide, und nicht narkotische, die hauptsächlich auf periphere Strukturen wirken, wie Paracetamol, Acetylsalicylsäure, eingeteilt. Zusätzliche Medikamente, die die Wirkung von Analgetika verstärken Die Medikamente dieser Gruppe sind selbst keine Analgetika, sondern werden in Kombination mit Analgetika gegen Schmerzen eingesetzt, da sie die Einstellung zum Schmerz, seine Wahrnehmung und das Niveau von Angst, Angst, Depression (trizyklische Antidepressiva können sogar eine Verringerung des Bedarfs an Schmerzen verändern können). Morphin bei einem Patienten im Endstadium). Solche Medikamente können sowohl Psychopharmaka als auch solche sein, die die Schmerzmechanismen beeinflussen, beispielsweise Krämpfe der glatten und quergestreiften Muskulatur beseitigen. Narkotische Analgetika sind pflanzliche und synthetische Drogen, die selektiv die Schmerzwahrnehmung reduzieren, die Schmerztoleranz erhöhen, indem sie die emotionale Färbung des Schmerzes und seiner vegetativen Begleiterscheinung reduzieren, Euphorie und Drogenabhängigkeit hervorrufen. Klassifikation von narkotischen Analgetika und ihren Antagonisten 1. Piperidin-Phenanthren-Derivate: 1) Morphin; 2) Codein (Methylmorphin, 5-7 mal schwächer als Morphin als Analgetikum); 3) Ethylmorphin (Dionin, gleich stark wie Morphin). 2. Phenylpiperidin-Derivate: 1) Promedol (3-4 mal schwächer als Morphin); 2) Fentanyl (100-400 Mal stärker als Morphin). 3. Derivate von Diphenylmethan: 1) Pyritramid (Dipidolor) - gleich Morphin; 2) Tramadol (Tramal) - Morphin etwas unterlegen. 4. Agonisten-Antagonisten: 1) Opiatrezeptoragonisten und Opiatrezeptorantagonisten - Buprenorphin (Norphin) (25-30 mal stärker als Morphin); 2) Opiatrezeptoragonisten und Opiatrezeptorantagonisten - Pentazocin (Lexir) (2-3 mal schwächer als Morphin) und Butorphanol (Moradol) (gleich Morphin). 41. Stadien der Anästhesie Vollnarkose oder Anästhesie ist ein Zustand des Körpers, der durch eine vorübergehende Abschaltung des Bewusstseins einer Person, ihrer Schmerzempfindlichkeit und Reflexe sowie durch eine Entspannung der Muskeln der Skelettmuskulatur gekennzeichnet ist, die durch die Wirkung von narkotischen Analgetika verursacht wird das zentrale Nervensystem. Abhängig von den Verabreichungswegen von Betäubungsmitteln in den Körper werden Inhalations- und Nicht-Inhalationsanästhesie unterschieden. Es gibt 4 Stadien der Anästhesie: 1) Analgesie; 2) Aufregung; 3) OP-Stadium, unterteilt in 4 Ebenen; 4) Stadium des Erwachens. Stadium der Analgesie Der Patient ist bei Bewusstsein, aber es wird eine gewisse Lethargie festgestellt, er döst, beantwortet Fragen einsilbig. Oberflächliche Empfindlichkeit und Schmerzempfindlichkeit fehlen, aber die taktile und thermische Empfindlichkeit bleiben erhalten. In diesem Stadium werden kurzfristige chirurgische Eingriffe durchgeführt, z. B. Öffnen von Phlegmonen, Abszessen, diagnostische Studien usw. Das Stadium ist kurzfristig und dauert 3-4 Minuten. Erregungsphase In diesem Stadium sind die Zentren der Großhirnrinde gehemmt und die subkortikalen Zentren befinden sich zu diesem Zeitpunkt in einem Zustand der Erregung. Gleichzeitig fehlt das Bewusstsein des Patienten vollständig, es wird eine ausgeprägte motorische und sprachliche Erregung festgestellt. Patienten fangen an zu schreien, versuchen vom OP-Tisch aufzustehen. Es wird eine Hyperämie der Haut festgestellt, der Puls wird häufiger, der systolische Blutdruck steigt an. Die Pupille des Auges wird weit, aber die Reaktion auf Licht bleibt bestehen, es wird Tränenfluss festgestellt. Oft gibt es Husten, erhöhte Bronchialsekretion, manchmal Erbrechen. Ein chirurgischer Eingriff vor dem Hintergrund der Erregung kann nicht durchgeführt werden. Während dieser Zeit sollten Sie den Körper weiterhin mit einem Betäubungsmittel sättigen, um die Anästhesie zu verbessern. Die Dauer des Stadiums hängt vom Allgemeinzustand des Patienten und der Erfahrung des Anästhesisten ab. Typischerweise beträgt die Erregungsdauer 7–15 Minuten. Chirurgisches Stadium Mit Beginn dieser Anästhesiephase beruhigt sich der Patient, die Atmung wird ruhig und gleichmäßig, Herzfrequenz und Blutdruck nähern sich dem Normalwert. Während dieser Zeit sind chirurgische Eingriffe möglich. Je nach Narkosetiefe werden 4 Narkosestufen und das Stadium III der Narkose unterschieden. Erste Stufe: Der Patient ist ruhig, die Anzahl der Atembewegungen, die Anzahl der Herzschläge und der Blutdruck nähern sich den Ausgangswerten. Die Pupille beginnt sich allmählich zu verengen, ihre Lichtreaktion bleibt erhalten. Zweite Ebene: Die Bewegung der Augäpfel wird gestoppt, sie werden in einer zentralen Position fixiert. Die Pupillen weiten sich und ihre Reaktion auf Licht wird schwächer. Der Muskeltonus wird reduziert, was Bauchoperationen ermöglicht. Die dritte Ebene wird als Tiefenanästhesie bezeichnet. Gleichzeitig werden die Pupillen der Augen als Reaktion auf einen starken Lichtreiz erweitert. Die Anästhesie der vierten Stufe ist für den Patienten lebensbedrohlich, da es zu Atem- und Kreislaufstillstand kommen kann. Erwachende Phase Sobald die Einführung von Betäubungsmitteln aufhört, ihre Konzentration im Blut abnimmt und der Patient alle Stadien der Anästhesie in umgekehrter Reihenfolge durchläuft, tritt ein Erwachen auf. 42. Vorbereitung des Patienten auf die Anästhesie Der Anästhesist übernimmt eine direkte und oft die Hauptrolle bei der Vorbereitung des Patienten auf Anästhesie und Operation. Ein obligatorischer Moment ist die Untersuchung des Patienten vor der Operation, aber gleichzeitig ist nicht nur die zugrunde liegende Erkrankung wichtig, wegen der operiert werden soll, sondern auch das Vorhandensein von Begleiterkrankungen, die der Anästhesist detailliert erfragt . Es ist notwendig zu wissen, wie der Patient wegen dieser Krankheiten behandelt wurde, die Wirkung der Behandlung, die Behandlungsdauer, das Vorhandensein allergischer Reaktionen, den Zeitpunkt der letzten Exazerbation. Wird der Patient planmäßig einem chirurgischen Eingriff unterzogen, so erfolgt ggf. eine Korrektur bestehender Begleiterkrankungen. Die Sanierung der Mundhöhle ist bei lockeren und kariösen Zähnen wichtig, da diese eine zusätzliche und unerwünschte Infektionsquelle darstellen können. Der Anästhesist ermittelt und bewertet den psychoneurologischen Zustand des Patienten. So ist beispielsweise bei Schizophrenie die Einnahme von halluzinogenen Drogen (Ketamin) kontraindiziert. Eine Operation während der Psychose ist kontraindiziert. Bei Vorliegen eines neurologischen Defizits wird es vorläufig korrigiert. Die allergische Vorgeschichte ist für den Anästhesisten von großer Bedeutung, hierfür wird die Unverträglichkeit gegenüber Medikamenten, sowie Nahrungsmitteln, Haushaltschemikalien etc. angegeben. Hat der Patient eine verstärkte allergische Anamnese, auch nicht auf Medikamente, kann es während der Narkose zu einer allergischen Reaktion bis hin zum anaphylaktischen Schock kommen. Daher werden Desensibilisierungsmittel (Diphenhydramin, Suprastin) in großen Mengen in die Prämedikation eingebracht. Ein wichtiger Punkt ist die Anwesenheit eines Patienten bei den vergangenen Operationen und Anästhesien. Es stellt sich heraus, was die Anästhesie war und ob es irgendwelche Komplikationen gab. Es wird auf den somatischen Zustand des Patienten hingewiesen: die Gesichtsform, die Form und Art der Brust, die Struktur und Länge des Halses, die Schwere des subkutanen Fettgewebes, das Vorhandensein von Ödemen. All dies ist notwendig, um die richtige Anästhesiemethode und Medikamente auszuwählen. Die erste Regel für die Vorbereitung eines Patienten auf die Anästhesie während einer Operation und bei der Anwendung einer Anästhesie ist die Reinigung des Magen-Darm-Trakts (der Magen wird durch die Sonde gewaschen, es werden Reinigungseinläufe durchgeführt). Um die psycho-emotionale Reaktion zu unterdrücken und die Aktivität des Vagusnervs zu unterdrücken, erhält der Patient vor der Operation Medikamente - Prämedikation. Nachts wird Phenazepam intramuskulär verschrieben. Patienten mit einem labilen Nervensystem werden einen Tag vor der Operation Beruhigungsmittel (Seduxen, Relanium) verschrieben. 40 Minuten vor der Operation werden narkotische Analgetika intramuskulär oder subkutan injiziert: 1 ml einer 1-2% igen Lösung von Promolol oder 1 ml Pentozocin (Lexir), 2 ml Fentanyl oder 1 ml 1% Morphin. Um die Funktion des Vagusnervs zu unterdrücken und den Speichelfluss zu reduzieren, werden 0,5 ml einer 0,1% igen Atropinlösung verabreicht. 43. Intravenöse und Inhalationsanästhesie Die Vorteile der intravenösen Vollnarkose liegen in der schnellen Einführung des Patienten in die Narkose. Bei dieser Art der Anästhesie gibt es keine Aufregung und der Patient schläft schnell ein. Betäubungsmittel, die zur intravenösen Verabreichung verwendet werden, erzeugen jedoch eine Kurzzeitanästhesie, sodass sie in ihrer reinen Form nicht als Mononarkose für Langzeitoperationen verwendet werden können. Barbiturate - Natriumthiopental und Hexenal - können schnell einen narkotischen Schlaf auslösen, während es kein Erregungsstadium gibt und das Erwachen schnell erfolgt. Die klinischen Bilder der Anästhesie mit Natriumthiopental und Hexenal sind ähnlich. Geksenal hat eine weniger hemmende Wirkung auf das Atemzentrum. Es werden frisch zubereitete Lösungen von Barbitursäurederivaten verwendet. In der Chirurgie wird die Anästhesie mit Barbituraten als Mononarkose für kurzfristige Operationen verwendet, die eine Dauer von 20 Minuten nicht überschreiten (z. B. Eröffnung von Abszessen, Phlegmonen, Reposition von Luxationen, diagnostische Manipulationen und Reposition von Knochenfragmenten). Derivate der Barbitursäure werden auch zur Induktionsanästhesie verwendet. Natriumhydroxybutyrat wird sehr langsam intravenös verabreicht. Das Medikament erzeugt eine oberflächliche Anästhesie und wird daher häufig in Kombination mit anderen Betäubungsmitteln wie Barbituraten - Propanidid - verwendet. Es wird häufig zur Induktionsanästhesie verwendet. Ketamin kann zur Mononarkose und zur Einleitungsanästhesie eingesetzt werden. Das Medikament verursacht oberflächlichen Schlaf, stimuliert die Aktivität des Herz-Kreislauf-Systems (Blutdruck steigt, Puls beschleunigt). Die Inhalationsanästhesie wird mit Hilfe von leicht verdunstenden (flüchtigen) Flüssigkeiten durchgeführt - Ether, Halothan, Methoxyfluran (Pentran), Trichlorethylen, Chloroform oder gasförmigen Betäubungsmitteln - Lachgas, Cyclopropan. Bei der endotrachealen Anästhesiemethode gelangt das Betäubungsmittel aus dem Anästhesiegerät durch einen in die Luftröhre eingeführten Schlauch in den Körper. Der Vorteil der Methode liegt in der Tatsache, dass sie eine freie Durchgängigkeit der Atemwege bietet und bei Operationen an Hals, Gesicht und Kopf verwendet werden kann und die Möglichkeit der Aspiration von Erbrochenem und Blut ausschließt; reduziert die Menge des verwendeten Arzneimittels; verbessert den Gasaustausch durch Verringerung des "toten" Raums. Die Endotrachealanästhesie ist bei größeren chirurgischen Eingriffen indiziert, sie wird als Mehrkomponentenanästhesie mit Muskelrelaxantien (Kombinationsanästhesie) eingesetzt. Die Gesamtverwendung mehrerer Medikamente in kleinen Dosen reduziert die toxischen Wirkungen auf den Körper von jedem von ihnen. Moderne gemischte Anästhesie wird verwendet, um Analgesie, Bewusstseinsabschaltung und Entspannung bereitzustellen. Analgesie und Bewusstseinsabschaltung erfolgen durch den Einsatz eines oder mehrerer Betäubungsmittel - inhaliert oder nicht inhaliert. Die Anästhesie wird auf der ersten Ebene des chirurgischen Stadiums durchgeführt. Muskelrelaxation oder Entspannung wird durch die fraktionierte Verabreichung von Muskelrelaxanzien erreicht. 44. Stadien der Anästhesie Es gibt drei Stufen der Anästhesie. 1. Einführung in die Anästhesie. Die Einleitungsanästhesie kann mit jedem Betäubungsmittel durchgeführt werden, gegen das ein eher tiefer Anästhesieschlaf ohne Erregungsstadium eintritt. Meistens werden Barbiturate, Fentanyl in Kombination mit Sombrevin, gemahlen mit Sombrevin verwendet. Auch Natriumthiopental wird häufig verwendet. Die Medikamente werden in Form einer 1% igen Lösung verwendet, sie werden intravenös in einer Dosis von 400-500 mg verabreicht. Vor dem Hintergrund der Induktionsanästhesie werden Muskelrelaxanzien verabreicht und eine tracheale Intubation durchgeführt. 2. Aufrechterhaltung der Anästhesie. Um die Vollnarkose aufrechtzuerhalten, können Sie jedes Narkotikum verwenden, das den Körper vor chirurgischen Traumata (Halothan, Cyclopropan, Lachgas mit Sauerstoff) sowie Neuroleptanalgesie schützen kann. Die Anästhesie wird auf der ersten und zweiten Stufe des chirurgischen Stadiums aufrechterhalten, und Muskelrelaxantien werden verabreicht, um Muskelverspannungen zu beseitigen, die eine Myoplegie aller Skelettmuskelgruppen, einschließlich der respiratorischen, verursachen. Die Hauptbedingung für die moderne kombinierte Anästhesiemethode ist daher die mechanische Beatmung, die durch rhythmisches Zusammendrücken eines Beutels oder Fells oder unter Verwendung eines künstlichen Beatmungsgeräts durchgeführt wird. Vor kurzem die am weitesten verbreitete Neuroleptanalgesie. Bei dieser Methode werden Lachgas mit Sauerstoff, Fentanyl, Droperidol, Muskelrelaxanzien zur Anästhesie verwendet. Einleitungsanästhesie intravenös. Die Anästhesie wird durch Inhalation von Lachgas mit Sauerstoff im Verhältnis 2: 1, fraktionierte intravenöse Verabreichung von Fentanyl und Droperidol 1-2 ml alle 15-20 Minuten aufrechterhalten. Bei erhöhter Herzfrequenz wird Fentanyl verabreicht, bei einem Anstieg des Blutdrucks - Droperidol. Diese Art der Anästhesie ist sicherer für den Patienten. Fentanyl verstärkt die Schmerzlinderung, Droperidol unterdrückt vegetative Reaktionen. 3. Entzug aus der Anästhesie. Am Ende der Operation stoppt der Anästhesist schrittweise die Verabreichung von Betäubungsmitteln und Muskelrelaxanzien. Das Bewusstsein kehrt zum Patienten zurück, die unabhängige Atmung und der Muskeltonus werden wiederhergestellt. Die Kriterien zur Beurteilung der Angemessenheit der Spontanatmung sind Indikatoren für PO2, PCO2 und pH. Nach dem Aufwachen, Wiederherstellung der Spontanatmung und des Skelettmuskeltonus kann der Anästhesist den Patienten extubieren und zur weiteren Beobachtung in den Aufwachraum transportieren. Während der Vollnarkose werden die wichtigsten Parameter der Hämodynamik ständig bestimmt und ausgewertet. Alle 10-15 Minuten Blutdruck und Puls messen. Bei Personen mit Erkrankungen des Herz-Kreislauf-Systems sowie bei Thoraxoperationen ist es notwendig, die Funktion des Herzmuskels ständig zu überwachen. Die elektroenzephalographische Beobachtung kann verwendet werden, um den Grad der Anästhesie zu bestimmen. Um die Lungenventilation und metabolische Veränderungen während Anästhesie und Operation zu kontrollieren, ist es notwendig, den Säure-Basen-Zustand (PO2, PCO2, pH, BE) zu untersuchen. 45. Komplikationen der Anästhesie Komplikationen während der Anästhesie können aufgrund einer unsachgemäßen Anästhesietechnik oder der Wirkung von Anästhetika auf lebenswichtige Organe auftreten. Eine solche Komplikation ist Erbrechen. Zu Beginn der Anästhesie kann Erbrechen mit der Art der dominanten Erkrankung (Pylorusstenose, Darmverschluss) oder mit der direkten Wirkung des Arzneimittels auf das Erbrechenszentrum in Verbindung gebracht werden. Vor dem Hintergrund des Erbrechens ist Aspiration gefährlich - das Eindringen von Mageninhalt in die Luftröhre und die Bronchien. Stark sauer reagierender Mageninhalt, der auf die Stimmbänder fällt und dann in die Luftröhre eindringt, kann zu Laryngospasmus oder Bronchospasmus führen, was zu Atemversagen mit anschließender Hypoxie führt - dies ist das sogenannte Mendelssohn-Syndrom, begleitet von Zyanose, Bronchospasmus, Tachykardie. Gefährlich kann Regurgitation sein - passives Werfen von Mageninhalt in die Luftröhre und die Bronchien. Komplikationen des Atmungssystems können aufgrund einer beeinträchtigten Durchgängigkeit der Atemwege auftreten. Dies kann auf Defekte im Anästhesiegerät zurückzuführen sein. Komplikationen der Trachealintubation durch direkte Laryngoskopie können wie folgt gruppiert werden: 1) Beschädigung der Zähne durch den Laryngoskopspatel; 2) Schädigung der Stimmbänder; 3) Einführung eines Endotrachealtubus in die Speiseröhre; 4) Einführung eines Endotrachealtubus in den rechten Bronchus; 5) Austritt des Endotrachealtubus aus der Trachea oder Biegen. Herzrhythmusstörungen (ventrikuläre Tachykardie, Extrasystole, Kammerflimmern) können verschiedene Ursachen haben: 1) Hypoxie und Hyperkapnie infolge längerer Intubation oder unzureichender Beatmung während der Anästhesie; 2) Überdosierung von Betäubungsmitteln - Barbiturate, Halothan; 3) die Verwendung von Adrenalin vor dem Hintergrund von Fluorotan, was die Empfindlichkeit von Fluorotan gegenüber Katecholaminen erhöht. Schädigung der peripheren Nerven Diese Komplikation tritt einen Tag oder länger nach der Anästhesie auf. Am häufigsten sind die Nerven der oberen und unteren Extremitäten sowie der Plexus brachialis geschädigt. Dies ist das Ergebnis einer falschen Position des Patienten auf dem OP-Tisch (Abduktion des Arms um mehr als 90° vom Körper, Arm hinter den Kopf legen, Fixieren des Arms am Bogen des OP-Tisches, Auflegen der Beine auf den Halter ohne Polsterung). Die korrekte Position des Patienten auf dem Tisch beseitigt die Spannung der Nervenstämme. Die Behandlung wird von einem Neuropathologen und einem Physiotherapeuten durchgeführt. 46. Lokalanästhesie Oberflächenanästhesie Diese Art der Anästhesie wird durch Kontakt des Anästhetikums mit dem einen oder anderen Organ, seiner Oberfläche, durchgeführt. Zu diesem Zweck eine 1-3%ige Kokainlösung, eine 0,25-2%ige Dicainlösung, eine 1-2%ige Lidocainlösung, eine 1-5%ige Trimecainlösung und eine 0,5-2%ige Pyromecainlösung. Die meisten Lokalanästhetika binden an inaktivierte Natriumkanäle, verhindern deren Aktivierung und den Eintritt von Natrium in die Zelle während der Membrandepolarisation und erzielen so eine analgetische Wirkung. Die Technik der Oberflächenanästhesie ist einfach und besteht darin, eine Lösung zu schmieren, einzuträufeln oder mit speziellen Sprühpistolen zu sprühen. Der Wirkungseintritt des Anästhetikums ist pH-abhängig, wobei es bei niedrigem pH-Wert länger dauert, bis die Wirkung eintritt, als bei hohem pH-Wert. Die Wirkungsdauer des Anästhetikums hängt vom Grad seiner Bindung an Proteine ab. Diese Art der Anästhesie wird bei diagnostischen Manipulationen und in der Augenheilkunde, Hals-Nasen-Ohrenheilkunde verwendet. Regionalanästhesie Die Regionalanästhesie umfasst Plexus-, Leitungs-, Epidural-, Paravertebral- und andere Arten von Anästhesie. Im Gegensatz zur Allgemeinanästhesie bietet die Regionalanästhesie aufgrund der peripheren Blockade von Schmerzimpulsen eine angemessene chirurgische Analgesie, während normale Vitalfunktionen aufrechterhalten werden. Die Regionalanästhesie ist technisch schwierig und erfordert eine genaue Kenntnis der anatomischen und topografischen Lage des Nervengeflechts oder Nervenleiters, eine klare Orientierung an dauerhaften Identifikationspunkten (Knochenvorsprünge, Arterien, Muskeln), die Fähigkeit, den Gewebewiderstand und die Empfindungen des Patienten zu beurteilen. Um die Schmerzempfindlichkeit auszuschalten, reicht es aus, eine 1% ige Lösung von Trimecain (Lidocain) einzuführen, und um die propriozeptive Empfindlichkeit auszuschalten und eine Muskelentspannung zu erreichen, sollten konzentriertere Lokalanästhesielösungen verwendet werden (z. B. Trimecain 2-2,5%). . Die Wiederherstellung der Sensibilität erfolgt in umgekehrter Reihenfolge, d.h. zuerst treten Muskeltonus und propriozeptive Empfindungen auf, dann Schmerz- und Temperaturempfindungen. Die Wirkung der Anästhesie hängt von der Menge an Anästhetikum ab, die transperineural eindringt und eine adäquate Schwellenblockade bewirkt. Die Verdoppelung der Konzentration des injizierten Anästhetikums verlängert die Anästhesie um 1/3 und die Einführung eines doppelten Volumens - nur um 3-9%. Lokalanästhetika führen oft zu anaphylaktischen Reaktionen. Trimecain: Die Wirkungsdauer beträgt 1-1,5 Stunden, die maximale Einzeldosis beträgt 800-1000 mg. Lidocain (Xicain) wird in einer 1-2%igen Lösung verwendet, die Narkosedauer beträgt bis zu 2,5-3 Stunden Bupivocain (Marcain) wird in einer 0,5-0,75%igen Lösung in einer maximalen Einzeldosis von 150-170 mg verwendet. Die Wirkungsdauer beträgt 8-12 Stunden.Bei der Verwendung von langwirksamen Anästhetika beschleunigt die Zugabe von Lidocain den Wirkungseintritt deutlich und verkürzt die Latenzzeit. 47. Anästhesie des zervikalen Plexus (ASP) ACS, ein- oder beidseitig durchgeführt, ermöglicht Ihnen alle Operationen an Hals, Schilddrüse, brachiozephalen Gefäßen bei Schussverletzungen, Verletzungen und Tumorerkrankungen. Das Plexus cervicalis (us cervicalis) wird aus den vorderen Ästen der vier oberen Halsnerven (C1-C4) gebildet, wenn sie aus den Zwischenwirbellöchern austreten. Er befindet sich an der Vorderfläche des mittleren Skalenusmuskels und des Muskels, der das Schulterblatt anhebt, seitlich der Querfortsätze der Halswirbel. Die motorischen Nerven des Plexus cervicalis innervieren die Halsmuskeln und die sensorischen Nerven - die Haut der Hinterhauptregion des Kopfes, die vorderen und seitlichen Oberflächen des Halses, die subklavische Region bis zur Höhe der Rippen I und II und die Ohrmuschel. Der größte Nerv des Plexus cervicalis ist der Zwerchfellnerv (p. prenicus), der aus C3-C4 und seltener durch einen zusätzlichen Ast aus C5 gebildet wird. Die meisten sensorischen Nerven treten in der Mitte unter dem hinteren Rand des M. sternocleidomastoideus aus und divergieren in den oberflächlichen Schichten des Halses, der Haut der Hinterhauptregion des Kopfes und der oberen Brust. Anästhesietechnik 2 cm unterhalb des Unterkieferwinkels, vor dem M. sternocleidomastoideus, wird die Pulsation der A. carotis interna bestimmt. Der horizontale Ast des Zungenbeins entspricht der Höhe des Querfortsatzes des C3-Wirbels. Der Injektionspunkt der Nadel befindet sich am Schnittpunkt der Linie, die eine Fortsetzung des horizontalen Zweigs des Zungenbeins ist, mit der Vorderkante des M. sternocleidomastoideus. An diesem Schnittpunkt wird unter aseptischen Bedingungen eine „Zitronenschale“ gebildet, durch die eine Injektionsnadel von außen nach innen und von vorne nach hinten geführt und medial bis zum M. sternocleidomastoideus und hinter die Carotis interna vorgeschoben wird Arterie (in der Lücke zwischen M. sternocleidomastoideus und tastbarer A. carotis interna) bis der Patient Parästhesien entwickelt oder die Nadel den Querfortsatz des C3-Wirbels trifft. Die Injektionstiefe überschreitet 2-5 cm nicht, die Nadel wird in dieser Position sicher fixiert und es wird ein Aspirationstest durchgeführt, bei dem festgestellt wird, ob sich das Ende der Nadel im Lumen des Gefäßes befindet. Zur Anästhesie werden von beiden Seiten 10-12 ml einer 2%igen Trimecain-Lösung injiziert. Um die Anästhesie des Zervikalplexus zu verbessern, können Sie zusätzlich die oberflächlichen Äste blockieren, die zur Vorderfläche des Halses führen. Der Ort ihres Austritts ist die Mitte des hinteren Randes des M. sternocleidomastoideus. Die Nadel wird an ihrem Austrittspunkt unter die oberflächliche Faszie des Halses injiziert. Eine Lösung von 2% Trimecain wird in einer Menge von 3-5 ml kranial und kaudal (fächerförmig) verabreicht. Eine ausreichende Anästhesie tritt nach 8-12 Minuten ein und bietet bei den meisten Patienten innerhalb von 1,5-2 Stunden eine wirksame Schmerzlinderung. 48. Anästhesie des Plexus brachialis (APS) Mit APS können Sie alle Operationen an der oberen Extremität, dem Schultergelenk, der Schulter, dem Unterarm und der Hand durchführen: Amputationen, chirurgische Wundbehandlung mit Reposition und Fixierung von Knochenfragmenten, Operationen an Blutgefäßen und Nerven, Reposition von Schulterluxationen usw Eine hohe Häufigkeit chirurgischer Eingriffe an der oberen Extremität, insbesondere in Kriegszeiten, wirft die Frage nach rationellen Anästhesiemethoden bei diesen Operationen auf. Anästhesie des Plexus brachialis von Winnie Der Patient liegt auf dem Rücken, der Kopf wird von der Punktionsstelle in die entgegengesetzte Richtung gedreht, das Kinn wird zum kontralateralen Schultergürtel gebracht. Die Hand von der Seite der Punktion liegt am Körper an, leicht nach unten gezogen. Orientierungspunkte: M. sternocleidomastoideus, Skalenus anterior, interstitieller Raum, V. jugularis externa, Schlüsselbein, Ringknorpel. Anästhesietechnik. Die Haut wird mit einer antiseptischen Lösung behandelt. Hinter dem M. sternocleidomastoideus, der sich durch eine leichte Anhebung des Kopfes deutlich konturiert, auf Höhe des Ringknorpels legen Sie die Fingerspitzen der linken Hand auf den M. scalenus anterior. Bei weiterer seitlicher Verschiebung der Finger um 0,5–1,5 cm wird der Zwischenraum zwischen den vorderen und mittleren Skalenmuskeln ertastet. Bei tiefem Einatmen wird es deutlicher, da sich die Skalenmuskeln anspannen. In den Tiefen des Interskalenraums sind die Querfortsätze der Halswirbel zu spüren (ein Gefühl des festen Widerstands), und bei erhöhtem Druck mit der Fingerspitze kommt es häufig zu Parästhesien in der Schulter oder im Schultergürtel; kaudal im Interskalenraum ist die Arteria subclavia tastbar. Der Interskalenraum im oberen Abschnitt wird von der Vena jugularis externa durchzogen. Der Einstichpunkt der Nadel liegt im oberen Teil des Interskalenraums auf Höhe des Ringknorpels. An diesem Punkt bildet sich eine „Zitronenschale“, durch die die Nadel medial und leicht nach unten gerichtet ist, von vorne nach hinten (dorsal) zum Querfortsatz von C6 in einem Winkel von 30° zur Sagittalebene. Wenn sich die Nadel um eine Distanz von 1,5 bis 4 cm nach innen bewegt, kommt es zu Parästhesien und die Nadelspitze ruht auf dem Querfortsatz des 6. Halswirbels. In dieser Position wird die Nadel fixiert bzw. um 1–2 mm nach oben gezogen und nach einem Aspirationstest werden 30–40 ml einer 2 %igen Lösung von Trimecain (Lidocain) oder einer 0,5–0,75 %igen Lösung von Bupivocain (Marcain) eingefüllt gespritzt. Während der Injektion der ersten Milliliter Lokalanästhesielösung verspürt der Patient kurzzeitige Schmerzen („Stromschlag“), die auf die korrekte Platzierung der Nadelspitze hinweisen. Liegt keine Parästhesie vor, können Sie die Position der Nadelspitze durch Injektion von 0,5 ml 0,9 %iger Natriumchloridlösung aus dem Kühlschrank überprüfen. Das Auftreten eines Schmerzgefühls in der oberen Extremität weist auf den Kontakt der kalten Lösung mit dem Nerv hin. 49. Anästhesie peripherer Nerven im Bereich des Handgelenks Bei Operationen an der Hand ist eine Betäubung der N. ulnaris, medianus und radialis erforderlich. In allen Fällen wird die Nadel in Höhe der proximalen Handgelenksfalte injiziert. Während der Anästhesie liegt der Patient auf dem Rücken, im Bereich des Handgelenks ist der Arm supiniert und leicht gebeugt. Orientierungspunkte: Ulna styloideus, Os pisiforme, Flexor-carpi-ulnaris-Sehne und Flexor-carpi-longus-Sehne. Anästhesie des N. ulnaris Technik zur Anästhesie des palmaren Astes des N. ulnaris. Der Einstichpunkt der Nadel liegt auf Höhe der proximalen Handwurzelfalte medial der Sehne des M. flexor carpi ulnaris. Die Nadel wird durch das Unterhautgewebe bis zu einer Tiefe von 1–2 cm in Richtung des Os pisiforme geführt. Nach dem Auftreten von Parästhesien und wenn der Aspirationstest negativ ist, fixieren Sie die Nadel und injizieren Sie 3-5 ml einer 2%igen Trimecainlösung. Liegt keine Parästhesie vor, wird die Nadel bis zum Kontakt mit dem Knochen vorgeschoben und beim Entfernen erfolgt eine Gewebeinfiltration mit einer 2 %igen Trimecainlösung. Technik zur Anästhesie des dorsalen Astes des N. ulnaris. Der Injektionspunkt der Nadel befindet sich auf Höhe des Schnittpunkts der proximalen Handgelenksfalte mit dem medialen Rand der Sehne des M. flexor ulnaris. Die Nadel wird auf den Processus styloideus der Ulna gerichtet. Um eine Parästhesie zu erreichen, werden 3-5 ml einer 2% igen Trimecainlösung injiziert. In Abwesenheit von Parästhesien wird die Nadel entfernt und 5–10 ml einer 2%igen Trimecainlösung werden in das Gewebe infiltriert. Anästhesie des Nervus medianus Anästhesietechnik. Der Injektionspunkt der Nadel befindet sich auf der Linie der proximalen Hautfalte des Handgelenks zwischen der Sehne des langen Palmarmuskels und dem radialen Beuger der Hand. Nach senkrechtem Vorschieben der Nadel durch das subkutane Gewebe bis zu einer Tiefe von 0,5–1 cm und Erreichen einer Parästhesie wird die Nadel fixiert und 3–5 ml einer 2%igen Lidocainlösung injiziert. Wenn keine Parästhesie in 1 cm Tiefe erreicht werden kann, werden die Gewebe fächerförmig mit 5-10 ml einer 2%igen Trimecain-Lösung infiltriert, während die Nadel langsam zurückgezogen wird. Anästhesie des N. radialis Anästhesietechnik. Der Injektionspunkt befindet sich in Höhe der proximalen Hautfalte des Handgelenks lateral der Arteria radialis auf der Projektion der Oberseite der „anatomischen Schnupftabakdose". Eine Injektion wird durchgeführt, und die Nadel wird in Richtung der „Schnupftabakdose" gerichtet. Bei Auftreten von Parästhesien wird die Nadel fixiert, bei negativem Aspirationstest werden 3-5 ml einer 2% igen Trimecain-Lösung injiziert. In Abwesenheit von Parästhesien werden 5-10 ml einer 2% igen Trimecain-Lösung fächerförmig in das darunter liegende Gewebe injiziert, wodurch ein 3-3,5 cm langes Infiltrations-"Armband" aus den Sehnen des kurzen Streckmuskels und des langen Abduktorkopfes entsteht Daumen auf der einen Seite zum langen Streckmuskel des Daumens - mit einer anderen. 50. Anästhesie der unteren Extremitäten Um chirurgische Eingriffe an der unteren Extremität durchzuführen, müssen alle vier Hauptnerven betäubt werden. Drei von ihnen - der Oberschenkelknochen, der Obturator und der äußere Hautnerv des Oberschenkels - stammen aus dem Lendengeflecht, und der Ischiasnerv wird teilweise aus dem Lendengeflecht und drei Ästen des Kreuzbeingeflechts gebildet. Anästhesietechnik. Die Haut wird mit einer Desinfektionslösung behandelt. Mit einer Anästhesielösung wird eine "Zitronenschale" gebildet, wonach die Nadel 1-1,5 cm unterhalb des Leistenbandes und 0,5-1 cm lateral der tastbaren Femoralarterie unter das Leistenband injiziert wird. Die Nadel wird durch das subkutane Gewebe etwas proximal unter dem Leistenband geführt, wo in einer Tiefe von 3-4 cm nach Punktion der Faszie die Nadel mit Widerstandsverlust versagt und Parästhesien auftreten können, die sich bis zur vorderen Oberfläche erstrecken des Oberschenkels. In dieser Position wird die Nadel mit Daumen und Zeigefinger der linken Hand fixiert und die Kante der Handfläche der linken Hand mit Kraft auf die Weichteile des Oberschenkels distal zur Nadel gedrückt und 35-40 ml a 1,5%ige Trimecain-Lösung wird injiziert. Der Druck auf die Weichteile dauert 1,5-2 Minuten. So wird aus der Anästhesie des N. femoralis mit Klemmung eine Anästhesie des Plexus lumbalis, die vom vorderen Zugang aus durchgeführt wird. Die Wirkung der Anästhesie dauert 2-2,5 Stunden. Die Anästhesie des Plexus lumbalis kann über den posterioren Zugang erfolgen, während gleichzeitig der N. femoralis (L2-L4) und der N. obturatorius (L2-L3), der N. genitofemoralis (L1-L2) und der N. cutaneus femoris lateralis (L2-L3) anästhesiert werden. . Die Position des Patienten während der Anästhesie ist auf einer gesunden Seite mit angewinkelten Beinen. Orientierungspunkte: Dornfortsatz des 4. Lendenwirbels (Verbindungslinie der Beckenkämme dahinter); 3 cm kaudal entlang der Dornfortsatzkämme vom Dornfortsatz des 4. Lendenwirbels und 5 cm lateral vom letzten Punkt. Anästhesietechnik. Vom Dornfortsatz des 4. Lendenwirbels wird in kaudaler Richtung eine 3 cm lange Linie gezogen, an deren Ende seitlich nach oben eine 5 cm lange Senkrechte wiederhergestellt wird, deren Endpunkt in der Nähe des Beckenkamms liegt. ist der Injektionspunkt der Nadel. Nach dem Erstellen einer „Zitronenschale“ wird eine 12-15 cm lange Nadel senkrecht zur Haut eingeführt, bis sie den Querfortsatz des 5. Lendenwirbels berührt. Kranial gleitet die Nadel vom Querfortsatz des 5. Lendenwirbels ab und dringt in die Dicke des quadratischen Psoas-Muskels ein. Gleichzeitig ist ein Widerstand gegen das Einbringen einer Lösung mit einer Spritze zu spüren (oder es tritt ein Federwiderstand bei Verformung der Luftblase in der Spritze auf). Die Nadel wird bis zu einer Tiefe eingeführt, bei der ein "Widerstandsverlust" zu spüren ist (oder die Luftblase nicht verformt ist). Dieser Test zeigt an, dass sich die Nadel in der Faszie zwischen dem quadratischen Psoas und dem großen Psoas befindet. Die Nadel wird in dieser Tiefe fixiert und 35-40 ml einer 1,5-2%igen Trimecain (Lidocain)-Lösung injiziert, um eine Anästhesie zu erreichen. 51. Anästhesie des Ischiasnervs Anästhesie des Ischiasnervs vom vorderen Zugang Anästhesietechnik. Der Patient liegt auf dem Rücken. Die Spina iliaca anterior superior und der am weitesten hervorstehende Punkt des Trochanter major des Femurs sind durch eine gerade Linie miteinander verbunden, und vom letzten Punkt aus wird eine Senkrechte zur Vorderfläche des Oberschenkels wiederhergestellt. Die Länge der Senkrechten entspricht dem Abstand zwischen der Spina iliaca anterior superior und dem Trochanter major des Femurs. Das Ende dieser Senkrechten ist der Projektionspunkt. In der physiologischen Position der unteren Extremität wird nach der Behandlung der Haut mit einer Desinfektionslösung und der Erzeugung einer „Zitronenschale“ eine 12–15 cm lange Nadel senkrecht nach unten geführt, bis sie auf dem Trochanter minus des Femurs aufliegt. Nachdem die Nadel aus dem Trochanter minus gerutscht ist, ohne die Hauptrichtung zu ändern, wird die Nadel noch tiefer eingeführt – 4–5 cm, bis eine Parästhesie auftritt. Wenn keine Parästhesie erreicht werden kann, wird die Nadel in den Knochen zurückgeführt und durch Drehen des Gliedes um 7-10 nach innen wird die Nadel erneut vorgeschoben, bis beim Patienten eine Parästhesie auftritt. Anästhesie des Ischiasnervs vom posterioren Zugang Anästhesietechnik. Der Patient liegt auf der gesunden Seite, die betäubte Extremität ist an den Hüft- und Kniegelenken in einem Winkel von 45-60° gebeugt. Vom am weitesten hervorstehenden Teil des Trochanter major des Femurs wird eine gerade Linie zur hinteren oberen Beckenwirbelsäule gezogen, von der aus eine 4–5 cm lange Senkrechte in kaudaler Richtung abgesenkt wird als Projektionspunkt für den Ischiasnerv. Die Nadel wird in einem Winkel von 90 zur Frontalebene des Körpers des Patienten eingeführt und vorgeschoben, bis Parästhesie oder Kontakt mit dem Knochen erreicht wird. Bei Bedarf wird die Nadel nach oben gezogen und etwa 0,5 cm lateral oder medial der ersten Injektion eingeführt. Die Erlangung einer Parästhesie ist obligatorisch. Es werden 20-25 ml einer 2%igen Lösung von Lidocain (Trimecain) verabreicht. Die Anästhesietechnik ändert sich nicht, wenn der Patient auf dem Bauch liegt. Anästhesie in der Kniekehle Anästhesietechnik. Die obere Ecke der Rautengrube befindet sich auf Höhe der Patellaoberkante. Der Injektionspunkt liegt 1-1,5 cm unterhalb des oberen Winkels auf der von diesem Winkel abgesenkten Winkelhalbierenden, gebildet von außen durch die Sehne des M. biceps femoris, von innen durch die Sehnen der Mm. semimembranosus und semitendinosus des Oberschenkels. Die Bewegungsrichtung der Nadel ist strikt vertikal, wobei sich der Patient in Bauchlage befindet, bis eine Parästhesie des N. tibialis erreicht wird. In Abwesenheit von Parästhesien wird die Nadel fächerförmig gerichtet und jedes Mal auf die Ebene des Unterhautgewebes gezogen. Nach einem Aspirationstest werden 5-10 ml einer 2% igen Trimecainlösung injiziert. Um den N. peronaeus communis von derselben Stelle aus zu blockieren, wird die Nadel seitlich in einem Winkel von 30-45 zur Frontalebene gerichtet. Nach Erhalt der Parästhesie werden 5-10 ml einer 2% igen Trimecainlösung injiziert. Es gibt keine Komplikationen oder Kontraindikationen. 52. Komplikationen der Regionalanästhesie Während der RA treten Komplikationen ziemlich selten auf und können in zwei Gruppen eingeteilt werden. 1. Spezifisch, die sich eher auf die technischen Fehler der Methodik beziehen: 1) irrtümliche Injektion eines Lokalanästhetikums in den Spinalkanal oder Epiduralraum, intravenös oder intraarteriell (mit Anästhesie des Plexus cervicalis, Anästhesie des Plexus lumbalis mit Leistenzugang); 2) Punktion von Hohlräumen und Organen (Pleurahöhle, Lunge); 3) die Bildung eines Hämatoms mit Vernachlässigung der Punktion und Beschädigung eines großen Gefäßes; Hämatom komprimiert das umgebende Gewebe oder das neurovaskuläre Bündel; 4) verlängerte und schwere Hypotonie, die bei schneller Resorption des Lokalanästhetikums auftritt; 5) Trauma des Nervenplexus oder -leiters mit dem Ende der Injektionsnadel während grober Manipulation; 6) das Fehlen einer analgetischen Wirkung nach Plexus- oder Leitungsanästhesie. 2. Unspezifisch, manifestiert sich hauptsächlich durch allgemeine und lokale Reaktionen des Körpers auf die Wirkung eines Lokalanästhetikums in Form von toxischen und allergischen Reaktionen. Je nach Zeitpunkt, Dosis und Ort der Verabreichung des Anästhetikums können unspezifische Komplikationen auftreten. In diesem Fall überwiegen Läsionen des zentralen Nervensystems oder des Herz-Kreislauf-Systems. Komplikationen von der Seite des Zentralnervensystems können mild (nur auf zentrale Erregung beschränkt) oder schwerwiegend sein, was sich durch Hemmung des Zentralnervensystems mit möglicher vollständiger Lähmung manifestiert. Die Art unspezifischer Komplikationen: 1) eine Überdosis Anästhetikum bei gleichzeitiger intraarterieller oder intravenöser Verabreichung einer großen Dosis (mehr als 1 g) Trimecain oder Lidocain; 2) allergische Reaktionen auf die Einführung eines Lokalanästhetikums, gekennzeichnet durch einen Symptomkomplex von Störungen des zentralen Nervensystems und des Herz-Kreislauf-Systems: Angstzustände, Bewusstseinsstörungen, Sprachstörungen, Muskelzuckungen, Krämpfe, tiefe Atmung, Herzrhythmusstörung, QR-Erweiterung, Senkung des Blutdrucks, Tachykardie , Apnoe, Asystolie; 3) infektiöse Komplikationen aufgrund einer minderwertigen Verarbeitung des Operationsfeldes am Ort der Anästhesie; 4) die Entwicklung einer Hypotonie bei Plexus- und Leitungsanästhesie ist viel seltener als bei Epidural- und Spinalanästhesie; 5) Bei der Einführung konzentrierter Lösungen von Lokalanästhetika in einem kleinen Prozentsatz der Fälle wird die Entwicklung einer Bradykardie festgestellt. 53. Lumbalanästhesie Blockade nach Vishnevsky Diese Art der Anästhesie wird durch Injektion eines Anästhetikums in den Wirbelkanal erreicht. Die Technik der Lumbalpunktion wird in Vortrag Nr. 2 beschrieben. Die Besonderheiten bestehen darin, dass die Punktionsebene höher liegt (T12-1_1, L1-L2) und nach dem Entfernen des Dorns von der Nadel sofort ein Anästhetikum injiziert wird. Das Volumen des Anästhetikums beträgt 3-5 ml. Naropin wird in einer Konzentration von 0,5 %, Lidocain in einer Konzentration von 2 % und Marcain in einer Konzentration von 0,5 % verabreicht. Die Dauer der Anästhesie beträgt 4-6 Stunden.Diese Art der Anästhesie verursacht auch eine starke Hypotonie. Bei einem hohen Anästhesieniveau (T12-L1) ist eine Ateminsuffizienz möglich. Die häufigste Komplikation sind Kopfschmerzen. Zervikale vagosympathische Blockade nach A. V. Vishnevsky Der Patient wird auf dem Rücken auf den Tisch gelegt, so dass die Hand auf der Seite der vorgeschlagenen Blockade über die Tischkante hängt. Der M. sternocleidomastoideus sollte entspannt sein. Eine Rolle wird unter den Schultergürtel gelegt, der Kopf wird in die entgegengesetzte Richtung zurückgezogen; In dieser Position sind die anatomischen Konturen des Halses gut umrissen. Das Feld wird mit Alkohol und Jod geschmiert. Der Arzt steht auf der Seite der gleichnamigen Blockade. Die Injektionsstelle ist der Winkel, der durch den Schnittpunkt der hinteren Kante des M. sternocleidomastoideus mit einer Vene gebildet wird. Der Zeigefinger der linken Hand wird am hinteren Rand des M. sternocleidomastoideus über der Stelle platziert, an der er sich mit der äußeren Jugularvene kreuzt. Sie drücken einen Finger stark auf diese Stelle und versuchen, das neurovaskuläre Bündel zur Mittellinie zu bewegen. In diesem Fall fühlt der Finger leicht die Vorderfläche der Halswirbel. Die Injektion der Nadel und ihr Vorschub sollte langsam erfolgen, nach oben und innen, während man sich die ganze Zeit auf die vordere Oberfläche der Wirbelsäule konzentriert. Die Nadel bewegt sich entlang der 2%igen Novocain-Lösung, die in kleinen Portionen (3-0,25 cm) gesendet wird, was die Sicherheit der Injektion gewährleistet. Die Spritze wird während der Injektion zwecks Kontrolle immer wieder von der Nadel abgezogen. Nachdem sie die Nadel zum Wirbel gebracht haben, spüren sie, wie sie daran anliegt. Dann wird der Druck auf die Nadel geschwächt, wodurch sie sich um 1-2 mm wegbewegt, wonach 40 bis 60 ml einer Lösung injiziert werden, die sich in einem kriechenden Infiltrat entlang der prävertebralen Aponeurose ausbreitet und den sympathischen Vagus bedeckt , und oft Zwerchfellnerven, die die Übertragung von Reizungen aus der pleuropulmonalen Region unterbrechen (blockieren). Die Wirksamkeit der vagosympathischen Blockade wird durch das Auftreten des Horner-Symptoms (Verengung der Pupille, Verengung der Lidspalte und Retraktion des Augapfels) belegt. Atemrhythmus und Puls werden seltener, Atemnot und Zyanose nehmen ab, das Allgemeinbefinden bessert sich. Um zu vermeiden, dass die Nadel in die Gefäße des Halses gerät, sollte der Sternocleidomastoideus-Muskel mit dem darunter liegenden neurovaskulären Bündel mit dem Zeigefinger stark genug zur Mittellinie bewegt werden. Es ist wichtig, die Nadel nach oben und nach innen zu richten, da eine Bewegung in horizontaler Richtung droht, eine Lösung unter die prävertebrale Aponeurose und eine nachfolgende Komplikation in Form eines Schmerzsyndroms einzuführen, das tagsüber nicht aufhört. 54. Beurteilung der Schwere des Patienten Beurteilung des somatischen Zustands des Patienten. 1 Punkt - Patienten, deren Krankheit lokalisiert ist und in der Regel keine systemischen Störungen verursacht, d.h. praktisch gesunde Menschen. 2 Punkte - Dies schließt Patienten mit unausgeprägten Störungen ein, die die Vitalaktivität des Körpers mäßig stören, ohne ausgeprägte Verschiebungen der Homöostase. 3 Punkte - Patienten mit lebenswichtigen systemischen Störungen, die die Funktion des Körpers erheblich stören, aber nicht zu einer Behinderung führen. 4 Punkte - Patienten mit schweren systemischen Störungen, die eine hohe Gefahr für das menschliche Leben darstellen und zu einer Behinderung führen. 5 Punkte - Patienten, deren Zustand als kritisch angesehen wird, das Sterberisiko innerhalb von 24 Stunden ist hoch. Umfang und Art des chirurgischen Eingriffs: 1 Punkt - Kleine Operationen für: Entfernung von oberflächlich gelegenen und lokalisierten Tumoren, Eröffnung kleiner Abszesse, Amputation von Fingern und Zehen, Ligatur und Entfernung von Hämorrhoiden, unkomplizierte Appendektomie und Herniotomie. 2 Punkte - Operationen mittlerer Schwere: Entfernung oberflächlich gelegener bösartiger Tumore, die einen längeren Eingriff erfordern; Öffnung von in Hohlräumen lokalisierten Abszessen; Amputation und Exartikulation der oberen und unteren Extremitäten; Operationen an peripheren Gefäßen; komplizierte Appendektomie und Herniotomie, die einen umfangreichen Eingriff erfordern; Probethorakotomie und Laparotomie; andere ähnlich in Komplexität und Umfang der Intervention. 3 Punkte - umfangreiche chirurgische Eingriffe: radikale Operationen an den Bauchorganen (außer den oben aufgeführten); radikale Operationen an den Organen der Brusthöhle. verlängerte Gliedmaßenamputationen, wie transiliosakrale Amputation; Gehirnoperation. 4 Punkte - Operationen am Herzen, große Gefäße und andere komplexe Eingriffe, die unter besonderen Bedingungen durchgeführt werden (künstlicher Kreislauf, Hypothermie usw.). Klassifikation des objektiven Status des Patienten, entwickelt von der American Society of Anesthesiologists (ASA). 1. Es liegen keine systemischen Störungen vor. 2. Leichte systemische Störungen ohne funktionelle Beeinträchtigung. 3. Mittelschwere und schwere systemische Erkrankungen mit Funktionsstörungen. 4. Schwere systemische Erkrankung, die ständig lebensgefährlich ist und zu Funktionsausfällen führt. 5. Endstadium, hohes Todesrisiko tagsüber, unabhängig von der Operation. 6. Hirntod, Organspende zur Transplantation. 55. Künstliche Lungenbeatmung Die künstliche Lungenbeatmung (ALV) sorgt für einen Gasaustausch zwischen der Umgebungsluft (oder einem bestimmten Gasgemisch) und den Lungenbläschen und wird als Mittel zur Wiederbelebung bei plötzlichem Atemstillstand als Bestandteil der Anästhesie eingesetzt und als Mittel zur Intensivpflege bei akutem Atemversagen sowie einigen Erkrankungen des Nerven- und Muskelsystems. Moderne Methoden der künstlichen Lungenbeatmung (ALV) können in einfache und Hardware-Methoden unterteilt werden. In Notfallsituationen (Apnoe, pathologischer Rhythmus, agonale Atmung, zunehmende Hypoxämie und (oder) Hyperkapnie sowie grobe Stoffwechselstörungen) wird üblicherweise eine einfache Methode der mechanischen Beatmung eingesetzt. Am einfachsten sind exspiratorische Methoden der maschinellen Beatmung (künstliche Beatmung) von Mund zu Mund und von Mund zu Nase. Hardware-Methoden werden verwendet, wenn eine langfristige mechanische Beatmung erforderlich ist (von einer Stunde bis zu mehreren Monaten und sogar Jahren). Das Atemschutzgerät Phase-50 verfügt über großartige Fähigkeiten. Das Vita-1-Gerät ist für die pädiatrische Praxis konzipiert. Das Beatmungsgerät wird über einen Endotrachealtubus oder eine Tracheotomiekanüle mit den Atemwegen des Patienten verbunden. Die Hardware-Beatmung erfolgt im Normalfrequenzmodus, der zwischen 12 und 20 Zyklen pro Minute liegt. In der Praxis gibt es Hochfrequenzbeatmungen (mehr als 1 Zyklen pro Minute), bei denen das Atemzugvolumen deutlich reduziert wird (auf 60 ml oder weniger), der Überdruck in der Lunge am Ende der Inspiration sowie im intrathorakalen Bereich reduziert wird Der Druck und die Durchblutung des Herzens werden verbessert. Außerdem wird mit dem Hochfrequenzmodus die Anpassung (Anpassung) des Patienten an das Beatmungsgerät erleichtert. Es gibt drei Methoden der Hochfrequenzbeatmung: volumetrisch, oszillierend und Jet. Das Volumen wird normalerweise mit einer Atemfrequenz von 80-100 pro 1 Minute durchgeführt, oszillierende IVL - 600-3600 pro 1 Minute, was die Vibration eines kontinuierlichen oder intermittierenden Gasflusses gewährleistet. Die am weitesten verbreitete Jet-Hochfrequenzbeatmung mit einer Atemfrequenz von 100-300 pro Minute, bei der ein Sauerstoffstrahl mit einem Druck von 1-2 atm durch eine Nadel oder einen Katheter mit einem Durchmesser von 2-4 in die Atemwege geblasen wird mm. Es wird auch eine Hilfsbeatmung durchgeführt, allerdings bleibt in diesem Fall die Spontanatmung des Patienten erhalten. Die Gaszufuhr erfolgt nach einem schwachen Einatemversuch des Patienten oder die Synchronisierung des Patienten auf einen individuell gewählten Betriebsmodus des Gerätes. Es gibt auch einen Modus der intermittierenden mandatorischen Beatmung (PPVL), der beim schrittweisen Übergang von der künstlichen Beatmung zur Spontanatmung eingesetzt wird. In diesem Fall atmet der Patient selbstständig, zusätzlich wird jedoch ein kontinuierlicher Gasgemischstrom in die Atemwege geleitet. Vor diesem Hintergrund führt das Gerät mit einer festgelegten Frequenz (von 10 bis 1 Mal pro Minute) eine künstliche Inhalation durch, die mit der spontanen Inhalation des Patienten zusammenfällt (synchronisierte PPVL) oder nicht zusammenfällt (unsynchronisierte PPVL). Eine schrittweise Reduzierung der künstlichen Beatmung bereitet den Patienten auf eine selbstständige Atmung vor. 56. Infusionstherapie Infusionstherapie ist eine Tropfinjektion oder Infusion intravenös oder unter die Haut von Arzneimitteln und biologischen Flüssigkeiten zur Normalisierung des Wasser-Elektrolyt-, Säure-Basen-Gleichgewichts des Körpers sowie zur forcierten Diurese (in Kombination mit Diuretika). Indikationen für die Infusionstherapie: alle Arten von Schock, Blutverlust, Hypovolämie, Flüssigkeits-, Elektrolyt- und Proteinverlust durch unbeugsames Erbrechen, starker Durchfall, Flüssigkeitsverweigerung, Verbrennungen, Nierenerkrankungen; Verstöße gegen den Gehalt an basischen Ionen (Natrium, Kalium, Chlor usw.), Azidose, Alkalose und Vergiftungen. Kristalloide Lösungen sind in der Lage, den Mangel an Wasser und Elektrolyten auszugleichen. Tragen Sie 0,85%ige Natriumchloridlösung, Ringer- und Ringer-Locke-Lösungen, 5%ige Natriumchloridlösung, 5-40%ige Glucoselösungen und andere Lösungen auf. Sie werden intravenös und subkutan, per Strahl (bei starker Dehydratation) und Tropfinfusion in einem Volumen von 10-50 ml/kg oder mehr verabreicht. Die Ziele der Infusionstherapie sind: Wiederherstellung des BCC, Beseitigung der Hypovolämie, Sicherstellung eines angemessenen Herzzeitvolumens, Aufrechterhaltung und Wiederherstellung der normalen Plasmaosmolarität, Gewährleistung einer angemessenen Mikrozirkulation, Verhinderung der Aggregation von Blutzellen, Normalisierung der Sauerstofftransportfunktion des Blutes. Kolloidale Lösungen sind Lösungen makromolekularer Substanzen. Sie tragen zur Flüssigkeitsretention im Gefäßbett bei. Hemodez, Polyglucin, Reopoliglyukin, Reogluman werden verwendet. Bei ihrer Einführung sind Komplikationen möglich, die sich in Form einer allergischen oder pyrogenen Reaktion äußern. Verabreichungswege - intravenös, seltener subkutan und tropfenweise. Die Tagesdosis überschreitet 30-40 ml/kg nicht. Sie haben eine entgiftende Qualität. Als Quelle für die parenterale Ernährung werden sie bei längerer Nahrungsverweigerung oder Unfähigkeit zur oralen Ernährung verwendet. Dextrane sind kolloidale Plasmaersatzstoffe, was sie bei der schnellen Genesung von BCC hochwirksam macht. Dextrane haben spezifische Schutzeigenschaften gegen ischämische Erkrankungen und Reperfusion, deren Risiko bei größeren chirurgischen Eingriffen immer vorhanden ist. Gefrorenes Frischplasma ist ein Produkt, das einem einzelnen Spender entnommen wird. FFP wird vom Vollblut getrennt und sofort innerhalb von 6 Stunden nach der Blutentnahme eingefroren. 30 Jahr bei 1 C in Plastiktüten gelagert. Angesichts der Labilität der Gerinnungsfaktoren sollte FFP innerhalb der ersten 2 Stunden nach schnellem Auftauen bei 37 °C transfundiert werden. Die Transfusion von gefrorenem Frischplasma (FFP) birgt ein hohes Risiko, sich mit gefährlichen Infektionen wie HIV, Hepatitis B und C usw. zu infizieren. Die Häufigkeit von anaphylaktischen und pyrogenen Reaktionen während der Transfusion von FFP ist sehr hoch, daher sollte die Verträglichkeit nach dem ABO-System berücksichtigt werden. Und für junge Frauen muss die Rh-Kompatibilität berücksichtigt werden. Autor: Kolesnikova M.A.
▪ Verfassungs- (Staats-) Recht der Russischen Föderation. Krippe ▪ Geschichte und Theorie der Religionen. Vorlesungsnotizen
Alkoholgehalt von warmem Bier
07.05.2024 Hauptrisikofaktor für Spielsucht
07.05.2024 Verkehrslärm verzögert das Wachstum der Küken
06.05.2024
▪ Eine neue Methode zur Diagnose von Angststörungen ▪ UP Xtreme i11 Einplatinencomputer ▪ Eingeschleuste Gene lösen sich ▪ Innovativer Iris-Identifikationsscanner
▪ Site-Bereich Frequenzsynthesizer. Artikelauswahl ▪ Artikel Sauna im Garten. Tipps für den Heimmeister ▪ Artikel Sassafras rot. Legenden, Kultivierung, Anwendungsmethoden ▪ Artikel Taschentuch und verschwindendes Geld. Fokusgeheimnis
Startseite | Bibliothek | Artikel | Sitemap | Site-Überprüfungen www.diagramm.com.ua |






 Arabic
Arabic Bengali
Bengali Chinese
Chinese English
English French
French German
German Hebrew
Hebrew Hindi
Hindi Italian
Italian Japanese
Japanese Korean
Korean Malay
Malay Polish
Polish Portuguese
Portuguese Spanish
Spanish Turkish
Turkish Ukrainian
Ukrainian Vietnamese
Vietnamese

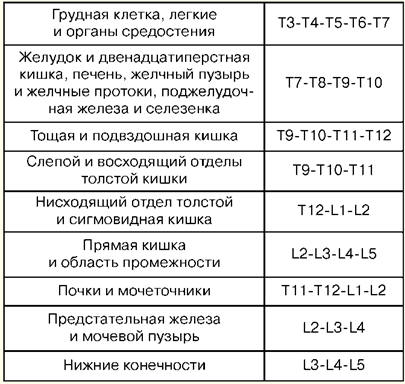


 Siehe andere Artikel Abschnitt
Siehe andere Artikel Abschnitt 