
|
Vorlesungsunterlagen, Spickzettel
Anorganische Chemie. Spickzettel: kurz das Wichtigste
Verzeichnis / Vorlesungsunterlagen, Spickzettel Inhaltsverzeichnis
1. Die Beziehung zwischen Stoffwechsel- und Energieprozessen im Körper. Thermodynamisches System Lebensvorgänge auf der Erde beruhen maßgeblich auf der Anreicherung von Sonnenenergie in biogenen Stoffen (Eiweiße, Fette, Kohlenhydrate) und der anschließenden Umwandlung dieser Stoffe in lebenden Organismen unter Freisetzung von Energie. Die Arbeiten von A. M. Lavoisier (1743-1794) und P. S. Laplace (1749-1827) zeigten durch direkte kalorimetrische Messungen, dass die während des Lebens freigesetzte Energie durch die Oxidation von Nahrungsmittelprodukten durch Sauerstoff in der von Tieren eingeatmeten Luft bestimmt wird. Mit der Entwicklung in den XIX-XX Jahrhunderten. Thermodynamik wurde es möglich, die Energieumwandlung in biochemischen Reaktionen quantitativ zu berechnen und ihre Richtung vorherzusagen. Die thermodynamische Methode basiert auf einer Reihe strenger Konzepte: "System", "Zustand des Systems", "innere Energie des Systems", "Funktion des Zustands des Systems". thermodynamisches System wird ein beliebiges Naturobjekt bezeichnet, das aus einer hinreichend großen Zahl von Molekülen (Struktureinheiten) besteht und durch eine reale oder imaginäre Grenzfläche (Interface) von anderen Naturobjekten getrennt ist. Naturobjekte, die nicht im System enthalten sind, werden als Umwelt bezeichnet. Die häufigsten Eigenschaften von Systemen sind m – die Masse der im System enthaltenen Substanz und E – die innere Energie des Systems. Die Masse der Substanz eines Systems wird durch die Gesamtmasse der Moleküle bestimmt, aus denen es besteht. Die innere Energie eines Systems ist die Summe der Energien der thermischen Bewegung von Molekülen und der Energie der Wechselwirkung zwischen ihnen. Systeme nach Art des Austauschs von Materie und Energie mit der Umgebung werden in drei Typen unterteilt: isoliert, geschlossen und offen. Isoliertes System heißt ein System, das weder Materie noch Energie mit dem Medium austauscht (Δm = 0, ΔE = 0). Ein geschlossenes System ist ein System, das keine Materie mit der Umgebung austauscht, aber Energie austauschen kann (Δm = 0, ΔE^ 0). Der Energieaustausch kann durch Übertragung von Wärme oder durch Verrichten von Arbeit erfolgen. offenes System heißt ein solches System, das sowohl Materie als auch Energie mit dem Medium austauschen kann (Δm ≠ 0, ΔE ≠ 0). Ein wichtiges Beispiel für ein offenes System ist die lebende Zelle. Systeme werden je nach Aggregatzustand der Substanz, aus der sie bestehen, in homogene und heterogene unterteilt. In einem homogenen System gibt es keine starken Änderungen der physikalischen und chemischen Eigenschaften, wenn von einem Bereich des Systems in einen anderen übergegangen wird. Ein Beispiel für ein solches System ist Blutplasma, das eine Lösung verschiedener biogener Substanzen ist. Ein heterogenes System besteht aus zwei oder mehr homogenen Teilen. Ein Beispiel für ein heterogenes System ist Vollblut, also Plasma mit Zellen – Erythrozyten und Leukozyten. 2. Der erste Hauptsatz der Thermodynamik. Begriffe, die das System charakterisieren Der erste Hauptsatz der Thermodynamik bietet einen rigorosen quantitativen Rahmen für die Analyse der Energie verschiedener Systeme. Um es zu formulieren, ist es notwendig, eine Reihe neuer Konzepte einzuführen, die das System charakterisieren. Eines der wichtigsten Konzepte ist der Zustand des Systems. Unter einem Zustand versteht man eine Menge von Systemeigenschaften, die es ermöglichen, ein System aus thermodynamischer Sicht zu definieren. Als verallgemeinertes Merkmal des Zustands des Systems werden folgende Begriffe verwendet: „Gleichgewicht“, „stationär“, „Übergangszustand“. Der Zustand des Systems wird als Gleichgewicht bezeichnet, wenn alle Eigenschaften über einen längeren Zeitraum konstant bleiben und keine Stoff- und Energieflüsse im System stattfinden. Wenn die Eigenschaften des Systems zeitlich konstant sind, aber Materie- und Energieflüsse vorhanden sind, wird der Zustand als stationär bezeichnet. Zustände werden quantitativ anhand thermodynamischer Variablen unterschieden. Thermodynamische Größen sind Größen, die den Zustand des Gesamtsystems charakterisieren. Sie werden auch thermodynamische Parameter des Systems genannt. Die wichtigsten thermodynamischen Größen sind Druck p, Temperatur T, Volumen des Systems V oder die Gesamtmasse des Systems m, die Masse der chemischen Stoffe (Komponenten) mk, aus denen das System besteht, oder die Konzentration dieser Stoffe. Es ist zu beachten, dass der Arzt ähnliche Merkmale (Temperatur, Gewicht, Zusammensetzung der biologischen Flüssigkeiten, Blutdruck) verwendet, um den Zustand des Patienten zu bestimmen. Der Übergang eines Systems von einem Zustand in einen anderen wird als bezeichnet prozess. Als Ergebnis des Prozesses ändern sich der Zustand des Systems und thermodynamische Größen. Wenn wir den Wert der thermodynamischen Größe im Anfangszustand mit X bezeichnen1 und schließlich - X2 , dann ist die Änderung dieser Größe jeweils gleich ΔX = X2 -X1 und wird als Inkrement der thermodynamischen Variablen X bezeichnet. Das mit dem entgegengesetzten Vorzeichen genommene Inkrement wird als Abnahme der Variablen X bezeichnet. Die innere Energie des Systems E ist eine der thermodynamischen Funktionen des Zustands. Ein wichtiges Merkmal staatlicher Funktionen ist ihre Unabhängigkeit von der Methode zur Erreichung eines bestimmten Systemzustands. Die Änderung der inneren Energie des Systems ΔE ergibt sich aus der Arbeit W, die bei der Wechselwirkung des Systems mit der Umgebung verrichtet wird, und dem Wärmeaustausch Q zwischen Umgebung und System, das Verhältnis zwischen diesen Größen ist das Inhalt des ersten Hauptsatzes der Thermodynamik. Die Zunahme der inneren Energie des Systems ΔE in einem Prozess ist gleich der vom System aufgenommenen Wärme Q plus der in diesem Prozess am System geleisteten Arbeit W: ∆E=Q+W. In biologischen Systemen wird normalerweise Wärme vom System an die äußere Umgebung abgegeben, und aufgrund des Verlusts an innerer Energie wird vom System Arbeit verrichtet. Es ist bequem, die mathematische Aufzeichnung des ersten Hauptsatzes der Thermodynamik in der Form darzustellen: ∆E = Q - W. Alle Größen in den obigen Formeln werden in Joule (J) gemessen. 3. Erster Hauptsatz der Thermodynamik Der erste Hauptsatz der Thermodynamik ist eines der grundlegenden Naturgesetze, das nicht aus anderen Gesetzen abgeleitet werden kann. Seine Gültigkeit wird durch zahlreiche Experimente bewiesen, insbesondere durch erfolglose Versuche, ein Perpetuum Mobile der ersten Art zu bauen, also ein solches Gerät, das beliebig lange ohne Energiezufuhr von außen arbeiten könnte. Je nach Prozessbedingungen im System werden verschiedene Zustandsfunktionen verwendet, die sich aus dem ersten Hauptsatz der Thermodynamik ableiten. Gleichzeitig werden statt komplexer biologischer Systeme vereinfachte Modelle verwendet, um Rückschlüsse auf die Umwandlungen von Masse und Energie zu ziehen. Der Druck im System wird konstant gehalten, er ist gleich dem Außendruck. Solche bei p = const auftretenden Prozesse nennt man isobar. Die in einem isobaren Prozess geleistete Expansionsarbeit ist bekanntermaßen: W = ρΔV, wobei ΔV das Volumeninkrement des Systems ist, gleich der Differenz zwischen den Volumina in den Zuständen 2 und 1. Setzen wir die Arbeit der Erweiterung in den mathematischen Ausdruck des ersten Hauptsatzes ein und führen einfache Transformationen durch, erhalten wir: Qρ = ΔE + pΔV = (E2 + ρV2) - (E1 +ρΔV1) wobei Qρ die Wärme des isobaren Prozesses ist; 1, 2 - Indizes, die sich auf den Beginn und das Ende des Prozesses beziehen. Der Wert (E + pV) ist eine Funktion des Zustands des Systems, der mit H bezeichnet und als Enthalpie bezeichnet wird: H = E + ρV. Dementsprechend kann der Ausdruck geschrieben werden als: Qp = H.2 - H1 = ∆H. Aus diesem Ausdruck folgt das Enthalpie - Zustandsfunktion, deren Inkrement gleich der vom System im isobaren Prozess aufgenommenen Wärme ist. Die Messung des Enthalpiezuwachses bei einem bestimmten Prozess kann dadurch erfolgen, dass dieser Prozess in einem Kalorimeter bei konstantem Druck durchgeführt wird. So führten A. M. Lavoisier und P. S. Laplace ihre Experimente durch und untersuchten die Energetik des Stoffwechsels in einem lebenden Organismus. In Fällen, in denen die Zustandsänderung des Systems bei konstantem Volumen auftritt, wird der Vorgang als isochor bezeichnet. In diesem Fall ist die Volumenänderung AV gleich Null und gemäß der Formel die Expansionsarbeit W = 0. Dann folgt aus dem mathematischen Ausdruck des ersten Hauptsatzes der Thermodynamik: Qv = ∆E. Die thermodynamische Definition folgt aus obiger Beziehung: innere Energie - Zustandsfunktion, deren Inkrement gleich der vom System im isochoren Prozess erhaltenen Wärme QV ist. Daher kann die Änderung der inneren Energie in einem bestimmten Prozess gemessen werden, indem dieser Prozess in einem Kalorimeter bei konstantem Volumen durchgeführt wird. Daraus folgt, dass bei ρ = const die Zuwächse der inneren Energie und der Enthalpie durch die Beziehung zusammenhängen: ∆H = ∆E + ρ∆V. 4. Hesssches Gesetz Der Teil der Thermodynamik, der sich mit der Umwandlung von Energie in chemischen Reaktionen befasst, wird als chemische Thermodynamik bezeichnet. Die Reaktionsgleichung, bei der die Änderungen der inneren Energie ΔE, der Enthalpie ΔH oder einer anderen dieser Reaktion entsprechenden Zustandsfunktion angegeben sind, heißt thermochemisch. Chemische Reaktionen, bei denen die Enthalpie des Systems abnimmt (ΔH < 0) und Wärme an die äußere Umgebung abgegeben wird, werden als bezeichnet exotherm. Reaktionen, bei denen die Enthalpie zunimmt (ΔH > 0) und das System Wärme Q aufnimmtp draußen genannt werden endothermisch. Die Oxidation von Glukose mit Sauerstoff erfolgt unter Freisetzung großer Wärmemengen (Qp = 2800 kJ/ /mol), d. h. dieser Prozess ist exotherm. Die entsprechende thermochemische Gleichung wird geschrieben als С6 Н12 О6 + 602 = 6С02 + 6Н2Oh, ΔH = 2800 kJ. Reaktionen, die in Lösung ablaufen, werden normalerweise von einer geringfügigen Volumenänderung des Systems begleitet, d. h. ΔV ≈ 0. In diesem Zusammenhang können wir in vielen Fällen bei biologischen Berechnungen davon ausgehen, dass ΔH = ΔE. Folglich ist die Wärmefreisetzung in solchen Systemen hauptsächlich auf eine Abnahme der inneren Energie als Ergebnis der Reaktion zurückzuführen und umgekehrt. Die Bildungsenthalpie der Verbindung A ist die Änderung der Enthalpie des Systems ΔHA Begleitend zur Bildung von 1 Mol Verbindung A aus einfachen Stoffen. Die Bildungsenthalpien von Sauerstoff, Kohlenstoff, Wasserstoff und allen anderen elementaren (einfachen) Stoffen werden zu Null angenommen. Unter sonst gleichen Bedingungen sind innere Energie und Enthalpie proportional zur Menge an Materie im System. Solche thermodynamischen Funktionen werden extensiv genannt. Aus thermodynamischer Sicht ist die Reaktion der allgemeinen Form nAA+SВ = nС + nD , Δh ist der Übergang des Systems aus dem Anfangszustand mit der Enthalpie H1 zu Zustand 2 mit der Enthalpie H2. Die Änderung der Enthalpie des Systems als Ergebnis dieses Übergangs, die als Enthalpie dieser Reaktion bezeichnet wird, ist gleich der Differenz: Hpja = H.2 - H1 = (NrcHc + nDHD) - (NАНА + nBHB). Das Gesetz der Konstanz der Wärmesummen wurde 1840 vom russischen Chemiker G. I. Hess entdeckt. Er ist der Entdecker der Anwendbarkeit des ersten Hauptsatzes der Thermodynamik bei chemischen Umwandlungen und der Begründer der chemischen Thermodynamik. Derzeit wird das Hesssche Gesetz als Folge des ersten Hauptsatzes der Thermodynamik betrachtet und wie folgt formuliert: Der Enthalpiezuwachs bei der Bildung bestimmter Produkte aus bestimmten Reagenzien bei konstantem Druck hängt nicht von der Anzahl und Art der Reaktionen ab, die zur Bildung führen dieser Produkte. Bei thermochemischen Berechnungen wird häufiger nicht das Hesssche Gesetz selbst verwendet, sondern seine oben für den Spezialfall der Glukoseoxidation hergeleitete Konsequenz in Form der Gleichheit (2). Für eine allgemein dargestellte Reaktion pАA+SвB = = nсC + nDD, eine Konsequenz des Hess-Gesetzes, wird mit der Gleichheit ΔH geschriebenpja = (NrCHC + nDHD) - (NAHA ++nBHB ) und ist wie folgt formuliert: Die Reaktionsenthalpie ist gleich der algebraischen Summe der Bildungsenthalpien einer stöchiometrischen Menge an Produkten minus der algebraischen Summe der Bildungsenthalpien einer stöchiometrischen Menge an Reaktanten. 5. Der zweite Hauptsatz der Thermodynamik. Gibbs freie Energie Der Körper verrichtet Arbeit, indem er innere Energie verbraucht, die in Form der Energie der chemischen Wechselwirkung der Atome seiner Bestandteile gespeichert ist. Der mathematische Ausdruck ΔE = Q - W des ersten Hauptsatzes der Thermodynamik bestimmt den genauen Zusammenhang zwischen dem inneren Energieverbrauch des Systems ΔE, der vom System geleisteten Arbeit W und der Energie Q, die in Form von Wärme verloren geht. Aus dem ersten Hauptsatz der Thermodynamik lässt sich jedoch nicht bestimmen, welcher Teil der verbrauchten inneren Energie in Arbeit umgewandelt werden kann. Theoretische Kostenschätzungen basieren auf dem zweiten Hauptsatz der Thermodynamik. Dieses Gesetz legt strenge Beschränkungen für die Effizienz der Umwandlung von Energie in Arbeit fest und erlaubt Ihnen außerdem, Kriterien für die Möglichkeit eines spontanen Ablaufs eines Prozesses einzuführen. Der Prozess wird aufgerufen spontan, wenn sie ohne jegliche Einflüsse durchgeführt wird, wenn das System sich selbst überlassen wird. Es gibt Prozesse, bei denen sich die innere Energie des Systems nicht ändert (ΔE = 0). Zu solchen Verfahren gehört beispielsweise die Ionisierung von Essigsäure in Wasser. Eine Reihe spontaner Prozesse läuft mit einem Anstieg der inneren Energie ab (ΔE > 0). Dazu gehören insbesondere typische Reaktionen der Bildung bioanorganischer Verbindungen von Albumin (Blutplasmaprotein) mit Metallionen, wie Cu2+. Die Änderung der inneren Energie AE für abgeschlossene Systeme kann nicht als Kriterium für spontane Prozesse dienen. Folglich reicht der erste Hauptsatz der Thermodynamik, aus dem sich dieses Kriterium ableitet, nicht aus, um die Frage nach der Spontaneität sowie der Effizienz von Prozessen zu lösen. Die Lösung dieser Fragen gelingt mit Hilfe des zweiten Hauptsatzes der Thermodynamik. Um den zweiten Hauptsatz der Thermodynamik zu formulieren, ist es notwendig, die Konzepte reversibler und irreversibler Prozesse im thermodynamischen Sinne einzuführen. Befindet sich das System im Gleichgewicht, wird dieser Zustand unter gleichen äußeren Bedingungen unbegrenzt aufrechterhalten. Wenn sich äußere Bedingungen ändern, kann sich der Zustand des Systems ändern, d.h. es kann ein Prozess im System stattfinden. Ein Prozess heißt thermodynamisch reversibel, wenn beim Übergang vom Anfangszustand 1 in den Endzustand 2 alle Zwischenzustände im Gleichgewicht sind. Ein Prozess heißt thermodynamisch irreversibel, wenn mindestens einer der Zwischenzustände Nichtgleichgewicht ist. Ein reversibler Prozess kann nur mit einer ausreichend langsamen Änderung der Parameter des Systems – Temperatur, Druck, Stoffkonzentration usw. – durchgeführt werden. Die Änderungsrate der Parameter muss so sein, dass Abweichungen vom Gleichgewicht, die während des Prozesses auftreten, vernachlässigbar sind. Es ist zu beachten, dass die Reversibilität mit einem wichtigen medizinischen Problem verbunden ist – der Gewebeerhaltung bei niedrigen Temperaturen. Reversible Prozesse sind der Grenzfall realer Prozesse, die in der Natur vorkommen und in der Industrie oder im Labor durchgeführt werden. 6. Der zweite Hauptsatz der Thermodynamik. Entropie Maximale Arbeit Wмакс, die bei gegebenem Verlust an innerer Energie ΔE beim Übergang von Zustand 1 nach Zustand 2 erhalten werden kann, wird nur dann erreicht, wenn dieser Vorgang reversibel ist. Gemäß dem Ausdruck für den ersten Hauptsatz der Thermodynamik ist die minimale Wärme Qmin Qmin \uXNUMXd ΔE - Wмакс . Der maximal erreichbare Wirkungsgrad, der die Wirtschaftlichkeit der inneren Energie des Systems charakterisiert, ist jeweils gleich ηмакс= W.макс /ΔE. Bei einem irreversiblen Übergang von Zustand 1 nach Zustand 2 ist die vom System verrichtete Arbeit kleiner als W. Zur Berechnung des Maximalfaktors hмакс bei einem bekannten Wert von ΔE ist es notwendig, den Wert von W zu kennenмакс oder Qmin Wмакс = ΔE - Qmin , also ηмакс = 1 - ΔE / Qmin . Q-Wertmin kann aus dem zweiten Hauptsatz der Thermodynamik unter Verwendung einer thermodynamischen Zustandsfunktion namens Entropie berechnet werden. Der Begriff der Entropie wurde (1865) von dem deutschen Physiker R. Yu Clausius (1822-1888), einem der Begründer der Thermodynamik und der molekularkinetischen Theorie thermischer Prozesse, eingeführt. Thermodynamische Definition der Entropie nach Clausius: Entropie ist eine Zustandsfunktion, deren Schrittweite ΔS gleich der Wärme Q istmin in einem reversiblen isothermen Prozess dem System zugeführt, dividiert durch die absolute Temperatur T, bei der der Prozess durchgeführt wird: ∆S = Qmin / T. Aus der Formel folgt, dass die Einheit der Entropie J/K ist. Ein Beispiel für einen reversiblen isothermen Prozess ist das langsame Schmelzen von Eis in einer Thermoskanne mit Wasser bei 273°K. Es wurde experimentell festgestellt, dass zum Schmelzen von 1 Mol Eis (18 g) mindestens 6000 J Wärme zugeführt werden müssen. In diesem Fall erhöht sich die Entropie des Eis-Wasser-Systems in der Thermoskanne um ΔS = 6000 J: 273°K = 22 J/K. Wenn eine Thermoskanne mit Wasser auf 273°K gekühlt wird, können 6000 J Wärme langsam abgeführt werden und 1 mol Eis wird während der Kristallisation von Wasser gebildet. Für diesen Prozess ist Qmin hat in der Formel einen negativen Wert. Dementsprechend nimmt die Entropie des Eis-Wasser-Systems bei der Bildung von 1 Mol Eis um ΔS = 22 J/K ab. Ebenso ist es möglich, die Entropieänderung für beliebige isotherme physikalische und chemische Prozesse zu berechnen, wenn die dem System bei diesen Prozessen zugeführte oder entzogene Wärme bekannt ist. Wie aus der Physik bekannt, kann diese Wärme durch kalorimetrische Messungen bestimmt werden. Somit ist die Änderung der Entropie sowie zwei weitere Funktionen des Systemzustands – innere Energie und Enthalpie – eine experimentell bestimmte Größe. Die physikalische Bedeutung der Entropie sowie der inneren Energie wird deutlich, wenn man Prozesse in isolierten Systemen aus molekularkinetischer Sicht betrachtet. 7. Boltzmann-Formel Isolierte Systeme tauschen definitionsgemäß weder Materie noch Energie mit der Umgebung aus. Natürlich gibt es solche Systeme in der Natur nicht wirklich. Eine sehr gute Isolierung kann jedoch erreicht werden, indem das System in eine mit einem Korken verschlossene Thermoskanne gestellt wird. Es stellt sich heraus, dass jeder spontane Prozess in einem isolierten System nur dann stattfinden kann, wenn er durch eine Zunahme der Entropie gekennzeichnet ist; im Gleichgewicht ist die Entropie des Systems konstant: ∆S ≥ 0. Diese auf experimentellen Beobachtungen beruhende Aussage ist eine der möglichen Formulierungen des zweiten Hauptsatzes der Thermodynamik. Ein Prozess, der nach dem zweiten Hauptsatz der Thermodynamik umgekehrt zu spontan ist, kann in einem isolierten System nicht ablaufen, da ein solcher Prozess durch eine Abnahme der Entropie gekennzeichnet ist. Eine Untersuchung verschiedener isolierter Systeme zeigt, dass spontane Prozesse immer mit einer Zunahme der Zahl der Mikrozustände w des Systems verbunden sind. Bei den gleichen Prozessen steigt die Entropie S des Systems, d. h. die Entropie steigt mit zunehmender Zahl der Mikrozustände. Zum ersten Mal wurde die Existenz einer solchen Abhängigkeit von dem österreichischen Physiker L. Boltzmann bemerkt, der 1872 die Beziehung vorschlug: КБ =R/NA = 1,38-1023 J/K, wo KБ - Boltzmann-Konstante, gleich dem Verhältnis der Gaskonstante R zur Avogadro-Konstante NA . Diese Beziehung wird als Boltzmann-Formel bezeichnet. Die Boltzmann-Formel ermöglicht es, die Entropie eines Systems theoretisch aus der Anzahl seiner möglichen Mikrozustände zu berechnen. Solche Berechnungen stimmen gut mit den experimentell ermittelten Werten überein. Insbesondere ist bekannt, dass die Zahl der Mikrozustände kristalliner Substanzen bei 0°K nahe bei w liegt0 „1. Damit lassen sich die Absolutwerte der Entropie kristallisierender Stoffe bestimmen, im Gegensatz zur inneren Energie E und Enthalpie H, für die nur relative Werte bestimmt werden können. Eine Zunahme der Anzahl von Mikrozuständen eines Systems kann in vielen Fällen mit einer Zunahme der Unordnung in diesem System verbunden sein, mit einem Übergang zu wahrscheinlicheren Verteilungen der Energie des Systems. Basierend auf der Boltzmann-Beziehung kann man eine molekularkinetische Definition der Entropie geben. Entropie ist ein Maß für die Wahrscheinlichkeit, dass sich ein System in einem bestimmten Zustand befindet, oder ein Maß für die Unordnung des Systems. Die Bedeutung des Begriffs der Entropie ergibt sich aus der Tatsache, dass es auf der Grundlage dieses Werts möglich ist, die Richtung spontaner Prozesse vorherzusagen. Die Anwendbarkeit der Messung der Entropie als Richtungskriterium von Prozessen ist jedoch gemäß der Formulierung des zweiten Hauptsatzes der Thermodynamik auf isolierte Systeme beschränkt. 8. Gibbs-Energie Als Kriterium für die Spontaneität von Prozessen in offenen und geschlossenen Systemen wird eine neue Zustandsfunktion eingeführt – die Gibbs-Energie. Diese Funktion wurde nach dem großen amerikanischen Physiker D. W. Gibbs (1839-1903) benannt, der diese Funktion ableitete und sie dann in thermodynamischen Arbeiten verwendete. Die Gibbs-Energie wird anhand der Enthalpie H und der Entropie S bestimmt, wobei die Beziehungen verwendet werden: G = H - S, ∆G = ∆H - ∆S. Basierend auf der Gibbs-Energie lässt sich der zweite Hauptsatz der Thermodynamik wie folgt formulieren: unter isobaren isothermen Bedingungen (p, T = const) können spontan nur solche Prozesse im System ablaufen, wodurch die Gibbs-Energie des Systems abnimmt (ΔG < 0). das System ändert sich nicht (G = const, AG = 0). ΔG < 0, p, T = konst. Aus dem Vorhergehenden folgt, dass die Gibbs-Energie eine wichtige Rolle bei der Untersuchung bioenergetischer Prozesse spielt. Mit dieser Zustandsfunktion können Sie die Richtung spontaner Prozesse in biologischen Systemen vorhersagen und die maximal erreichbare Effizienz berechnen. Die Gibbs-Energie G ist wie die Enthalpie H eine Funktion des Systemzustands. Daher kann die Änderung der Gibbs-Energie ΔG ähnlich wie die Änderung der Enthalpie ΔH zur Charakterisierung chemischer Umwandlungen herangezogen werden. Die Reaktionsgleichungen, bei denen die diesen Reaktionen entsprechende Gibbs-Energieänderung angegeben ist, werden auch thermochemisch genannt. Chemische Reaktionen, bei denen die Gibbs-Energie des Systems abnimmt (ΔG < 0) und Arbeit verrichtet wird, nennt man exergonisch. Als endergonisch werden Reaktionen bezeichnet, bei denen die Gibbs-Energie ansteigt (ΔG > 0) und am System Arbeit verrichtet wird. Abgeleitet aus dem zweiten Hauptsatz der Thermodynamik ist die Gibbs-Energie eine Zustandsfunktion. Daher lässt sich das Hesssche Gesetz für die Gibbs-Energie ebenso wie für die Enthalpie in folgender Form formulieren: Die Änderung der Gibbs-Energie während der Bildung bestimmter Produkte aus bestimmten Reagenzien bei konstantem Druck und konstanter Temperatur hängt nicht von der Anzahl und Art der Reaktionen ab, die zur Bildung dieser Produkte führen. Ein wichtiges Beispiel für die Anwendung des Hessschen Gesetzes ist die Berechnung der Gibbs-Energie der Reaktion der Glucoseoxidation mit Disauerstoff. Die Änderung der Gibbs-Energie bei dieser Reaktion bei p = 101 kPa und T = 298°K, außerhalb des Körpers bestimmt, beträgt ΔG° = 2880 kJ/mol. Die entsprechende thermochemische Gleichung wird geschrieben als: С6Н12О6 + 6O2 = 6CO2 + 6Н2Ach, ΔGpja° = 2880 kJ/mol. In den Körperzellen verläuft diese Reaktion in mehreren aufeinanderfolgenden Stadien, die von Biochemikern untersucht wurden. Aus dem Hess'schen Gesetz kann vorhergesagt werden, dass die Summe der Gibbs-Energieänderungen in allen Zwischenreaktionen ΔG istpja: G1 +ΔG2 +ΔG3 + … + ∆Gn = ∆Gpja 🇧🇷. Die Gibbs-Energie einer Reaktion ist gleich der algebraischen Summe der Gibbs-Bildungsenergien einer stöchiometrischen Menge an Produkten minus der algebraischen Summe der Gibbs-Bildungsenergien einer stöchiometrischen Menge an Reaktanten: Gpja = (NrcGc + nDGD)(NAGA + nBGB). 9. Lösungen. Klassifizierung von Lösungen Je nach Aggregatzustand können Lösungen gasförmig, flüssig und fest sein. Jede Lösung besteht aus gelösten Stoffen und einem Lösungsmittel, obwohl diese Konzepte etwas willkürlich sind. Beispielsweise kann dieses System je nach Verhältnis der Alkohol-Wasser-Menge eine Lösung von Alkohol in Wasser oder Wasser in Alkohol sein. Üblicherweise wird als Lösungsmittel diejenige Komponente angesehen, die sich in der Lösung im gleichen Aggregatzustand wie vor der Auflösung befindet. Die Untersuchung von Lösungen ist für Ärzte von besonderem Interesse, da die wichtigsten biologischen Flüssigkeiten – Blut, Lymphe, Urin, Speichel, Schweiß – Lösungen von Salzen, Proteinen, Kohlenhydraten und Lipiden in Wasser sind. Biologische Flüssigkeiten sind am Transport von Nährstoffen (Fette, Aminosäuren, Sauerstoff), Arzneimitteln zu Organen und Geweben sowie an der Ausscheidung von Metaboliten (Harnstoff, Bilirubin, Kohlendioxid usw.) aus dem Körper beteiligt. Blutplasma ist ein Medium für Zellen – Lymphozyten, Erythrozyten, Blutplättchen. In den flüssigen Medien des Körpers bleibt die Säurekonstanz, die Konzentration von Salzen und organischen Substanzen erhalten. Diese Konstanz wird als Konzentrationshomöostase bezeichnet. Klassifizierung von Lösungen Lösungen von Stoffen mit einer Molmasse von weniger als 5000 g/mol werden als Lösungen niedermolekularer Verbindungen (LMC) bezeichnet, Lösungen von Stoffen mit einer Molmasse von mehr als 5000 g/mol werden als Lösungen hochmolekularer Verbindungen bezeichnet ( HMC). Basierend auf dem Vorhandensein oder Fehlen einer elektrolytischen Dissoziation werden NMS-Lösungen in zwei Klassen eingeteilt – Lösungen von Elektrolyten und Nichtelektrolyten. Elektrolytlösungen - Lösungen von Salzen, Säuren, Basen, Ampholyten, die in Ionen dissoziieren. Zum Beispiel KNO-Lösungen3, HCl, KOH, Al(OH)3 , Glycin. Die elektrische Leitfähigkeit von Elektrolytlösungen ist höher als die des Lösungsmittels. Lösungen von Nichtelektrolyten - Lösungen von Substanzen, die in Wasser praktisch nicht dissoziieren. Zum Beispiel Lösungen von Saccharose, Glucose, Harnstoff. Die elektrische Leitfähigkeit von Nichtelektrolytlösungen unterscheidet sich kaum von der eines Lösungsmittels. Lösungen von NMS (Elektrolyte und Nichtelektrolyte) werden im Gegensatz zu kolloidalen Lösungen als wahr bezeichnet. Echte Lösungen sind durch eine homogene Zusammensetzung und das Fehlen einer Grenzfläche zwischen dem gelösten Stoff und dem Lösungsmittel gekennzeichnet. Die Größe der gelösten Partikel (Ionen und Moleküle) ist kleiner als 109m Die meisten IUPs sind Polymere, deren Moleküle (Makromoleküle) aus einer großen Anzahl sich wiederholender Gruppen oder monomerer Einheiten bestehen, die durch chemische Bindungen miteinander verbunden sind. IUP-Lösungen werden als Polyelektrolytlösungen bezeichnet. Polyelektrolyte umfassen Polysäuren (Heparin, Polyadenylsäure, Polyasparaginsäure usw.), Polybasen (Polylysin), Polyampholyte (Proteine, Nukleinsäuren). Die Eigenschaften von HMS-Lösungen unterscheiden sich deutlich von denen von NMS-Lösungen. Sie werden daher in einem gesonderten Abschnitt behandelt. Dieses Kapitel ist Lösungen von niedermolekularen Elektrolyten, Ampholyten und Nichtelektrolyten gewidmet. 10. Wasser als Lösungsmittel Das häufigste Lösungsmittel auf unserem Planeten ist Wasser. Der Körper einer durchschnittlich 70 kg schweren Person enthält etwa 40 kg Wasser. Gleichzeitig fallen etwa 25 kg Wasser auf die Flüssigkeit in den Zellen und 15 kg extrazelluläre Flüssigkeit, die Blutplasma, Interzellularflüssigkeit, Liquor cerebrospinalis, Intraokularflüssigkeit und flüssige Inhalte des Magen-Darm-Trakts umfasst. In tierischen und pflanzlichen Organismen beträgt der Wassergehalt normalerweise mehr als 50 %, und in einigen Fällen erreicht der Wassergehalt 90-95 %. Aufgrund seiner anomalen Eigenschaften ist Wasser ein einzigartiges Lösungsmittel, das perfekt für das Leben geeignet ist. Zunächst einmal löst Wasser ionische und viele polare Verbindungen gut. Diese Eigenschaft von Wasser ist größtenteils auf seine hohe Dielektrizitätskonstante (78,5) zurückzuführen. Eine weitere große Klasse gut wasserlöslicher Substanzen sind polare organische Verbindungen wie Zucker, Aldehyde, Ketone und Alkohole. Ihre Wasserlöslichkeit erklärt sich aus der Tendenz von Wassermolekülen, polare Bindungen mit den polaren funktionellen Gruppen dieser Substanzen einzugehen, beispielsweise mit den Hydroxylgruppen von Alkoholen und Zuckern oder mit dem Sauerstoffatom der Carbonylgruppe von Aldehyden und Ketonen. Im Folgenden sind Beispiele für Wasserstoffbrückenbindungen aufgeführt, die für die Löslichkeit von Substanzen in biologischen Systemen wichtig sind. Wasser bewirkt aufgrund seiner hohen Polarität die Hydrolyse von Stoffen. Da Wasser der Hauptbestandteil der inneren Umgebung des Körpers ist, sorgt es für die Prozesse der Absorption, Bewegung von Nährstoffen und Stoffwechselprodukten im Körper. Es ist zu beachten, dass Wasser das Endprodukt der biologischen Oxidation von Stoffen, insbesondere Glukose, ist. Die Bildung von Wasser als Ergebnis dieser Prozesse geht mit der Freisetzung einer großen Energiemenge einher – etwa 29 kJ/mol. Andere anomale Eigenschaften von Wasser sind ebenfalls wichtig: hohe Oberflächenspannung, niedrige Viskosität, hohe Schmelz- und Siedepunkte und eine höhere Dichte im flüssigen Zustand als im festen Zustand. Wasser ist durch das Vorhandensein von Assoziaten gekennzeichnet - Gruppen von Molekülen, die durch Wasserstoffbrückenbindungen verbunden sind. Abhängig von ihrer Affinität zu Wasser werden die funktionellen Gruppen gelöster Partikel in hydrophil (Wasser anziehend), leicht wasserlöslich, hydrophob (Wasser abstoßend) und amphiphil eingeteilt. Zu den hydrophilen Gruppen gehören polare funktionelle Gruppen: Hydroxyl-OH, Amino-NH2 , Thiol-SH, Carboxyl-COOH. Zu hydrophoben - unpolaren Gruppen, zB Kohlenwasserstoffresten: CHXNUMX-(CH2)п -, AUS6Н5 -. Zu den hydrophilen Substanzen zählen Substanzen (Aminosäuren, Proteine), deren Moleküle beide hydrophilen Gruppen (-OH, -NH) enthalten2 , -SH, -COOH) und hydrophobe Gruppen: (CH3 - (CH2)п ,-AUS6Н5-). Beim Auflösen amphiphiler Substanzen verändert sich die Struktur des Wassers durch Wechselwirkung mit hydrophoben Gruppen. Der Ordnungsgrad von Wassermolekülen, die sich in der Nähe von hydrophoben Gruppen befinden, nimmt zu und der Kontakt von Wassermolekülen mit hydrophoben Gruppen wird minimiert. Hydrophobe Gruppen, die sich assoziieren, drängen Wassermoleküle aus ihrem Standortbereich. 11. Die Konzentration der Lösung und wie man sie ausdrückt Lösung Ein homogenes System variabler Zusammensetzung aus zwei oder mehr Stoffen in einem Gleichgewichtszustand wird als homogen bezeichnet. Die Stoffe, aus denen eine Lösung besteht, werden Lösungskomponenten genannt. Ein wichtiges Merkmal einer Lösung ist ihre Konzentration. Dieser Wert bestimmt viele Eigenschaften der Lösung. Stoffkonzentration (Lösungskomponente) ist eine Menge, die durch die Menge an gelöstem Stoff gemessen wird, die in einer bestimmten Masse oder einem bestimmten Volumen einer Lösung oder eines Lösungsmittels enthalten ist. Die am häufigsten verwendeten Arten der Konzentration sind: Massenanteil, Molkonzentration, Moläquivalentkonzentration, Molanteil, Volumenanteil, Titer. Massenanteil W(X) ausgedrückt in Bruchteilen einer Einheit, Prozent (%), ppm (ein Tausendstel Prozent) und in Teilen pro Million (ppm). Der Massenanteil wird nach den Formeln berechnet: W(X) = m(X)/m(Jahre), W(X) = m(X)/m(Jahre) × 100 %, wo m(X) - Masse der gegebenen Komponente X (gelöster Stoff), kg (g); m (Jahre) ist die Masse der Lösung, kg (g). Die molare Konzentration wird in mol/m ausgedrückt3 , mol/dm3 , mol/cm3 , mol/l, mol/ml. In der Medizin ist die Verwendung von Einheiten von mol/l vorzuziehen. Die molare Konzentration wird nach folgender Formel berechnet: C(X) =n(X)/V(pp) = m(X)/M(X) × v(rr), wo nein(X) - Menge der gelösten Substanz des Systems, mol; M(X) ist die Molmasse des gelösten Stoffes, kg/mol oder g/mol; m(X) ist die Masse des gelösten Stoffes, kg bzw. g; V(rr) - Volumen der Lösung, l. Molare Konzentration b(X) ausgedrückt in Einheiten von mol/kg. Aufzeichnungsform, zum Beispiel: b (HCl) \u0,1d XNUMX mol / kg. Berechnen Sie die molare Konzentration nach der Formel: b(X) =n(X)/m(rl) = m(X)/M(X) ×m(rl) wo m(rl) - Masse des Lösungsmittels, kg. In der Chemie ist das Konzept des Äquivalents und des Äquivalenzfaktors weit verbreitet. Äquivalent wird als reales oder bedingtes Teilchen einer Substanz X bezeichnet, das in einer bestimmten Säure-Base-Reaktion einem Wasserstoffion oder in einer bestimmten Redoxreaktion einem Elektron oder in einer bestimmten Austauschreaktion zwischen Salzen einer Ladungseinheit entspricht . Volumenanteil f(X) ausgedrückt in Bruchteilen einer Einheit oder in Prozent, wird sie nach folgender Formel berechnet: Ф(X) = V(X)/ V(rr) wo v(X) - das Volumen dieser Komponente X der Lösung; V(rr) ist das Gesamtvolumen des Lösungsmittels. Der Titer der Lösung wird mit T bezeichnet(X), Maßeinheit - kg/cm3 , g/cm3 , g/ml. Der Titer der Lösung kann nach folgender Formel berechnet werden: Т(X) = m(X)/ V(rr) wo m(X) ist die Masse der Substanz, normalerweise g; V(rr) Lösungsvolumen, ml. 12. Auflösungsprozess Die Art des Auflösungsprozesses ist komplex. Natürlich stellt sich die Frage, warum manche Stoffe in manchen Lösungsmitteln gut und in anderen schlecht oder praktisch unlöslich sind. Die Bildung von Lösungen ist immer mit bestimmten physikalischen Vorgängen verbunden. Ein solcher Prozess ist die Diffusion eines gelösten Stoffes und eines Lösungsmittels. Durch Diffusion werden Partikel (Moleküle, Ionen) von der Oberfläche der gelösten Substanz entfernt und gleichmäßig im Volumen des Lösungsmittels verteilt. Deshalb hängt die Auflösungsgeschwindigkeit ohne Rühren von der Diffusionsgeschwindigkeit ab. Die unterschiedliche Löslichkeit von Stoffen in verschiedenen Lösungsmitteln ist jedoch nicht allein durch physikalische Vorgänge zu erklären. Der große russische Chemiker D. I. Mendeleev (1834-1907) glaubte, dass chemische Prozesse bei der Auflösung eine wichtige Rolle spielen. Er bewies die Existenz von Schwefelsäurehydraten H2SO4H2OH2SO42H2OH2SO44H2O und einige andere Substanzen, zum Beispiel C2Н5OH3H2A. In diesen Fällen geht die Auflösung mit der Bildung chemischer Bindungen zwischen den Partikeln des gelösten Stoffes und dem Lösungsmittel einher. Dieser Vorgang wird als Solvatation bezeichnet, im besonderen Fall, wenn das Lösungsmittel Wasser ist, als Hydratation. Wie festgestellt wurde, können je nach Art des gelösten Stoffes durch physikalische Wechselwirkungen Solvate (Hydrate) entstehen: Ion-Dipol-Wechselwirkung (z. B. beim Auflösen von Stoffen mit ionischer Struktur (NaCI usw.). ); Dipol-Dipol-Wechselwirkung – bei der Auflösung von Stoffen mit molekularer Struktur (organische Stoffe )). Chemische Wechselwirkungen werden aufgrund von Donor-Akzeptor-Bindungen durchgeführt. Hier sind die gelösten Ionen Elektronenakzeptoren und die Lösungsmittel (Н2Ach NH3) - Elektronendonoren (z. B. die Bildung von Aquakomplexen) sowie als Folge der Bildung von Wasserstoffbrückenbindungen (z. B. die Auflösung von Alkohol in Wasser). Beweise für die chemische Wechselwirkung eines gelösten Stoffes mit einem Lösungsmittel liefern die thermischen Effekte und die Farbänderung, die die Auflösung begleiten. Wenn beispielsweise Kaliumhydroxid in Wasser gelöst wird, wird Wärme freigesetzt: KOH + xN2O \uXNUMXd KOH (N2Oh; ΔH°Lösung = 55 kJ/mol. Und wenn Natriumchlorid gelöst wird, wird Wärme absorbiert: NaCl + xH2O = NaCl(H2Oh; ΔH°Lösung = +3,8 kJ/mol. Man nennt die Wärme, die freigesetzt oder aufgenommen wird, wenn 1 Mol eines Stoffes gelöst wird Lösungswärme QLösung Nach dem ersten Hauptsatz der Thermodynamik QLösung = ΔHLösung, wo ΔHLösung ist die Enthalpieänderung beim Auflösen einer gegebenen Menge eines Stoffes. Die Auflösung von wasserfreiem weißem Kupfersulfat in Wasser führt zum Auftreten einer intensiven blauen Farbe. Die Bildung von Solvaten, Farbänderungen, thermische Effekte sowie eine Reihe anderer Faktoren weisen auf eine Änderung der chemischen Natur der Komponenten der Lösung während ihrer Bildung hin. Auflösung ist somit nach modernen Vorstellungen ein physikalisch-chemischer Vorgang, bei dem sowohl physikalische als auch chemische Wechselwirkungen eine Rolle spielen. 13. Thermodynamik des Auflösungsprozesses Nach dem zweiten Hauptsatz der Thermodynamik können sich Stoffe bei p, T = const, in jedem Lösungsmittel spontan lösen, wenn durch diesen Vorgang die Gibbs-Energie des Systems abnimmt, d.h. ΔG = (ΔН - TΔS) < 0. Der Wert von ΔН wird Enthalpiefaktor genannt, und der Wert von TΔS wird Auflösungsentropiefaktor genannt. Beim Lösen von flüssigen und festen Stoffen steigt in der Regel die Entropie des Systems (ΔS > 0), da die gelösten Stoffe von einem geordneteren in einen weniger geordneten Zustand übergehen. Der Beitrag des Entropiefaktors, der zur Erhöhung der Löslichkeit beiträgt, macht sich besonders bei erhöhten Temperaturen bemerkbar, weil dann der Faktor T groß ist und der Absolutwert des Produkts TΔS ebenfalls groß ist, bzw. die Abnahme der Gibbs Energie steigt. Wenn Gase in einer Flüssigkeit gelöst werden, nimmt die Entropie des Systems normalerweise ab (ΔS < 0), da der gelöste Stoff von einem weniger geordneten Zustand (großes Volumen) in einen geordneteren Zustand (kleines Volumen) übergeht. Eine Temperaturerniedrigung begünstigt die Auflösung von Gasen, da in diesem Fall der Faktor T kleiner und der Absolutwert des Produkts TΔS umso kleiner wird und die Abnahme der Gibbs-Energie umso größer ist, je niedriger der Wert von T ist. Während der Bildung einer Lösung kann die Enthalpie des Systems auch sowohl zunehmen (NaCl) als auch abnehmen (KOH). Die Änderung der Enthalpie des Lösungsvorgangs muss gemäß dem Hessschen Gesetz als algebraische Summe der endo- und exothermen Beiträge aller den Lösungsprozess begleitenden Prozesse betrachtet werden. Dies sind die endothermen Wirkungen der Zerstörung des Kristallgitters von Substanzen, das Aufbrechen der Bindungen von Molekülen, die Zerstörung der Anfangsstruktur des Lösungsmittels und die exothermen Wirkungen der Bildung verschiedener Wechselwirkungsprodukte, einschließlich Solvate. Zur Vereinfachung der Darstellung ist das Inkrement der Auflösungsenthalpie ΔНLösung kann als Energiedifferenz E dargestellt werdencr, aufgewendet für die Zerstörung des Kristallgitters der gelösten Substanz, und Energie ESol, freigesetzt während der Solvatation von gelösten Teilchen durch Lösungsmittelmoleküle. Mit anderen Worten, die Enthalpieänderung ist die algebraische Summe der Enthalpieänderung ΔHcr infolge der Zerstörung des Kristallgitters und einer Änderung der Enthalpie ΔНSol durch Solvatation durch Lösungsmittelpartikel: ΔNLösung = ΔHcr + ΔHSol, wo ΔHLösung - Enthalpieänderung während der Auflösung. Die Auflösung von Edelgasen in organischen Lösungsmitteln geht jedoch oft mit Wärmeaufnahme einher, beispielsweise Helium und Neon in Aceton, Benzol, Ethanol und Cyclohexan. Beim Auflösen von Feststoffen mit molekularer Kristallstruktur und Flüssigkeiten sind molekulare Bindungen nicht sehr stark und daher normalerweise ΔHSol > ΔNcr Dies führt dazu, dass die Auflösung von beispielsweise Alkoholen und Zuckern ein exothermer Prozess ist (ΔHLösung <0). Beim Lösen von Feststoffen mit einem Ionengitter ist das Energieverhältnis Ecr und ESol kann anders sein. Die bei der Solvatation von Ionen freigesetzte Energie kompensiert jedoch in den meisten Fällen nicht die Energie, die für die Zerstörung des Kristallgitters aufgewendet wird, daher ist der Auflösungsprozess endotherm. Somit ermöglichen thermodynamische Daten, die spontane Auflösung verschiedener Substanzen basierend auf dem ersten und zweiten Hauptsatz der Thermodynamik vorherzusagen. 14. Löslichkeit Wenn ein gelöster Stoff mit einem Lösungsmittel in Kontakt kommt, läuft der Vorgang der Lösungsbildung in vielen Fällen spontan ab, bis eine bestimmte Grenzkonzentration erreicht ist (Sättigung eintritt). Dies geschieht, wenn das Gleichgewicht erreicht ist, wenn die Enthalpie- und Entropiefaktoren gleich sind, d.h. ΔН = TΔS. Wenn beispielsweise Kristalle in eine Flüssigkeit eingebracht werden, gelangen Moleküle oder Ionen von der Oberfläche des Kristalls in die Lösung. Aufgrund der Diffusion werden die Partikel gleichmäßig über das Volumen des Lösungsmittels verteilt. Die Auflösung schreitet bis zur Sättigung fort. Eine Lösung, die bei einer bestimmten Temperatur die maximale Menge an gelöstem Stoff enthält und mit einem Überschuss an gelöstem Stoff im Gleichgewicht ist, wird als gesättigt bezeichnet. Eine übersättigte Lösung ist eine Lösung, deren Konzentration höher ist als die einer gesättigten Lösung. Eine Lösung mit einer niedrigeren Konzentration als eine gesättigte Lösung wird als ungesättigt bezeichnet. Die Fähigkeit eines Stoffes, sich in einem bestimmten Lösungsmittel zu lösen, wird als Löslichkeit bezeichnet. Numerisch ist die Löslichkeit eines Stoffes gleich der Konzentration seiner gesättigten Lösung. Die Löslichkeit kann in den gleichen Einheiten wie die Konzentration ausgedrückt werden, beispielsweise als Menge des gelösten Stoffes in 1 Liter einer gesättigten Lösung, mol/l, oder als Masse eines gelösten Stoffes in 100 g einer gesättigten Lösung . Die Einheit der Löslichkeit ist Gramm pro 100 g Lösungsmittel. Der entsprechende Wert wird als Löslichkeitskoeffizient bezeichnet. Die Löslichkeit hängt von der Art des gelösten Stoffes und des Lösungsmittels, der Temperatur, dem Druck und dem Vorhandensein anderer Substanzen in der Lösung ab. Einfluss auf die Löslichkeit der Art der Komponenten Die Auflösungsfähigkeit von Substanzen wird durch die Art der Wechselwirkungskräfte zwischen den Molekülen der Komponenten der Lösung X bestimmt1 ihr2 : Lösungsmittel - Lösungsmittel (X1 -X1 ), gelöster Stoff - gelöster Stoff (X2 - X2 ), Lösungsmittel - gelöster Stoff (X1 - X2 ) (Punkte zeigen molekulare Bindung an). Die Löslichkeit von Substanzen ist sehr unterschiedlich. Die Beispiele zeigen die Löslichkeit verschiedener Salze im gleichen Lösungsmittel (Wasser) und die Löslichkeit der gleichen Substanz (AgNO3 ) in verschiedenen Lösungsmitteln. Substanzen mit ionischem Bindungstyp und Substanzen, die aus polaren Molekülen bestehen, lösen sich besser in polaren Lösungsmitteln wie Wasser, Alkoholen. Diese Lösungsmittel zeichnen sich durch eine hohe Dielektrizitätskonstante aus. Die hohe Löslichkeit von Stoffen ist häufig auf die Bildung intermolekularer Bindungen, insbesondere Wasserstoffbrücken, zurückzuführen. So wird die unbegrenzte gegenseitige Löslichkeit von Wasser und Alkohol durch die Bildung von Wasserstoffbrückenbindungen zwischen Wasser- und Alkoholmolekülen erklärt, und die Auflösung von AgcI-Kristallen in einer wässrigen Ammoniaklösung wird durch die Bildung einer chemischen Donor-Akzeptor-Bindung des Silbers erklärt Ion mit Ammoniakmolekülen (AgCl ist in Wasser praktisch unlöslich). Aus dem gleichen Grund weist Pyridin, ein Lösungsmittel mit niedriger Dielektrizitätskonstante, eine sehr hohe Löslichkeit auf. Da die Löslichkeit das wahre Gleichgewicht charakterisiert, kann der Einfluss äußerer Bedingungen auf diesen Zustand (Druck, Temperatur) mit dem Le-Chatelier-Prinzip qualitativ abgeschätzt werden. Solche Bewertungen sind in der Praxis des Tieftauchens, bei der Arbeit in Hot Shops usw. erforderlich. 15. Löslichkeit von Gasen in Flüssigkeiten. Gesetze von Henry-Dalton und Sechenov Die Auflösung von Gasen in Flüssigkeiten geht fast immer mit Wärmefreisetzung einher. Daher nimmt die Löslichkeit von Gasen gemäß dem Prinzip von Le Chatelier mit steigender Temperatur ab. Dieses Muster wird häufig verwendet, um gelöste Gase (z. B. CO02) durch Kochen aus Wasser zu entfernen. Manchmal wird die Auflösung eines Gases von der Absorption von Wärme begleitet (z. B. die Auflösung von Edelgasen in einigen organischen Lösungsmitteln). In diesem Fall erhöht eine Erhöhung der Temperatur die Löslichkeit des Gases. Ein Gas löst sich nicht unbegrenzt in einer Flüssigkeit auf. Bei einer bestimmten Gaskonzentration X stellt sich ein Gleichgewicht ein:  Wenn sich ein Gas in einer Flüssigkeit löst, nimmt das Volumen des Systems erheblich ab. Daher sollte eine Druckerhöhung nach dem Prinzip von Le Chatelier zu einer Verschiebung des Gleichgewichts nach rechts führen, d. h. zu einer Erhöhung der Löslichkeit des Gases. Wenn das Gas in einer bestimmten Flüssigkeit leicht löslich ist und der Druck niedrig ist, dann ist die Löslichkeit des Gases proportional zu seinem Druck. Diese Abhängigkeit wird durch das Gesetz von Henry (1803) ausgedrückt: Die Gasmenge, die bei einer bestimmten Temperatur in einem bestimmten Flüssigkeitsvolumen im Gleichgewicht gelöst ist, ist direkt proportional zum Druck des Gases. Das Henrysche Gesetz kann in folgender Form geschrieben werden: с (X) = K.r(X) × P.(X) wo ist die Gaskonzentration in einer gesättigten Lösung, mol/l; P(X) - Gasdruck X über der Lösung, Pa; Kr(X) - Henry-Konstante für Gas X, mol × l1 × Pa1 . Die Henry-Konstante hängt von der Art des Gases, des Lösungsmittels und der Temperatur ab. Das Henrysche Gesetz gilt nur für relativ verdünnte Lösungen, bei niedrigen Drücken und ohne chemische Wechselwirkung zwischen den Molekülen des gelösten Gases und dem Lösungsmittel. Das Henrysche Gesetz ist ein Sonderfall des allgemeinen Daltonschen Gesetzes. Wenn wir über die Auflösung nicht einer gasförmigen Substanz sprechen, sondern eines Gasgemisches, dann gehorcht die Löslichkeit jeder Komponente dem Gesetz von Dalton: die Löslichkeit jeder der Komponenten des Gasgemisches bei konstanter Temperatur ist proportional zum Partialdruck der Komponente über der Flüssigkeit und hängt nicht vom Gesamtdruck der Mischung und der Individualität anderer Komponenten ab. Mit anderen Worten, bei der Auflösung eines Gasgemisches in einer Flüssigkeit ist der Partialdruck p! diese Komponente. Unter dem Partialdruck einer Komponente versteht man den Anteil des Drucks der Komponente am Gesamtdruck des Gasgemisches: Рi/ Rgemeinsam Der Partialdruck der Komponente wird nach der Formel berechnet Der russische Physiologe I. M. Sechenov (1829-1905) untersuchte die Löslichkeit von Gasen in Flüssigkeiten in Gegenwart von Elektrolyten und stellte das folgende Muster fest (Sechenov-Gesetz): Die Löslichkeit von Gasen in Flüssigkeiten in Gegenwart von Elektrolyten nimmt ab; Gase werden freigesetzt. Рi = Pgemeinsam ×(Xi) wo pi - Partialdruck der Komponente Xi; Рgemeinsam Gesamtdruck des Gasgemisches; x(Xi) ist der Molenbruch der i-ten Komponente. Der russische Physiologe I. M. Sechenov (1829-1905) untersuchte die Löslichkeit von Gasen in Flüssigkeiten in Gegenwart von Elektrolyten und stellte das folgende Muster fest (Sechenov-Gesetz): Die Löslichkeit von Gasen in Flüssigkeiten in Gegenwart von Elektrolyten nimmt ab; Gase werden freigesetzt. 16. Die Rolle der Diffusion bei Stoffübertragungsprozessen in biologischen Systemen Diffusion spielt in biologischen Systemen eine wichtige Rolle. Zunächst erfolgt die Bewegung von Nährstoffen und Stoffwechselprodukten in Gewebeflüssigkeiten durch Diffusion. Darüber hinaus wird in vielen Fällen die Geschwindigkeit physikalisch-chemischer Prozesse in lebenden Organismen durch die Diffusionsgeschwindigkeit von Reaktanten bestimmt, da die Diffusion von Reaktanten normalerweise die langsamste Stufe des Prozesses ist, während biochemische Reaktionen, an denen Enzyme beteiligt sind, sehr schnell ablaufen. Jede lebende Zelle ist von einer Membran umgeben, die dem Schutz und der Regulierung der intrazellulären Umgebung dient. Substanzen passieren Membranen durch zwei Hauptmechanismen: durch gewöhnliche Diffusion (passiver Transport) und durch energetisch aktivierten Transfer (aktiver Transport). Die innere Schicht der Membran besteht aus Kohlenwasserstoffketten. Daher sind viele kleine neutrale Moleküle und unpolare HMS-Moleküle in dieser Schicht löslich und können die Membran durch normale Diffusion entlang eines Konzentrationsgradienten passieren. Ein solcher Stofftransport wird als passiv bezeichnet. Bei der Sauerstoffanreicherung des Blutes in der Lunge spielt die Diffusion eine große Rolle. Aufgrund der großen Verzweigung ist die Oberfläche der Lungenbläschen groß (~ 80 m2), sodass sich Sauerstoff aktiv im Plasma auflöst und in die roten Blutkörperchen gelangt. Das venöse Blut ist sauerstoffarm – die Sauerstoffkonzentration im venösen Blut tendiert gegen Null. Folglich ist der Sauerstoffkonzentrationsgradient zwischen der Atmosphäre und dem in die Lunge gelangenden Blut hoch, was zu einer aktiven Absorption führt (gemäß dem Fickschen Gesetz). Die Übertragung von Stoffen von einem Bereich niedrigerer Konzentration in einen Bereich höherer Konzentration gegen einen Gradienten wird als aktiver Transport bezeichnet. Ein solcher Prozess kann nicht spontan ablaufen und erfordert Energieaufwand. Die Energiequelle ist die exergonische Hydrolysereaktion einer bioanorganischen Verbindung – Adenosintriphosphat (ATP). Eine stabile stationäre Verteilung von K-Ionen-Konzentrationen innerhalb und außerhalb der Zelle wird erreicht, wenn der Fluss von K-Ionen durch die Membran in die Zelle aufgrund passiver Diffusion gleich dem Fluss von K-Ionen aus der Zelle wird. Die Verteilung (Ionenhomöostase) wird in ähnlicher Weise für Na-Ionen erreicht, nur der aktive Transport und die kompensierende passive Diffusion von Ionen sind den entsprechenden Strömen von K-Ionen entgegengesetzt gerichtet. Das Diffusionsverfahren wird in der Medizin häufig eingesetzt. Beispielsweise wird in der klinischen Praxis eine Dialysemethode verwendet, die auf der selektiven Diffusion niedermolekularer Substanzen durch eine semipermeable Membran entlang eines Konzentrationsgradienten basiert, um ein Gerät mit „künstlicher Niere“ herzustellen. IUP-Partikel passieren keine semipermeable Membran, sodass biologische Flüssigkeiten (z. B. Blutplasma) durch Dialyse von schädlichen niedermolekularen Substanzen – „Schlacken“ (Harnstoff, Harnsäure, Bilirubin, Amine, überschüssige K-Ionen) – gereinigt werden können ), die sich bei verschiedenen Krankheiten anreichern. Bei der Reinigung gelangt das aus einer Vene abgelassene Blut des Patienten in spezielle Kammern mit semipermeablen Membranen, durch die NMS diffundieren und aus dem Plasma entfernt werden kann. Bei einer Reihe von entzündlichen Erkrankungen kommt es zur Proteinzerstörung, und im Blutplasma gibt es neben NMS auch Proteinfragmente (Peptide und Polypeptide), die ebenfalls entfernt werden müssen. 17. Senkung des Gefrierpunkts und Erhöhung des Siedepunkts von Lösungen Eine direkte Folge der Abnahme des Dampfdrucks über der Lösung ist eine Änderung des Gefrierpunkts ΔTз und Siedepunkt der Lösungen ΔТк verglichen mit den Werten dieser Größen für ein reines Lösungsmittel. Die Beziehungen zwischen diesen Größen folgen auch aus dem zweiten Hauptsatz der Thermodynamik. Der Siedepunkt einer Flüssigkeit ist die Temperatur, bei der ihr Dampfdruck gleich dem Außendruck wird (z. B. bei 101,3 kPa beträgt der Siedepunkt von Wasser 100 ° C). Der Gefrierpunkt (Kristallisation) einer Flüssigkeit ist die Temperatur, bei der der Dampfdruck über der Flüssigkeit gleich dem Dampfdruck über der festen Phase ist. Wenn wir die Gefrier- und Siedepunkte der Lösung mit T3 und Tk bezeichnen, und die gleichen Werte für das Lösungsmittel T °3 und T°к , dann erhalten wir: ΔTk = Tк - T°к > 0 XNUMX, XNUMX, XNUMX, XNUMX, ΔT3 = T°3 - T.3 > 0. Die Auswirkungen der Erhöhung des Siedepunktes und der Senkung des Gefrierpunktes von Lösungen lassen sich qualitativ mit dem Prinzip von Le Chatelier erklären. In der Tat, wenn in einem Gleichgewichtssystem "Flüssigkeit - Dampf" (z. B. H2О(H) - H2О(G)), eine lösliche, nichtflüchtige Substanz einführen, dann sinkt der Dampfdruck des Lösungsmittels über der Lösung. Um die Abnahme des Dampfdrucks auszugleichen und den vorherigen Gleichgewichtszustand zu erreichen, muss die Lösung auf eine höhere Temperatur (mehr als 373 °K) erhitzt werden, da der Prozess endotherm ist. Es gebe ein Gleichgewichtssystem "feste Phase - Flüssigkeit", zum Beispiel H2О(T) >H2О(H), bei 273°K. Wenn eine bestimmte Menge eines nichtflüchtigen Stoffes (in der festen Phase unlöslich) in der flüssigen Phase gelöst wird, nimmt die Konzentration der Wassermoleküle in der flüssigen Phase ab. Nach dem Prinzip von Le Chatelier beginnt ein Prozess, der die Wassermenge in der flüssigen Phase erhöht – das Schmelzen von Eis. Um ein neues Gleichgewicht herzustellen, muss die Lösung abgekühlt werden, d. h. die Temperatur muss gesenkt werden, da der Prozess exotherm ist. Nach dem Gesetz von Raoult für verdünnte Lösungen ist die Abnahme des Dampfdrucks proportional zur Konzentration der Lösung. Daher sollte die Erhöhung des Siedepunkts und die Verringerung des Gefrierpunkts solcher Lösungen mit zunehmender Konzentration zunehmen. Raul untersuchte das Einfrieren und Sieden von Lösungen und fand: eine Erhöhung des Siedepunkts ΔTк und Absenken des Gefrierpunkts ΔТ3 verdünnte Lösungen von Nichtelektrolyten ist direkt proportional zur molaren Konzentration der Lösung: ΔTк =Kэb(X), ΔT3 = Kз b(X), wo b(X) - molare Konzentration, mol/kg; Кз und Kэ - Proportionalitätskoeffizienten, kg × K × mol1 , die als ebulliometrische bzw. kryometrische Konstanten bezeichnet werden. Die physikalische Bedeutung der Konstanten Kэ und Kз wird klar, wenn wir b akzeptieren(X) = 1. Dann Kэ = ΔTк , und kз = ΔTз . Mit anderen Worten, die ebulliometrische Konstante ist numerisch gleich dem Anstieg des Siedepunkts einer einmolaren Lösung und die kryometrische Konstante ist gleich der Abnahme der Gefriertemperatur einer einmolaren Lösung. Ebuliometrische und kryometrische Konstanten hängen nur von der Art des Lösungsmittels ab und nicht von der Art des gelösten Stoffes (ideale Lösungen). 18. Osmotischer Druck Osmose ist das überwiegend einseitige Eindringen von Lösungsmittelmolekülen (Diffusion) durch eine semipermeable Membran aus einem Lösungsmittel in eine Lösung oder aus einer Lösung mit geringerer Konzentration in eine Lösung mit höherer Konzentration. Eine notwendige Bedingung für das Auftreten von Osmose ist das Vorhandensein eines Lösungsmittels und einer Lösung oder zweier Lösungen unterschiedlicher Konzentration, die durch eine semipermeable Membran getrennt sind. Aus thermodynamischer Sicht ist die treibende Kraft der Osmose der Wunsch des Systems, Konzentrationen auszugleichen, da in diesem Fall die Entropie des Systems zunimmt, da das System in einen weniger geordneten Zustand übergeht, die Gibbs-Energie des Systems nimmt entsprechend ab und die chemischen Potentiale gleichen sich aus. Daher ist Osmose ein spontaner Prozess. Ein einfaches Experiment kann als Illustration dienen, um den Zusammenhang zwischen dem Mechanismus der Osmose und einer Änderung des Dampfdrucks über einer Lösung zu erklären. Wenn ein Glas mit einem reinen Lösungsmittel und ein Glas mit einer Lösung einer nichtflüchtigen Substanz (die Flüssigkeitsstände in den Gefäßen sind gleich) in ein geschlossenes Glasgefäß gestellt werden, dann wird nach einer Weile der Flüssigkeitsstand in der im ersten Glas sinkt und der Füllstand der Lösung im zweiten Glas steigt. Dabei gelangt das Lösungsmittel vom ersten Becherglas in das zweite Becherglas, was (nach dem Gesetz von Raoult) auf einen geringeren Dampfdruck des Lösungsmittels über der Lösung als über dem reinen Lösungsmittel zurückzuführen ist. Somit wirkt der Luftraum zwischen dem Lösungsmittel und der Lösung als semipermeable Membran. Füllen wir ein Gefäß mit halbdurchlässigen Wänden mit einer wässrigen Glukoselösung und stellen es in ein anderes Gefäß mit Wasser, so dass die Flüssigkeitsspiegel in diesen Gefäßen übereinstimmen. Als Ergebnis der Osmose nimmt das Volumen der Lösung im ersten Behälter zu und der Flüssigkeitsspiegel in diesem Behälter steigt allmählich an. Dadurch entsteht ein zusätzlicher hydrostatischer Druck, der Osmose verhindert. Der hydrostatische Druck der Flüssigkeitssäule im osmotischen Gleichgewicht bestimmt den osmotischen Druck der Lösung. Osmotischer Druck wird der gemessene Wert des minimalen hydraulischen Drucks genannt, der auf die Lösung ausgeübt werden muss, um die Osmose zu stoppen. Gesetze des osmotischen Drucks. Van't Hoff schlug eine empirische Gleichung zur Berechnung des osmotischen Drucks verdünnter Lösungen von Nichtelektrolyten vor: π = C(X)RT, wo π - osmotischer Druck, kPa; С(X) - molare Konzentration, mol/l; R ist die universelle Gaskonstante gleich 8,31 kPa - l / (mol - K); T - absolute Temperatur, K. Obwohl das Van't-Hoff-Gesetz auf der Grundlage experimenteller Daten aufgestellt wurde, kann es aus den Bedingungen des thermodynamischen Gleichgewichts bei ΔG = 0 abgeleitet werden. Daher sollte dieses Gesetz als Folge des zweiten Hauptsatzes der Thermodynamik betrachtet werden. Der Ausdruck in obiger Form ähnelt der Clapeyron-Mendeleev-Gleichung für ideale Gase, jedoch beschreiben diese Gleichungen unterschiedliche Prozesse. 19. Die Rolle von Osmose und osmotischem Druck in biologischen Systemen Das Phänomen der Osmose spielt in vielen chemischen und biologischen Systemen eine wichtige Rolle. Osmose reguliert den Wasserfluss in Zellen und interzelluläre Strukturen. Die Elastizität von Zellen (Turgor), die die Elastizität von Geweben und die Erhaltung einer bestimmten Form von Organen gewährleistet, ist auf den osmotischen Druck zurückzuführen. Tier- und Pflanzenzellen haben Schalen oder eine Oberflächenschicht aus Protoplasma, die die Eigenschaften semipermeabler Membranen hat. Wenn diese Zellen in Lösungen mit unterschiedlichen Konzentrationen gegeben werden, wird Osmose beobachtet. Lösungen, die den gleichen osmotischen Druck haben, werden als isotonisch bezeichnet. Wenn zwei Lösungen unterschiedliche osmotische Drücke haben, ist die Lösung mit einem höheren osmotischen Druck hypertonisch gegenüber der zweiten und die zweite Lösung hypotonisch gegenüber der ersten. Wenn Zellen in eine isotonische Lösung gegeben werden, behalten sie ihre Größe und funktionieren normal. Wenn Zellen in eine hypotonische Lösung gegeben werden, gelangt Wasser aus einer weniger konzentrierten externen Lösung in die Zellen, was zu ihrer Schwellung und dann zum Bruch der Membranen und zum Ausfluss von Zellinhalten führt. Diese Zerstörung von Zellen nennt man Lyse, bei roten Blutkörperchen nennt man diesen Vorgang Hämolyse. Blut mit Zellbestandteilen, das während der Hämolyse austritt, wird wegen seiner Farbe als Lackblut bezeichnet. Wenn Zellen in eine hypertonische Lösung gegeben werden, verlässt Wasser die Zellen in einer konzentrierteren Lösung, und es wird eine Faltenbildung (Austrocknung) der Zellen beobachtet. Dieses Phänomen wird als Plasmolyse bezeichnet. Menschliche biologische Flüssigkeiten (Blut, Lymphe, Gewebeflüssigkeiten) sind wässrige Lösungen niedermolekularer Verbindungen – NaCl, KCl, CaCl, hochmolekularer Verbindungen – Proteine, Polysaccharide, Nukleinsäuren und Formelemente – Erythrozyten, Leukozyten, Blutplättchen. Ihre Gesamtwirkung bestimmt den osmotischen Druck biologischer Flüssigkeiten. Der osmotische Druck des menschlichen Blutes bei 310°K (37°C) beträgt 780 kPa (7,7 atm). Den gleichen Druck erzeugt eine 0,9%ige wässrige NaCl-Lösung (0,15 mol/l), die daher mit Blut isotonisch ist (Kochsalzlösung). Neben Na- und C1-Ionen gibt es jedoch noch andere Ionen im Blut sowie IUPs und Formelemente. Daher ist es für medizinische Zwecke richtiger, Lösungen zu verwenden, die dieselben Bestandteile und dieselbe Menge wie diejenigen enthalten, aus denen das Blut besteht. Diese Lösungen werden als Blutersatz in der Chirurgie verwendet. Der menschliche Körper ist neben dem osmotischen Druck durch Konstanz (Homöostase) und andere physikalisch-chemische Indikatoren des Blutes wie Säure gekennzeichnet. Zulässige Schwankungen des osmotischen Drucks des Blutes sind sehr gering und überschreiten selbst bei schwerer Pathologie nicht mehrere zehn kPa. Bei verschiedenen Verfahren können nur isotonische Lösungen in großen Mengen in das Blut von Menschen und Tieren injiziert werden. Bei großen Blutverlusten (z. B. nach größeren Operationen, Verletzungen) werden Patienten mehrere Liter isotonische Lösung gespritzt, um den Flüssigkeitsverlust mit Blut auszugleichen. Das Phänomen der Osmose ist in der medizinischen Praxis weit verbreitet. In der Chirurgie werden daher hypertonische Verbände verwendet (in einer hypertonischen 10% igen NaCl-Lösung getränkte Gaze), die in eitrige Wunden injiziert werden. Nach dem Gesetz der Osmose wird der Strom der Wundflüssigkeit durch die Gaze nach außen geleitet, wodurch die Wunde ständig von Eiter, Mikroorganismen und Fäulnisprodukten gereinigt wird. 20. Dissoziationsgrad (Ionisierung). Die Stärke der Elektrolyte Elektrolyte, die fast vollständig in Ionen zerfallen (ionisieren), werden als stark bezeichnet, Elektrolyte, die nicht vollständig ionisieren, werden als schwach bezeichnet. In einer Lösung aus schwachen Elektrolyten gibt es neben Ionen nichtionisierte Moleküle. Durch unvollständige Ionisierung erklärte S. Arrhenius, warum der isotonische Koeffizient von Lösungen schwacher Elektrolyte nicht ganzzahlig ist. Um die Vollständigkeit der Dissoziation quantitativ zu charakterisieren, wird der Begriff des Dissoziationsgrades (Ionisierung) eingeführt. Der Dissoziationsgrad (Ionisationsgrad) eines Elektrolyten ist das Verhältnis der Anzahl der in Ionen zerlegten Moleküle zur Gesamtzahl seiner in die Lösung eingebrachten Moleküle. Mit anderen Worten ist an der Anteil der in Ionen zerlegten Elektrolytmoleküle. Der Dissoziationsgrad an wird in Prozent oder Bruchteilen einer Einheit ausgedrückt: αн = Nн/ Np, wobei N die Anzahl der in Ionen zerlegten Elektrolytmoleküle ist; Np die Anzahl der in die Lösung eingebrachten (gelösten) Elektrolytmoleküle. Also für C(CHXNUMXCOOH) = 0,1 mol/l, Dissoziationsgrad αн = 0,013 (oder 1,3 %). Gemäß dem Dissoziationsgrad werden Elektrolyte herkömmlicherweise in starke (αн > 30 %) und schwach (αн < 3 %). Im Intervall gelten Elektrolyte als mittelstark. Fast alle Salze gelten als starke Elektrolyte. Von den wichtigsten Säuren und Basen ist H2SO4 , HCl, HBr, HI, HNO3 , NaOH, KOH, Ba(OH)2 . Die meisten organischen Säuren sowie einige anorganische Verbindungen gehören zu schwachen Elektrolyten – H2S, HCN, N2MIT3 , ALSO3 , HCl0, N2AN3IN3 Hg2CI2 ,Fe(SCN)3 . An wird experimentell bestimmt, indem die Abweichung der Kollativeigenschaften von Elektrolytlösungen von den theoretischen Abhängigkeiten für ideale Lösungen gemessen wird. Beispielsweise wird der isotonische Koeffizient i kryoskopisch bestimmt, dann der Dissoziationsgrad errechnet Bei starken Elektrolyten ist der Dissoziationsgrad ersichtlich, da sie fast vollständig in Ionen dissoziieren. Die Abweichung des isotonischen Koeffizienten i vom ganzzahligen Wissen erklärt sich für sie nicht durch das Vorhandensein nicht assoziierter Moleküle in der Lösung, sondern aus anderen Gründen. Die Dissoziation wird von der Freisetzung oder Aufnahme von Wärme begleitet. Daher muss der Dissoziationsgrad von der Temperatur abhängen. Der Einfluss der Temperatur kann nach dem Prinzip von Le Chatelier abgeschätzt werden. Erfolgt die elektrolytische Spaltung unter Wärmeaufnahme, so nimmt mit steigender Temperatur a zu, bei Wärmeabgabe ein ab. Der Grad der elektrolytischen Dissoziation wird durch die Konzentration der Lösung beeinflußt. Beim Verdünnen der Lösung steigt der Dissoziationsgrad deutlich an. Insofern ist die angegebene Einteilung der Elektrolytstärke nach dem Dissoziationsgrad αн gilt nur für Lösungen mit einer Konzentration von etwa 0,1 mol/l. Betrachtet man die elektrolytische Dissoziation als reversiblen Gleichgewichtsprozess, so erhöht die Verdünnung mit Wasser nach dem Prinzip von Le Chatelier die Anzahl der destillierten Moleküle, d.h. der Dissoziationsgrad steigt. Der Dissoziationsgrad schwacher Elektrolyte wird auch durch die Zugabe gleichnamiger Ionen beeinflusst. So erhöht die Einführung eines schwachen Elektrolyten in das Gleichgewichtssystem die Ionenkonzentration, was gemäß dem Le-Chatelier-Prinzip zu einer signifikanten Verschiebung des Dissoziationsgleichgewichts nach links führt, d. h. zu einer Verringerung des Dissoziationsgrades . So verringert die Zugabe von gleichnamigen Ionen zu einer schwachen Elektrolytlösung den Grad ihrer Dissoziation. 21. Dissoziationskonstante. Ostwalds Zuchtgesetz. Theorie der Lösungen starker Elektrolyte Quantitativ lässt sich die elektrolytische Dissoziation als reversibler Gleichgewichtsprozess durch eine durch das Massenwirkungsgesetz bestimmte Dissoziations(Ionisations)konstante charakterisieren. Das Massenwirkungsgesetz gilt streng genommen für reversible Reaktionen, also für Lösungen schwacher Elektrolyte. Beispielsweise lässt sich die Dissoziation des KtnAnm-Elektrolyten als Gleichgewichtsprozess darstellen: Ktn Anm × nKtm+ +mAn . Nach dem Massenwirkungsgesetz schreibt man die Gleichgewichtskonstante wie folgt: КД = (Ktm+)n+(Einn)m + (ktnAnm) wo (Ktm+) und einn ) - molare Gleichgewichtskonzentrationen von Elektrolytionen; (KtnAnm) ist die molare Gleichgewichtskonzentration von undissoziierten Elektrolytmolekülen; КД ist die Gleichgewichtskonstante, genannt Dissoziationskonstante. Diese Gleichung gilt nur für verdünnte Lösungen schwacher Elektrolyte. Bei der Anwendung auf konzentrierte Lösungen und auf Lösungen starker Elektrolyte muss die Gleichung modifiziert werden. Je größer die Dissoziationskonstante KД , desto mehr dissoziiert der Elektrolyt. Im Gegensatz zum Dissoziationsgrad KД hängt nur von der Art des Lösungsmittels, des Elektrolyten und der Temperatur ab, nicht jedoch von der Konzentration der Lösung. Somit sind sowohl die Konstante als auch der Grad der elektrolytischen Dissoziation quantitative Merkmale der Dissoziation. Natürlich gibt es einen Zusammenhang zwischen ihnen. Mehrbasige Säuren und mehrsaure Basen dissoziieren schrittweise. Beispielsweise erfolgt die Dissoziation von Phosphorsäure in drei Schritten:  Ähnlich für Polysäurebasen (z. B. Ca (OH)2) - Die Dissoziation erfolgt in zwei Stufen. Die schrittweise Dissoziation ist dadurch gekennzeichnet, dass die Zersetzung des Elektrolyten bei jeder nachfolgenden Stufe in geringerem Ausmaß auftritt als bei der vorherigen. Dieser Charakter der Änderung der Dissoziationskonstanten kann durch elektrostatische Anziehung auf der Grundlage des Coulombschen Gesetzes erklärt werden. Die Ionisationsenergie ist minimal, wenn ein Ion von einem Neutralelektrolytmolekül abgelöst wird. Die Ablösung eines Ions bei jedem nächsten Dissoziationsschritt erfordert zunehmende Energie, da die Entfernung eines Ions von einem Teilchen erfolgt, dessen Ladung bei nachfolgenden Schritten größer wird. Die nahezu vollständige Dissoziation starker Elektrolyte in Ionen, unabhängig von der Konzentration ihrer Lösungen, wird durch physikalische und physikalisch-chemische Forschungsmethoden bestätigt. Somit sind die Werte der Neutralisationswärme aller starken Säuren durch starke Basen in verdünnten Lösungen nahezu gleich. Unabhängig von der Art der Säure und Base erhält man den gleichen Wert AH = 56,5 kJ/mol. Diese Tatsache ist ein klarer Beweis für die vollständige Dissoziation verdünnter Lösungen von Säuren und Basen. In allen Fällen ist der gemeinsame Prozess, der während der Neutralisation abläuft, die Kombination von Ionen in einem Mol 22. Theorie der Säuren und Basen Viele Elektrolyte, insbesondere Hydroxide verschiedener Elemente E, weisen die Eigenschaften von Säuren oder Basen auf. Die Dissoziation von EON-Hydroxid kann auf zwei Arten erfolgen: 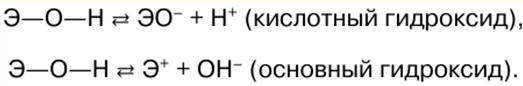 Die Lücke kann entlang beider Bindungen der Gruppe auftreten ÄON. Polarität und Stärke von Bindungen hängen bekanntlich von der unterschiedlichen Elektronegativität der Elemente, der Größe und effektiven Ladung der Atome ab. Wenn die Bruchenergie der O-H-Bindung viel kleiner ist als die Bruchenergie der E-O-Bindung, dann verläuft die Dissoziation des Hydroxids entsprechend dem Säuretyp. Wenn im Gegensatz dazu die Energie zum Brechen der O-H-Bindung viel größer ist als die Energie zum Brechen der E-O-Bindung, dann verläuft die Dissoziation gemäß dem Haupttyp. In Hydroxiden von Alkali- und Erdalkalimetallen sowie Übergangsmetallen in niedrigen Oxidationsstufen ist die Stärke der E-O-Bindung relativ gering, Sauerstoff ist stärker an Wasserstoff gebunden und die E-O-H-Dissoziation verläuft hauptsächlich nach dem basischen Typ, d. h. unter Abspaltung von Hydroxiddion . Dies liegt daran, dass die Ionen solcher Elemente ziemlich groß sind und eine kleine effektive Ladung haben, d. h. sie haben eine schwache Polarisierungsfähigkeit. Mit zunehmendem Oxidationsgrad nimmt die polarisierende Wirkung des E-Atoms zu (steigende spezifische Ladung), Sauerstoff wird fester an das Element E gebunden und die Dissoziation von E-O-H erfolgt überwiegend nach dem Säuretyp, also dem Wasserstoffion wird abgespalten. Letzteres ist mit der Umverteilung der Elektronendichte am Sauerstoffatom verbunden. Dadurch wird die E-O-Bindung stärker und die O-H-Bindung schwächer. Derzeit gibt es keine eindeutige Definition der Konzepte von Säure und Base, die gleichermaßen zur Charakterisierung von Säure-Base-Wechselwirkungen in beliebigen Lösungsmitteln verwendet werden könnten. Um viele Elektrolyte in wässrigen Lösungen zu charakterisieren, kann man immer noch die von Arrhenius gegebenen Konzepte von Säure und Base verwenden: 1) eine Säure ist ein Elektrolyt, der in Lösungen unter Bildung von Wasserstoffionen H dissoziiert; 2) die Base ist ein Elektrolyt, der in Lösungen unter Bildung von OH-Hydroxidionen dissoziiert; 3) Ampholyt (amphoteres Hydroxid) ist ein Elektrolyt, der in Lösung dissoziiert, um sowohl Wasserstoffionen als auch Hydroxidionen zu bilden. Ampholyte umfassen Hydroxide von Zink, Aluminium, Chrom und anderen amphoteren Elementen sowie Aminosäuren, Proteine, Nukleinsäuren. Die Anwendung des Prinzips von Le Chatelier auf eine Kette von Säure-Base-Gleichgewichten zeigt, dass mit zunehmender Konzentration von Hydroxydionen OH im System die Wahrscheinlichkeit einer Dissoziation vom Säuretyp zunimmt. Eine Erhöhung der Konzentration der Wasserstoffionen H+ im System führt je nach Haupttyp zu einer bevorzugten Dissoziation. Dies bedeutet, dass der Ampholyt im sauren Milieu einen basischen Charakter aufweist und im alkalischen Milieu einen sauren Charakter. Beispielsweise verhält sich Zinkhydroxid bei der Wechselwirkung mit Säuren wie eine Base: Zn (OH)2 + 2HCI - ZnCI2 + 2Н2Oh und bei Wechselwirkung mit Laugen - als Säure: Zn(OH)2+ 2 NaOH → Na2[Zn(OH)4]. 23. Blutpuffersysteme Blutplasma Puffersysteme sind von großer Bedeutung für die Aufrechterhaltung des Säure-Basen-Gleichgewichts von Organismen. Intra- und extrazelluläre Flüssigkeiten aller lebenden Organismen zeichnen sich durch einen konstanten pH-Wert aus, der mit Hilfe von Puffersystemen aufrechterhalten wird. Der pH-Wert der meisten intrazellulären Flüssigkeiten liegt im Bereich von 6,8 bis 7,8. Das Säure-Basen-Gleichgewicht des CO-Gleichgewichts im menschlichen Blut wird durch Hydrogenkarbonat-, Phosphat- und Proteinpuffersysteme bereitgestellt. Der normale pH-Wert des Blutplasmas beträgt 7,40 ± 0. Dies entspricht dem Bereich der aktiven Säurewerte von 05 bis 3,7x4,0 mol/l. Da im Blut verschiedene Elektrolyte (HC1083 , H2CO3 H2Ro4 , NRO42 ), Proteine, Aminosäuren, was bedeutet, dass sie so weit dissoziieren, dass die Aktivität von a (H +) im angegebenen Bereich liegt. Da der Gehalt an anorganischen und organischen Stoffen in Plasma und Blutkörperchen nicht gleich ist, empfiehlt es sich, diese Blutbestandteile getrennt zu betrachten. Blutplasma HCO-Puffersystem3 / N2MIT3 besteht aus Kohlensäure2MIT3 und konjugierte Base HCO3 . Dies ist das wichtigste Puffersystem des Blutes. Einer der Bestandteile ist Kohlensäure H2MIT3 - gebildet durch die Wechselwirkung von im Plasma gelöstem CO2 mit Wasser: MIT2(r) + N2Er N2MIT3. wo CO2(r) - Konzentration von gelöstem CO2 . Die Gleichgewichtskonstante dieser Reaktion ist: K = [N2MIT3] / [CO2] Zwischen CO2 in den Alveolen und dem Hydrogencarbonatpuffer im Blutplasma, das durch die Kapillaren der Lunge fließt, stellt sich eine Kette von Gleichgewichten ein. Das Hydrogencarbonat-Puffersystem wirkt als effektiver physiologischer Puffer nahe pH 7,4. Beim Eintritt in das Blut von Säuren - Spendern von H+ das Gleichgewicht in der Kette verschiebt sich nach dem Le-Chatelier-Prinzip dadurch nach links, dass HCO-Ionen3 binden H-Ionen in H-Moleküle2MIT3 . Gleichzeitig sinkt die Konzentration von H2MIT3 steigt, und die Konzentration von HCO-Ionen3 sinkt. Erhöhung der Konzentration von H2MIT3 führt zu einer Verschiebung des Gleichgewichts nach links (Prinzip von Le Chatelier). Es verursacht Verfall2MIT3 und eine Erhöhung der CO-Konzentration2 im Plasma gelöst. Dadurch verschiebt sich das Gleichgewicht nach links und der CO-Druck steigt.2 in der Lunge. Überschüssiges CO2 aus dem Körper ausgeschieden. Dadurch kommt das Hydrogencarbonatsystem des Blutes schnell ins Gleichgewicht mit CO2 in den Alveolen und erhält effektiv die Konstanz des pH-Wertes des Blutplasmas. 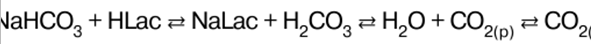 Somit wird ein normaler Blut-pH-Wert mit einer leicht ausgeprägten pH-Verschiebung aufgrund von Azidose aufrechterhalten. In geschlossenen Räumen kommt es häufig zu Erstickungserscheinungen (Sauerstoffmangel) und vermehrter Atmung. Ersticken wird jedoch weniger mit Sauerstoffmangel als vielmehr mit einem Überschuss an CO2 in Verbindung gebracht. Überschüssiges CO2 in der Atmosphäre führt nach dem Henryschen Gesetz zu einer zusätzlichen Auflösung von CO2 in Blut. Und dies führt zu einem Absinken des pH-Wertes im Blut, also zu einer Azidose. Das Hydrogencarbonat-Puffersystem reagiert am schnellsten auf Änderungen des Blut-pH-Werts. Seine Säurepufferkapazität beträgt Vк \u40d XNUMX mmol / l Blutplasma, und die Pufferkapazität für Alkali ist viel geringer und entspricht ungefähr Vщ = 1-2 mmol/l Blutplasma. 24. Neutralisationsreaktionen Neutralisationsreaktionen werden als Austauschreaktionen der Wechselwirkung von Säuren und Basen bezeichnet, bei denen Salz und Wasser gebildet werden. Betrachten Sie verschiedene Arten von Neutralisationsreaktionen. 1. Neutralisation einer starken Base mit einer starken Säure: KOH + HNO3 -KNO3 + N2O. Die molekulare Ionengleichung für eine solche Reaktion H+ + OH → h2O und der negative Wert der Gibbs-Energie ΔG° zeigen, dass das Gleichgewicht praktisch in Richtung Wasserbildung verschoben wird. Ein häufiger Fall einer Neutralisationsreaktion ist die Wechselwirkung von Säuren und Basen unterschiedlicher Stärke (Dissoziationsgrad). Diese Reaktionen laufen aufgrund der Umkehrreaktion der Salzhydrolyse nicht vollständig ab. 2. Neutralisation einer schwachen Säure mit einer starken Base:  oder in molekularer Form:  In diesem Fall ist die Neutralisationsreaktion reversibel. Die Reaktion der Neutralisation einer schwachen Base mit einer starken Säure ist ebenfalls reversibel:  oder in molekularer Form: 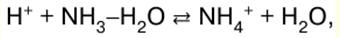 und auch - eine schwache Base mit einer schwachen Säure: 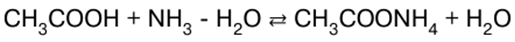 oder in molekularer Form:  In diesen Systemen ist das Gleichgewicht stark nach rechts verschoben, da Wasser ein viel schwächerer Elektrolyt ist als Blausäure, Ammoniak und Essigsäure. Neutralisationsreaktionen bilden die Grundlage des Neutralisationsverfahrens. Diese Methode wird in klinischen Labors verwendet, um den Säuregehalt von Magensaft und die Pufferkapazität von Blutplasma zu bestimmen. In der Pharmakologie wird es zur quantitativen Bestimmung von anorganischen Säuren (Salz-, Schwefel-, Borsäure) und organischen Säuren (Essig-, Benzoe-, Wein-, Zitronen-, Salicylsäure) eingesetzt. In biopharmazeutischen Studien werden der pKa von Säuren und der pKa von Basen durch die Neutralisationsmethode bestimmt, da der Wert dieser Werte die Fähigkeit von Arzneimitteln vorhersagen kann, biologische Membranen zu passieren. Zur Bestimmung des pK wird eine Säure-Base-Titration verwendetа Aminosäuren und pKа dissoziierende Gruppen in Proteinen. Proteintitrationskurven, die bei zwei verschiedenen Temperaturen erhalten wurden, können verwendet werden, um die Anzahl von Carboxyl-, Imidazol- und anderen Gruppen zu bestimmen. Die Titration von Aminosäuren und Proteinen ermöglicht die Bestimmung ihrer isoelektrischen Punkte. Hydrolyse ist die Zersetzung eines Stoffes durch Wasser. Chemische Verbindungen verschiedener Klassen können hydrolysiert werden: Proteine, Fette, Kohlenhydrate, Ester, Salze usw. In der anorganischen Chemie begegnet man ihnen am häufigsten bei der Hydrolyse von Salzen. 25. Salzhydrolyse Salzhydrolyse - Dies ist die Wechselwirkung von Salz mit Wassermolekülen, die zur Bildung von Verbindungen mit geringer Dissoziation führt. Der Prozess der Hydrolyse besteht im Übergang eines Protons von einem Wassermolekül zu einem gegebenen Ion (CO32 + HOH * HCO3+ OH ) oder von einem gegebenen Ion, einschließlich von einem hydratisierten Metallkation, zu einem Wassermolekül. Je nach Art des Salzes wirkt Wasser entweder als Säure oder als Base, und das Salz ist jeweils die konjugierte Base oder die konjugierte Säure. Je nach Salzart sind vier Varianten der Hydrolyse möglich. 1. Salze aus einer starken Säure und einer schwachen Base:  2. Salze aus einer starken Base und einer schwachen Säure: CH3COONa + HOH → CH3COOH + NaOH. 3. Salze, die aus einer schwachen Säure und einer schwachen Base gebildet werden. Ammoniumcyanid wird durch die Reaktion hydrolysiert: 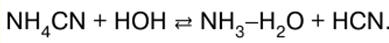 4. Salze, die durch eine starke Säure und eine starke Base gebildet werden. NaCl, KNO3 unterliegen keiner Hydrolyse. Der Mechanismus der Salzhydrolyse besteht in der polarisierenden Wechselwirkung von Salzionen mit ihrer Hydrathülle. Je stärker diese Wechselwirkung ist, desto intensiver ist die Hydrolyse. Alle betrachteten Hydrolysefälle betrafen Salze, die aus einsauren Basen und einbasigen Säuren gebildet wurden. Salze von mehrbasigen Säuren und mehrbasigen Säuren werden schrittweise hydrolysiert, wobei saure und basische Salze gebildet werden. Quantitativ wird die Hydrolyse als CO-Gleichgewicht durch den Hydrolysegrad und die Hydrolysekonstante charakterisiert. Der Hydrolysegrad wird durch das Verhältnis der Menge an hydrolysierter Substanz zur Gesamtmenge an gelöstem Stoff gemessen. Der Hydrolysegrad hängt von der Art des Salzes, seiner Konzentration und Temperatur ab. Nach dem Massenwirkungsgesetz nimmt der Hydrolysegrad mit Verdünnung der Lösung zu. Also in Konzentration Na2CO3 0,001 mol/l, der Hydrolysegrad beträgt 34 %. Im allgemeinen Fall gelten die folgenden Gesetzmäßigkeiten. 1. Die Salzhydrolyse sollte mit zunehmender Temperatur und Verdünnung der Lösung zunehmen. 2. Bei der reversiblen Hydrolyse sollte gemäß dem Le-Chatelier-Prinzip der Prozess durch Ansäuern (wenn dieses Salz durch eine starke Säure und eine schwache Base gebildet wird, reichern sich H-Ionen an) oder durch Alkalisieren (wenn das Salz durch gebildet wird) unterdrückt werden einer schwachen Säure und einer starken Base sammeln sich OH-Ionen an). 3. Die Hydrolyse von Salzen, in deren Folge schwerlösliche oder gasförmige Produkte entstehen, die aus der Reaktionssphäre entfernt werden (Prinzip der Gleichgewichtsverschiebung), ist irreversibel. Zum Beispiel Hydrolyse von Pb(SO4)2 verläuft vollständig aufgrund der Bildung eines Niederschlags von PbO2: Blei (SO4)2 + 2Н2O→PbO2 + 2H2SO4. Die Hydrolyse ist charakteristisch für viele Klassen anorganischer und organischer Verbindungen. Die Hydrolyse anorganischer Verbindungen ist wichtig für die Bewertung ihrer Toxizität. Die Hydrolyse organischer Verbindungen wird verwendet, um wertvolle Produkte aus Holz, Fetten, Estern und anderen Dingen zu gewinnen, aber die Hydrolyse spielt eine besonders wichtige Rolle im Leben lebender Organismen. 26. Fällungs- und Auflösungsreaktion Zu den in der Elektrolytlösung ablaufenden Austauschreaktionen gehören die Fällungs- und Auflösungsreaktionen. Fällungsreaktionen werden von Fällungen begleitet. Reaktionen, die mit der Auflösung von Niederschlägen einhergehen, werden Auflösungsreaktionen genannt. Weit verbreitet sind Systeme, die aus einem Depot eines schwerlöslichen Elektrolyten und einer darüber liegenden gesättigten Lösung bestehen. In solchen Systemen stellt sich ein dynamisches Gleichgewicht zwischen der gesättigten Lösung und dem Niederschlag ein. Aufgrund der geringen Löslichkeit ist die Konzentration des schwerlöslichen Elektrolyten in der Lösung sehr gering, sodass davon ausgegangen werden kann, dass er in der Lösung vollständig dissoziiert ist. Mit anderen Worten stellt sich in einer gesättigten Lösung ein dynamisches Gleichgewicht zwischen der festen Phase des Stoffes und den in die Lösung übergegangenen Ionen ein. Beispielsweise stellt sich in einer gesättigten AgCl-Lösung folgendes Gleichgewicht ein: AgCl(T) → Ag+(p) + Cl(R). Die Konzentration der Festphase AgCl als konstanter Wert ist aus dem Ausdruck für die Gleichgewichtskonstante ausgenommen. Folglich wird die Gleichgewichtskonstante nur durch das Produkt der Ionenkonzentrationen in der Lösung bestimmt und wird als Konstante oder Löslichkeitsprodukt bezeichnet. Im allgemeinen Fall wird für den Elektrolyten Ktn Anm die Löslichkeitskonstante durch das stöchiometrische Produkt der Ionenkonzentrationen bestimmt: Кпр= [Ktm+ ]n[Einn]m Dieser Wert charakterisiert die Löslichkeit des Elektrolyten bei konstanter Temperatur in Abwesenheit von Fremdstoffen. K-Konstanzпр bedeutet nicht die Konstanz der Konzentrationen einzelner Ionen in Lösung. So ist es möglich, die Konzentration von Ag-Ionen in einer gesättigten Lösung von AgCl durch Zugabe von beispielsweise AgNO zu erhöhen3 , während sich das Gleichgewicht nach dem Le-Chatelier-Prinzip nach links verschiebt, was zu einer Erhöhung der Ionenabscheidungsrate führt. Nach einiger Zeit gleichen sich die Auflösungsgeschwindigkeiten von AgCl und die Ausfällung von Ag- und Cl-Ionen an. Das neu eingestellte Gleichgewicht wird wie bisher durch den Wert K charakterisiertпр(AgCl), aber die Gleichgewichtskonzentrationen von Ag- und Cl-Ionen ändern sich. Also nach Kпр Es ist möglich, die Bildung und Auflösung von Elektrolytniederschlägen basierend auf zwei Regeln vorherzusagen. 1. Ein Elektrolyt fällt aus, wenn das stöchiometrische Produkt der Konzentrationen seiner Ionen in Lösung größer als die Löslichkeitskonstante ist. 2. Der Elektrolytniederschlag löst sich auf, wenn das stöchiometrische Produkt der Konzentrationen seiner konstituierenden Ionen in Lösung kleiner als die Löslichkeitskonstante wird. Fällungsreaktionen sind die Grundlage der Fällungsmethode, die bei der quantitativen Analyse von Arzneimitteln eingesetzt wird. Die Fällungsmethode wird bei der klinischen Analyse von Chloriden in Urin, Magensaft, Blut sowie in der Sanitär- und Hygienepraxis – bei der Analyse von Trinkwasser – eingesetzt. Wissenschaftler glauben, dass die unterschiedliche Löslichkeit natürlicher Elementverbindungen im Wasser einen großen Einfluss auf deren Gehalt in lebenden Organismen hatte. Es besteht ein enger Zusammenhang zwischen der Löslichkeit von Verbindungen in Wasser und der toxischen Wirkung von Ionen einer Reihe von Elementen. Zum Beispiel die Einführung von Al3 + in den Körper durch die Bildung von schwerlöslichem Aluminiumphosphat AlPO4 27. Redoxreaktionen Eines der grundlegenden Konzepte der anorganischen Chemie ist das Konzept der Oxidationsstufe (CO). Der Oxidationszustand eines Elements in einer Verbindung ist die formale Ladung des Atoms des Elements, berechnet aus der Annahme, dass Valenzelektronen zu Atomen mit einer höheren relativen Elektronegativität (REO) übergehen und alle Bindungen im Verbindungsmolekül ionisch sind. Der Oxidationszustand des Elements E wird oben im Elementsymbol mit einem „+“ oder „-“-Zeichen vor der Zahl angegeben. Der Oxidationszustand von Ionen, die tatsächlich in Lösung oder Kristallen vorkommen, stimmt mit ihrer Ladungszahl überein und wird ebenfalls mit einem „+“ oder „-“-Zeichen hinter der Zahl angegeben, zum Beispiel Cl, Ca2+. Die Stock-Methode wird auch verwendet, um den Oxidationsgrad in römischen Ziffern nach dem Symbol des Elements anzugeben: Mn (VII), Fe (III). Die Frage nach dem Vorzeichen der Oxidationsstufe von Atomen in einem Molekül wird anhand eines Vergleichs der Elektronegativitäten der miteinander verbundenen Atome, die das Molekül bilden, gelöst. In diesem Fall hat ein Atom mit einer niedrigeren Elektronegativität eine positive Oxidationsstufe und ein Atom mit einer höheren Elektronegativität eine negative Oxidationsstufe. Es ist zu beachten, dass der Oxidationszustand nicht mit der Wertigkeit eines Elements identifiziert werden kann. Die Valenz, definiert als die Anzahl der chemischen Bindungen, durch die ein bestimmtes Atom mit anderen Atomen verbunden ist, kann nicht gleich Null sein und hat kein „+“ oder „-“-Zeichen. Die Oxidationsstufe kann sowohl einen positiven als auch einen negativen Wert annehmen und auch einen Null- oder sogar Bruchwert annehmen. Also in einem CO-Molekül2 die Oxidationsstufe von C ist +4 und im CH-Molekül4 die Oxidationsstufe von C ist 4. Die Wertigkeit von Kohlenstoff4 a in beiden Verbindungen ist IV. Trotz der oben genannten Nachteile ist die Verwendung des Konzepts des Oxidationsgrads bei der Klassifizierung chemischer Verbindungen und der Formulierung von Gleichungen für Redoxreaktionen bequem. Wenn ein Element oxidiert wird, erhöht sich die Oxidationsstufe, mit anderen Worten erhöht das Reduktionsmittel während der Reaktion die Oxidationsstufe. Im Gegensatz dazu nimmt die Oxidationsstufe ab, wenn das Element reduziert wird, d. h. während der Reaktion verringert das Oxidationsmittel die Oxidationsstufe. Somit ist es möglich, Redoxreaktionen wie folgt zu formulieren: Redoxreaktionen sind Reaktionen, die unter einer Änderung der Oxidationsstufe der Atome der Elemente, aus denen die reagierenden Substanzen bestehen, ablaufen. 28. Oxidations- und Reduktionsmittel Um die Produkte und die Richtung von Redoxreaktionen vorherzusagen, ist es nützlich, daran zu denken, dass typische Oxidationsmittel einfache Substanzen sind, deren Atome ein großes EER > 3,0 haben (Elemente der VIA- und VIIA-Gruppen). Von diesen sind die stärksten Oxidationsmittel Fluor (OEO = 4,0), Sauerstoff (OEO = 3,0), Chlor (OEO = 3,5). Wichtige Oxidationsmittel umfassen PbO2 , KNO4 , Ca(SO4)2 , K.2Cr2O7 , HClO, HClO3, KSIO4, NaBio3, H2SO4(Ende), H.N.O.3 (Ende) Na2O2 , (NH4)2S2O8 , KSIO3 , H2O2 und andere Substanzen, die mehr oder mehr CO-Atome enthalten. Typische Reduktionsmittel sind einfache Substanzen, deren Atome einen kleinen EER < 1,5 haben (Metalle der Gruppen IA und IIA und einige andere Metalle). Wichtige Reduktionsmittel sind H2S, N.H.3, HI, KI, SnCl2 , FeSO4 , CH2 , CO, H2SO3 , cr2(SO4)3 , CuCl, Na2S2O3 und andere Substanzen, die niedrige CO-Atome enthalten. Substanzen, die Atome in den maximalen bzw. minimalen Oxidationsstufen enthalten, können nur Oxidationsmittel sein, z. B. K2sg2O7 , KMPO4 , PbO2 , HClO4 oder nur Reduktionsmittel wie NH3 , H2S, HALLO. Substanzen, die Atome in mittleren Oxidationsstufen enthalten, können die Oxidationsstufe sowohl erhöhen als auch erniedrigen, d.h. sie können sowohl Reduktionsmittel (unter Einwirkung eines aktiveren Oxidationsmittels als sie) als auch Oxidationsmittel (unter Einwirkung eines aktiveren Oxidationsmittels) sein aktiver als sie, Reduktionsmittel). Solche Substanzen weisen Redox-Dualität auf. Bei der Erstellung von Gleichungen für Redoxreaktionen können zwei Methoden verwendet werden: die Elektronenbilanzmethode und die ionenelektronische Methode (Halbreaktionsmethode). Eine korrektere Vorstellung von Redoxprozessen in Lösungen liefert die ionenelektronische Methode. Mit dieser Methode werden tatsächlich in einer Lösung vorhandene Veränderungen durch Ionen und Moleküle vorhergesagt. Neben der Vorhersage von Reaktionsprodukten sind ionische Halbreaktionsgleichungen für das Verständnis von Redoxprozessen bei der Elektrolyse und in galvanischen Zellen notwendig. Diese Methode spiegelt die Rolle der Umgebung als Teilnehmer des Prozesses wider. Und schließlich ist es bei dieser Methode nicht erforderlich, alle gebildeten Substanzen im Voraus zu kennen, da viele von ihnen durch Aufstellen der Redoxreaktionsgleichung erhalten werden. Es sollte beachtet werden, dass Halbreaktionen zwar die realen Prozesse widerspiegeln, die während Redoxreaktionen ablaufen, aber nicht mit den realen Stadien (Mechanismus) von Redoxreaktionen identifiziert werden können. Viele Faktoren beeinflussen die Art und Richtung von Redoxreaktionen: die Art der Reaktanten, die Reaktion des Mediums, Konzentration, Temperatur und Katalysatoren. Zu beachten ist, dass ein negativer Wert nicht immer zu einer eindeutigen Entscheidung über den tatsächlichen Verlauf der Reaktion in eine bestimmte Richtung führt, da zusätzlich der kinetische Faktor berücksichtigt werden muss. 29. Biologische Bedeutung von Redoxprozessen Redoxreaktionen sind chemische Prozesse, bei denen Elektronen von einem Molekül oder Ion auf ein anderes übertragen werden. Bei Redoxreaktionen laufen zwei miteinander verbundene Prozesse ab: Oxidation und Reduktion. Oxidation ist der Vorgang, bei dem Elektronen abgegeben werden. Erholung ist der Vorgang des Hinzufügens von Elektronen. Stoffe, deren Atome oder Ionen Elektronen abgeben, nennt man Reduktionsmittel. Stoffe, deren Atome oder Ionen Elektronen hinzufügen (oder ein gemeinsames Elektronenpaar an sich ziehen) werden als Oxidationsmittel bezeichnet. Bei der Reaktion von Zink mit CuSO4 Cu2 + Elektronen hinzufügen: selbst2+ + 2e־ -Si0 . Zinkatome geben Elektronen ab: Zn0 -Zn2 + 2e־. Dementsprechend ist CuSO4 - Oxidationsmittel, Zn - Reduktionsmittel. Wichtige Prozesse in tierischen Organismen sind Reaktionen der enzymatischen Oxidation von Substratsubstanzen: Kohlenhydrate, Fette, Aminosäuren. Durch diese Prozesse erhalten Organismen große Mengen an Energie. Ungefähr 90 % des gesamten Energiebedarfs eines erwachsenen Mannes wird durch die Energie gedeckt, die im Gewebe durch die Oxidation von Kohlenhydraten und Fetten entsteht. Der Rest der Energie – etwa 10 % – stammt aus dem oxidativen Abbau von Aminosäuren. Die biologische Oxidation verläuft über komplexe Mechanismen unter Beteiligung einer Vielzahl von Enzymen. In Mitochondrien erfolgt die Oxidation durch Elektronentransfer von organischen Substraten. Als Elektronentransporter umfasst die Atmungskette der Mitochondrien verschiedene Proteine, die verschiedene funktionelle Gruppen enthalten, die dazu bestimmt sind, Elektronen zu transportieren. Während sie sich entlang der Kette von einem Zwischenprodukt zum anderen bewegen, verlieren die Elektronen ihre freie Energie. Für jedes Elektronenpaar, das durch die Atmungskette auf Sauerstoff übertragen wird, werden 3 ATP-Moleküle synthetisiert. Die bei der Übertragung von 2 Elektronen auf Sauerstoff freigesetzte freie Energie beträgt 220 kJ/mol. Die Synthese von 1 ATP-Molekül unter Standardbedingungen verbraucht 30,5 kJ. Daraus wird deutlich, dass ein ziemlich bedeutender Teil der freien Energie, die während der Übertragung eines Elektronenpaars freigesetzt wird, in ATP-Molekülen gespeichert wird. Aus diesen Daten wird auch die Rolle des mehrstufigen Elektronentransfers vom anfänglichen Reduktionsmittel zum Sauerstoff deutlich. Die große Energie (220 kJ), die bei der Übertragung eines Elektronenpaares auf Sauerstoff freigesetzt wird, wird in mehrere Portionen aufgeteilt, die den einzelnen Oxidationsstufen entsprechen. Bei drei solchen Stufen entspricht die freigesetzte Energiemenge ungefähr der Energie, die für die Synthese von 1 ATP-Molekül benötigt wird. Redoxreaktionen sind die Grundlage oxidimetrischer Methoden, die in der klinischen Analyse zur Bestimmung von Ca-Ionen, Harnsäure, Katalase- und Peroxidase-Enzymen, Zucker im Blut sowie in der Hygiene- und Hygieneanalyse zur Bestimmung der Oxidationsfähigkeit von Wasser und des Gehalts an verwendet werden Aktivchlor in Bleichmitteln, Restchlor im Trinkwasser des Haushalts. Wasser 30. Chemische Bindung und ihre experimentellen Eigenschaften Die Entwicklung eines modernen Atommodells und die darauf basierende Vorhersage der Eigenschaften einzelner Atome ist eine sehr wichtige Errungenschaft der Quantenmechanik. Allerdings werden isolierte Atome unter terrestrischen Bedingungen selten gefunden. Die Körper der unbelebten und lebenden Natur, die uns umgeben, bestehen aus einer Vielzahl von Molekülen. A. M. Butlerov (1828-1886) schuf die Theorie der chemischen Struktur organischer Substanzen (1861). Seit dieser Zeit begannen die Begriffe „Valenz“ und „chemische Bindung“ allmählich Einzug in die Chemie zu halten. Valenz ist die Fähigkeit eines Atoms, eine bestimmte Anzahl anderer Atome zu verbinden, um ein Molekül zu bilden. Die Wertigkeit wird durch Striche neben dem Elementsymbol angezeigt. Wasserstoff (H) ist einwertig, Sauerstoff (0=) ist zweiwertig. Die Anzahl der Valenzbalken bestimmt die Anzahl der chemischen Bindungen, die ein bestimmtes Atom mit anderen Atomen eingehen kann. Eine chemische Bindung ist eine Reihe von Wechselwirkungen zwischen Elektronen und Kernen, die zur Kombination von Atomen zu einem Molekül führen. Die Eigenschaften einer chemischen Bindung werden mit verschiedenen Methoden untersucht. Mit Hilfe chemischer Methoden werden die Anzahl der Bindungen von Atomen (Valenz) und deren Reaktivität bestimmt. Mit physikalischen Methoden werden Länge, Stärke, Orientierung und Polarität chemischer Bindungen bestimmt. Chemische Bindungslänge rс wird der Wert genannt, der durch den Abstand zwischen den Kernen der gebundenen Atome gemessen wird. Als Einheit der chemischen Bindungslänge gс bequem zu verwenden Pikometer (pm): 1 pm = 1012 m Chemische Bindungsstärke Eс - Wert gemessen durch Enthalpie ΔЕс Verbindungsaufbau. Als Einheit der chemischen Bindungsstärke Eс kJ/mol verwendet. Orientierung der chemischen Bindung aс - der Wert, der durch den Winkel zwischen den Richtungen der Bindungen eines bestimmten Atoms mit benachbarten Atomen des Moleküls gemessen wird. Der Winkel ac wird Valenzwinkel genannt. Bindungswinkeleinheit aс - Grad. Polarität der chemischen Bindung μс - der durch das elektrische Moment dieser Verbindung gemessene Wert. Das elektrische Moment für zwei elektrische Ladungen +q und ־q, die im Absolutwert gleich und im Vorzeichen entgegengesetzt sind, ist gleich μ = qr, wobei r der Abstand zwischen den Ladungen ist. Diese beiden Ladungen bilden einen elektrischen Dipol. Eine chemische Bindung ist polarisiert, wenn sich zwei Atome unterschiedlicher Elektronegativität (EOE) verbinden. Infolgedessen erscheint an einem Atom mit einem großen OEO-Wert eine überschüssige negative Ladung δ und an einem anderen Atom mit einem niedrigeren OEO-Wert eine überschüssige positive Ladung +δ. Die Polarität der Verbindung wird nach folgender Formel berechnet: μс = δrс. Es ist praktisch, die nichtsystemische Debye-Einheit (D) als Einheit zur Messung der Polarität einer chemischen Bindung zu verwenden – 1 D = 3,3 x 1030 C/m. Die Polarität der O-H-Bindung in einem Wassermolekül beträgt μer = 1,5D. Die Untersuchung der chemischen Bindung zeigte, dass Länge, Stärke, Orientierung, Polarität derselben chemischen Bindung in verschiedenen Verbindungen in den meisten Fällen ungefähr die gleichen Werte haben. Daraus folgt, dass die Wechselwirkungen, die zur Bildung einer bestimmten Bindung zwischen Atomen führen, in verschiedenen Molekülen gleicher Natur sind. Quantenmechanische Theorien der chemischen Bindung liefern eine Erklärung für diese Tatsache. 31. Wasserstoffbrückenbindung. Intermolekulare und intramolekulare Wasserstoffbrückenbindung Chemische Bindungen in Molekülen sind normalerweise sehr stark, ihre Energie liegt im Bereich von 100-150 kJ/mol. Außerdem gibt es sogenannte Wasserstoffbrückenbindungen, deren Stärke 10-40 kJ/mol beträgt. Die Länge dieser Bindungen beträgt jeweils 270-230 pm. Wasserstoffbrückenbindung zwischen Atomen EА und EВ bezeichnet die Wechselwirkung, die von einem mit E verbundenen Wasserstoffatom ausgeführt wirdА oder eВ chemische Bindung. Das Bild einer Wasserstoffbrücke hat im allgemeinen Fall die Form: ЭА-N...Eв.. Offensichtlich handelt es sich bei der Wasserstoffbrücke um drei Zentren, da an ihrer Bildung 3 Atome beteiligt sind. Für das Auftreten einer solchen Bindung ist es notwendig, dass die Atome EА und EВ haben eine hohe Elektronegativität. Dies sind die Atome der negativsten Elemente: Stickstoff (REO = 3,0), Sauerstoff (REO = 3,5), Fluor (REO = 4,0) und Chlor (REO = 3,0). Eine Wasserstoffbrücke wird als Ergebnis einer Kombination von ls-AO-Wasserstoff und zwei 2pAO-Atomen E gebildetА und EВ; 2Rorbitale sind entlang einer geraden Linie ausgerichtet. Daher ist die Wasserstoffbrücke linear. Die Wasserstoffbrücke heißt: 1) intramolekular, wenn die Atome EА und EВ , verbunden durch diese Bindung, gehören zu demselben Molekül; 2) intermolekular, wenn Atome EА und EВ befinden sich in verschiedenen Molekülen. Intramolekulare Wasserstoffbrücken spielen eine wichtige biologische Rolle, da sie beispielsweise die helikale Struktur von Polymerproteinmolekülen bestimmen. In Proteinen sind dies N-H...O-Bindungen zwischen Aminosäureresten. Nicht weniger wichtig sind intermolekulare Wasserstoffbrückenbindungen. Mit ihrer Hilfe werden Nukleinsäureketten zu einer Doppelhelix verbunden. Es gibt zwei Arten von Bindungen zwischen Nukleinbasen – NHN und N-H-O. Die durchschnittliche kinetische Energie der thermischen Bewegung von Molekülen liegt in der Größenordnung von 3/2RT. Bei einer menschlichen Körpertemperatur von 37°C (310°K) sind das etwa 4 kJ/mol. Die Stärke von Wasserstoffbrückenbindungen liegt im Bereich von 10–40 kJ/mol, sie sind also stark genug, um ständigen Stößen umgebender Moleküle standzuhalten und die Konstanz der Form polymerer biologischer Strukturen zu gewährleisten. Gleichzeitig werden beim Aufprall aktiver Moleküle regelmäßig Wasserstoffbrückenbindungen aufgebrochen und wiederhergestellt, wodurch der Fluss verschiedener Lebensprozesse sichergestellt wird. Die betrachteten Beispiele veranschaulichen deutlich einen breiteren Anwendungsbereich des MO LCAO-Verfahrens als das VS-Verfahren. Dennoch kann die VS-Methode erfolgreich verwendet werden, um die Eigenschaften und Struktur vieler Substanzen, einschließlich komplexer Verbindungen, vorherzusagen. 32. Makro- und Mikroelemente in der Umwelt und im menschlichen Körper Es gibt verschiedene Klassifikationen von chemischen Elementen, die im menschlichen Körper enthalten sind. So teilte V. I. Vernadsky die Elemente in Abhängigkeit vom durchschnittlichen Gehalt (Massenanteil w, %) in lebenden Organismen nach dem Zehn-Tage-System ein. Gemäß dieser Klassifizierung werden die in lebenden Organismen enthaltenen Elemente in drei Gruppen eingeteilt: Makro-, Mikro- und Ultramikroelemente. Makronährstoffe Dies sind Elemente, deren Gehalt im Körper höher als 10 ist2%. Dazu gehören Sauerstoff, Kohlenstoff, Wasserstoff, Stickstoff, Phosphor, Schwefel, Calcium, Magnesium, Natrium und Chlor. Spurenelemente Dies sind Elemente, deren Gehalt im Körper im Bereich von 10 liegt3 um 105%. Dazu gehören Jod, Kupfer, Arsen, Fluor, Brom, Strontium, Barium, Kobalt. Ultramikroelemente Dies sind Elemente, deren Gehalt im Körper unter 10 liegt5%. Dazu gehören Quecksilber, Gold, Uran, Thorium, Radium usw. Derzeit werden Ultramikroelemente mit Mikroelementen zu einer Gruppe kombiniert. Diese Klassifizierung spiegelt nur den Inhalt von Elementen in lebenden Organismen wider, gibt jedoch nicht die biologische Rolle und physiologische Bedeutung dieses oder jenes Elements an. V. V. Kovalsky teilte die chemischen Elemente aufgrund ihrer Bedeutung für das Leben in drei Gruppen ein. Lebenswichtige (unersetzliche) Elemente Sie sind ständig im menschlichen Körper enthalten, sind Bestandteil von Enzymen, Hormonen und Vitaminen: H, O, Ca, N, K, P, Na, S, Mg, d, C, I, Mn, Cu, Co, Fe, Zn, Mo, V. Ihr Mangel führt zu einer Störung des normalen menschlichen Lebens. Verunreinigungselemente Diese Elemente kommen ständig im Körper von Tieren und Menschen vor: Ga, Sb, Sr, Br, F, B, Be, Li, Si, Sn, Cs, Al, Ba, Ge, As, Rb, Pb, Ra, Bi, Cd, Cr, Ni, Ti, Ag, Th, Hg, U, Se. Ihre biologische Rolle ist wenig verstanden oder unbekannt. Verunreinigungselemente Sc, Tl, In, La, Pr, Sm, W, Re, Tb usw. Gefunden bei Menschen und Tieren. Daten zur Anzahl und biologischen Rolle sind noch nicht geklärt. Die für den Aufbau und die Lebenstätigkeit verschiedener Zellen und Organismen notwendigen Elemente werden als biogene Elemente bezeichnet. Es ist immer noch unmöglich, alle biogenen Elemente genau aufzulisten, da es schwierig ist, sehr geringe Konzentrationen von Spurenelementen zu bestimmen und ihre biologischen Funktionen zu bestimmen. Für 24 Elemente wurde die Biogenität zuverlässig nachgewiesen. Dies sind Elemente der ersten und einige Elemente der zweiten Gruppe (nach Kowalski). 33. Topographie der wichtigsten biogenen Elemente im menschlichen Körper Menschliche Organe konzentrieren verschiedene chemische Elemente unterschiedlich in sich, d.h. Mikro- und Makroelemente sind ungleichmäßig zwischen verschiedenen Organen und Geweben verteilt. Die meisten Spurenelemente reichern sich im Leber-, Knochen- und Muskelgewebe an. Diese Gewebe sind die Hauptdepots (Speicher) für viele Spurenelemente. Elemente können eine spezifische Affinität zu bestimmten Organen aufweisen und in diesen in hohen Konzentrationen enthalten sein. Es ist bekannt, dass Zink in der Bauchspeicheldrüse konzentriert ist, Jod in der Schilddrüse, Fluor im Zahnschmelz, Aluminium, Arsen, Vanadium in Haaren und Nägeln, Cadmium, Quecksilber, Molybdän in den Nieren und Zinn im Darm Gewebe, Strontium – in der Prostata, Knochengewebe, Barium – im Pigment der Netzhaut, Brom, Mangan, Chrom – in der Hypophyse usw. In Organismen können Mikroelemente in gebundenem Zustand und in Form freier ionischer Formen vorliegen. Es ist bekannt, dass Silizium, Aluminium, Kupfer und Titan im Gehirngewebe in Form von Komplexen mit Proteinen vorliegen, während Mangan in ionischer Form vorliegt. Wasserstoff und Sauerstoff sind Makroelemente. Sie sind Bestandteil des Wassers, das im erwachsenen menschlichen Körper durchschnittlich etwa 65 % ausmacht. Wasser ist in den menschlichen Organen, Geweben und biologischen Flüssigkeiten ungleichmäßig verteilt. So macht Wasser im Magensaft, Speichel, Blutplasma, Lymphe 89,5 bis 90 %, im Urin, in der grauen Substanz des Gehirns, in den Nieren 80 % und in der weißen Substanz des Gehirns, der Leber, der Haut und des Rückenmarks aus , Muskeln, Lunge, Herz - 70-80 %. Am wenigsten – 40 % Wasser – ist im Skelett enthalten. Makroelemente – Kohlenstoff, Wasserstoff, Sauerstoff, Stickstoff, Schwefel, Phosphor – sind Bestandteil von Proteinen, Nukleinsäuren und anderen biologisch aktiven Verbindungen des Körpers. Der Kohlenstoffgehalt in Proteinen beträgt 51–55 %, Sauerstoff – 22–24 %, Stickstoff – 15–18 %, Wasserstoff – 6,5–7 %, Schwefel – 0,3–2,5 %, Phosphor – etwa 0,5 %. Zu den Kohlenhydraten gehören auch Kohlenstoff, Wasserstoff und Sauerstoff, deren Gehalt in tierischen Geweben gering ist – etwa 2 %. Diese Elemente sind Bestandteil von Lipiden (Fetten). Darüber hinaus enthalten Phospholipide Phosphor in Form von Phosphatgruppen. Lipide sind am stärksten im Gehirn konzentriert (12 %), dann in der Leber (5 %), der Milch (2–3 %) und dem Blutserum (0,6 %). Der Großteil des Phosphors (600 g) ist jedoch im Knochengewebe enthalten. Dies macht 85 % der Masse des gesamten im menschlichen Körper vorkommenden Phosphors aus. Phosphor ist auch in der Zahnhartsubstanz konzentriert, wo es zusammen mit Kalzium, Chlor, Fluor in Form von Hydroxyl, Chlor und Fluorapatiten der allgemeinen Formel Ca enthalten ist5 (PO4)3X, wobei X = OH, Cl bzw. F. Calcium ist überwiegend im Knochen- und auch im Zahngewebe konzentriert. Natrium und Chlor kommen hauptsächlich in extrazellulären Flüssigkeiten vor, während Kalium und Magnesium hauptsächlich in intrazellulären Flüssigkeiten vorkommen. Natrium und Kalium sind in Form von Fluoriden Bestandteil des Knochen- und Zahngewebes. Magnesium als Mg-Phosphat3 (PO4)2 in der Zahnhartsubstanz enthalten. Hormone sind an der Aufrechterhaltung eines bestimmten Gehalts an Makro- und Mikroelementen im Körper beteiligt. 34. Die biologische Rolle chemischer Elemente im Körper Die biologische Rolle chemischer Elemente im menschlichen Körper ist äußerst vielfältig. Die Hauptfunktion von Makronährstoffen besteht darin, Gewebe aufzubauen, einen konstanten osmotischen Druck sowie eine Ionen- und Säure-Basen-Zusammensetzung aufrechtzuerhalten. Mikroelemente sind als Bestandteil von Enzymen, Hormonen, Vitaminen und biologisch aktiven Substanzen als Komplexbildner oder Aktivatoren am Stoffwechsel, an Fortpflanzungsprozessen, an der Gewebeatmung und an der Neutralisierung toxischer Substanzen beteiligt. Mikroelemente beeinflussen aktiv die Prozesse der Hämatopoese, Oxidation, Reduktion und Durchlässigkeit von Blutgefäßen und Geweben. Makro- und Mikroelemente – Kalzium, Phosphor, Fluor, Jod, Aluminium, Silizium – bestimmen die Bildung von Knochen- und Zahngewebe. Es wurden viele Krankheiten identifiziert, die mit einem Mangel oder einer übermäßigen Anreicherung verschiedener Mikroelemente einhergehen. Fluoridmangel verursacht Zahnkaries, Jodmangel verursacht endemische Struma und überschüssiges Molybdän verursacht endemische Gicht. Diese Art von Mustern hängt mit der Tatsache zusammen, dass der menschliche Körper ein Gleichgewicht optimaler Konzentrationen biogener Elemente aufrechterhält – die chemische Homöostase. Eine Störung dieses Gleichgewichts aufgrund eines Mangels oder Überschusses des Elements kann zu verschiedenen Krankheiten führen. Zusätzlich zu den sechs Hauptmakroelementen – Organogenen (Kohlenstoff, Wasserstoff, Stickstoff, Sauerstoff, Schwefel und Phosphor), aus denen Kohlenhydrate, Fette, Proteine und Nukleinsäuren bestehen – sind anorganische Makroelemente für die normale Ernährung von Mensch und Tier notwendig – Kalzium, Chlor , Magnesium, Kalium, Natrium – und Spurenelemente – Kupfer, Fluor, Jod, Eisen, Molybdän, Zink, sowie möglicherweise (bei Tieren nachgewiesen) Selen, Arsen, Chrom, Nickel, Silizium, Zinn, Vanadium. Die Analyse des Gehalts und Verhältnisses von Mikroelementen im menschlichen Körper wird auch bei der forensischen medizinischen Untersuchung verwendet. Beispielsweise steigt bei einer Alkoholvergiftung unter dem Einfluss von Ethylalkohol der Kalziumgehalt in der Leber an und Natrium und Kalium werden geringer. Gleichzeitig nimmt im Herzen und in den Nieren dagegen der Calciumgehalt ab. Der Mangel an Elementen wie Eisen, Kupfer, Fluor, Zink, Jod, Kalzium, Phosphor, Magnesium und einigen anderen in der Ernährung führt zu schwerwiegenden Folgen für die menschliche Gesundheit. Allerdings muss bedacht werden, dass nicht nur ein Mangel, sondern auch ein Überschuss an biogenen Elementen für den Körper schädlich ist, da dies die chemische Homöostase stört. Mineralische Bestandteile, die in vernachlässigbaren Mengen lebensnotwendig sind, werden bei höheren Konzentrationen toxisch. Eine Reihe von Elementen (Silber, Quecksilber, Blei, Cadmium usw.) gelten als toxisch, da ihr Eintritt in den Körper selbst in Spurenmengen zu schweren pathologischen Erscheinungen führt. Verschiedene Elemente und ihre Verbindungen werden in großem Umfang als Arzneimittel verwendet. Somit trägt die Untersuchung der biologischen Rolle chemischer Elemente, die Aufklärung der Beziehung zwischen dem Austausch dieser Elemente und anderen biologisch aktiven Substanzen (Enzyme, Hormone, Vitamine) zur Entwicklung neuer Arzneimittel und zur Entwicklung optimaler Dosierungsschemata bei sowohl zu therapeutischen als auch zu prophylaktischen Zwecken. 35. S-Elemente und ihre Verbindungen Wasser ist eine der wichtigsten und am weitesten verbreiteten Wasserstoffverbindungen auf der Erde. Der Wasserraum nimmt fast 75 % der Erdoberfläche ein. Der Körper eines Erwachsenen enthält durchschnittlich 65–67 % Wasser, ein Fötus (4 Monate) – 94 % und ein Neugeborenes – 74 %. Alle chemischen Reaktionen im Körper finden nur in Gewässern statt. Ein Leben ohne Wasser ist unmöglich. Destilliertes Wasser ist eine Arzneibuchzubereitung. In der medizinischen Praxis wird eine andere Wasserstoffverbindung verwendet - Wasserstoffperoxid H2 02. Diese Verbindung ist ein wichtiges Nebenprodukt des Stoffwechsels. Wasserstoffperoxid ist eine farblose, durchsichtige Flüssigkeit. Verursacht Brennen bei Kontakt mit Haut und Schleimhäuten. Molekül H2О2 Polar. Das Vorhandensein einzelner Elektronenpaare an Sauerstoffatomen ermöglicht die Bildung von Donor-Akzeptor-Bindungen von Wasserstoffperoxid mit Liganden – Elektronenakzeptoren. Die Oxidationsstufe von Sauerstoff in H2О2 gleich 1, d.h. es hat einen mittleren Wert zwischen der Oxidationsstufe von Sauerstoff in Wasser (2) und in elementarem Sauerstoff O2 . Daraus folgt, dass Wasserstoffperoxid sowohl die Eigenschaften eines Oxidationsmittels als auch die Eigenschaften eines Reduktionsmittels aufweisen kann (Redox-Dualität). Gemessen an den Standard-Redox-Halbreaktionspotentialen ist Wasserstoffperoxid jedoch eher durch oxidierende Eigenschaften gekennzeichnet. Reines Wasserstoffperoxid ist thermodynamisch instabil und zerfällt beim Stehen explosionsartig unter Freisetzung großer Wärmemengen in Wasser und Sauerstoff. Wässrige Lösungen von Wasserstoffperoxid sind stabiler und können an einem kühlen Ort längere Zeit gelagert werden. Wasserstoffperoxid wird üblicherweise in Form einer 30 %igen wässrigen Lösung – Perhydrol – verkauft. Der Co-Prozess der Zersetzung von Wasserstoffperoxid wird in Gegenwart von Salzen von Schwermetallen erheblich beschleunigt. Die durch Metallionen katalysierte Zersetzung von Wasserstoffperoxid kann zur Bildung von Radikalen führen, von denen die wichtigsten Hydroxid HO und Hydroperoxid sind. Die Toxizität ist darauf zurückzuführen2О2 und O2 interagieren mit der Lipidschicht von Zellmembranen und schädigen diese. In der medizinischen Praxis wird Wasserstoffperoxid hauptsächlich als externes bakterizides Mittel verwendet. Aktion h2О2 basierend auf der Oxidationsfähigkeit von Wasserstoffperoxid und der Unbedenklichkeit seines Reduktionsprodukts – Wasser. Bei der Behandlung von Wunden spielt der freigesetzte Sauerstoff eine doppelte Rolle: 1) hat eine antimikrobielle, desodorierende und depigmentierende Wirkung, die mikrobielle Körper abtötet; 2) bildet Schaum und trägt zum Übergang von Gewebezersetzungspartikeln in einen suspendierten Zustand und zur Reinigung von Wunden bei. Als Arzneimittelzubereitung wird eine 3% ige wässrige Lösung von Wasserstoffperoxid verwendet, eine 6% ige Lösung von Wasserstoffperoxid wird zum Bleichen von Haaren verwendet. In Form einer 30%igen Lösung wird Wasserstoffperoxid zur Behandlung der warzigen Form des Lichen planus und zur Entfernung jugendlicher Warzen eingesetzt. 36. Die biologische Rolle von s-Elementen der IA-Gruppe (Lithium, Rubidium, Cäsium, Francium) Gemessen am Gehalt im menschlichen Körper sind Natrium (0,08 %) und Kalium (0,23 %) Makroelemente, die restlichen Alkalimetalle sind Lithium (10).4%), Rubidium (105%), Cäsium (104%) - zu Spurenelementen. Lithium Der Lithiumgehalt im menschlichen Körper beträgt etwa 70 mg (10 mmol) - 104%. Lithiumverbindungen in höheren Tieren sind in Leber, Nieren, Milz, Lunge, Blut und Milch konzentriert. Die maximale Menge an Lithium findet sich in menschlichen Muskeln. Die biologische Rolle von Lithium als Spurenelement ist noch nicht vollständig geklärt. Es wurde nachgewiesen, dass Li-Ionen (in ausreichender Konzentration) auf der Ebene der Zellmembranen mit Natrium-Ionen konkurrieren, wenn sie in Zellen eindringen. Offensichtlich ist der Ersatz von Na-Ionen in Zellen durch Li-Ionen mit einer größeren Kovalenz von Lithiumverbindungen verbunden, wodurch diese sich besser in Phospholipiden lösen. Es wurde festgestellt, dass einige Lithiumverbindungen eine positive Wirkung auf Patienten mit manischer Depression haben. Aus dem Magen-Darm-Trakt aufgenommen, reichern sich Li-Ionen im Blut an. Wenn die Konzentration von Li-Ionen 0,6 mmol / l und mehr erreicht, kommt es zu einer Abnahme der emotionalen Spannung und einer Abschwächung der manischen Erregung. Gleichzeitig muss der Gehalt an Li-Ionen im Blutplasma streng kontrolliert werden. In Fällen, in denen die Konzentration von Li-Ionen 1,6 mmol/l übersteigt, sind negative Phänomene möglich. Rubidium und Cäsium Entsprechend dem Gehalt an Rubidium im menschlichen Körper (105%) und Cäsium (104%) gehören zu den Spurenelementen. Sie sind ständig im Körper enthalten, ihre biologische Rolle ist jedoch noch nicht aufgeklärt. Als vollständiges Analogon von Kalium reichert sich Rubidium auch in der intrazellulären Flüssigkeit an und kann bei verschiedenen Prozessen eine äquivalente Menge Kalium ersetzen. Radioaktive Isotope 13rCs und 87Rb wird bei der Strahlentherapie von bösartigen Tumoren sowie bei der Untersuchung des Kaliumstoffwechsels verwendet. Aufgrund ihres schnellen Abbaus können sie sogar ohne Angst vor langfristigen schädlichen Auswirkungen in den Körper eingeführt werden. Frankreich Dies ist ein radioaktives chemisches Element, das auf künstliche Weise gewonnen wird. Es gibt Hinweise darauf, dass sich Francium in den frühesten Stadien ihrer Entwicklung selektiv in Tumoren anreichern kann. Diese Beobachtungen können bei der Diagnose von Krebs nützlich sein. Daher sind von den Elementen der Gruppe IA Li, Rb, Cs physiologisch aktiv und Na und K lebenswichtig. Die Ähnlichkeit der physikalisch-chemischen Eigenschaften von Li und Na aufgrund der Ähnlichkeit der elektronischen Struktur ihrer Atome zeigt sich auch in der biologischen Wirkung von Kationen (Anreicherung in der extrazellulären Flüssigkeit, Austauschbarkeit). Eine ähnliche Natur der biologischen Wirkung von Kationen von Elementen langer Perioden - K+, Rb+, Cs+ (Anreicherung in der intrazellulären Flüssigkeit, Austauschbarkeit) ist auch auf die Ähnlichkeit ihrer elektronischen Struktur und physikalisch-chemischen Eigenschaften zurückzuführen. Dies ist die Grundlage für den Einsatz von Natrium- und Kaliumpräparaten bei Vergiftungen mit Lithium- und Rubidiumsalzen. 37. Die biologische Rolle der S-Elemente der IA-Gruppe (Natrium, Kalium) Der Natriumgehalt im menschlichen Körper mit einem Gewicht von 70 kg beträgt etwa 60 g (2610 mmol) – 0,08 %. Davon befinden sich 44 % des Natriums in der extrazellulären Flüssigkeit und 9 % in der intrazellulären Flüssigkeit. Die verbleibende Menge an Natrium befindet sich im Knochengewebe, wo sich Na-Ionen im Körper ablagern. Etwa 40 % des im Knochengewebe enthaltenen Natriums sind an Stoffwechselprozessen beteiligt, und dadurch ist das Skelett entweder ein Spender oder ein Akzeptor von Na-Ionen, was dazu beiträgt, eine konstante Konzentration von Na-Ionen in der extrazellulären Flüssigkeit aufrechtzuerhalten. Natrium ist das wichtigste extrazelluläre Ion. Im menschlichen Körper kommt Natrium in Form seiner löslichen Salze vor, hauptsächlich Chlorid, Phosphat und Hydrogencarbonat. Natrium ist im ganzen Körper verteilt: im Blutserum, in der Liquor cerebrospinalis, in der Augenflüssigkeit, in Verdauungssäften, in der Galle, in den Nieren, in der Haut, im Knochengewebe, in der Lunge und im Gehirn. Na-Ionen spielen eine wichtige Rolle bei der Sicherstellung der Konstanz der inneren Umgebung des menschlichen Körpers und sind an der Aufrechterhaltung eines konstanten osmotischen Drucks der Bioflüssigkeit (osmotische Homöostase) beteiligt. Na-Ionen sind an der Regulierung des Wasserstoffwechsels beteiligt und beeinflussen die Funktion von Enzymen. Zusammen mit K-, Mg-, Ca-, Cl-Ionen ist das Na-Ion an der Übertragung von Nervenimpulsen beteiligt und erhält die normale Erregbarkeit von Muskelzellen aufrecht. Wenn sich der Natriumgehalt im Körper ändert, treten Funktionsstörungen des Nerven-, Herz-Kreislauf- und anderer Systeme, der glatten und der Skelettmuskulatur auf. Natriumchlorid NaCl ist die Hauptquelle für Salzsäure für Magensaft. Natrium gelangt hauptsächlich in Form von Speisesalz in den menschlichen Körper. Der tatsächliche tägliche Bedarf des Körpers an Natrium beträgt 1 g, obwohl die durchschnittliche Aufnahme dieses Elements 4-7 g erreicht.Die kontinuierliche übermäßige Aufnahme von NaCl trägt zu Bluthochdruck bei. Wenn mikrobielle Zellen Alkalien ausgesetzt werden, kommt es zur Ausfällung von Zellproteinen und in der Folge zum Absterben von Mikroorganismen. Natriumsulfat (Glaubersalz) Na2SO4 × 10H2O wird als Abführmittel verwendet. Natriumtetraborat Na2B4О7 × 10H2O wird äußerlich als Antiseptikum zum Spülen, Duschen, Schmieren verwendet. Natriumhydroxid in Form einer 10%igen Lösung ist Bestandteil des in der orthopädischen Praxis zum Gießen von feuerfesten Modellen verwendeten Silins bei der Herstellung von gegossenen Prothesen aus einer Kobalt-Chrom-Legierung. Der Kaliumgehalt im menschlichen Körper mit einem Gewicht von 70 kg beträgt etwa 160 g (4090 mmol) – 0,23 %. Kalium ist das wichtigste intrazelluläre Kation und macht 2/3 der gesamten aktiven zellulären Kationen aus. Von der gesamten im Körper enthaltenen Kaliummenge befinden sich 98 % in den Zellen und nur etwa 2 % in der extrazellulären Flüssigkeit. Kalium verteilt sich im ganzen Körper. Seine Topographie: Leber, Nieren, Herz, Knochengewebe, Muskeln, Blut, Gehirn usw. K-Ionen spielen eine wichtige Rolle bei physiologischen Prozessen – Muskelkontraktion, normale Herzfunktion, Weiterleitung von Nervenimpulsen, Stoffwechselreaktionen. K-Ionen sind wichtige Aktivatoren von Enzymen im Inneren der Zelle. 38. Biologische Rolle der s-Elemente der IIA-Gruppe. Ihre Verwendung in der Medizin (Beryllium, Magnesium, Calcium) Beryllium kommt sowohl in Pflanzen als auch in tierischen Organismen vor. Der Gehalt an Beryllium in lebenden Organismen beträgt 107%, d.h. es ist ein verunreinigendes Ultramikroelement. Die biologische Rolle von Beryllium ist noch nicht ausreichend untersucht. Berylliumverbindungen sind giftig und verursachen eine Reihe von Krankheiten (Beryllium-Rachitis, Berylliose etc.). Flüchtige Verbindungen von Beryllium sind besonders giftig. Die negative Wirkung von Be2 + auf physiologische Prozesse erklärt sich aus seinen chemischen Eigenschaften. Magnesium wird formal als Makronährstoff eingestuft. Sein Gesamtgehalt im Körper beträgt 0,027 % (ca. 20 g). Die Topographie von Magnesium im menschlichen Körper ist wie folgt: Magnesium ist am stärksten im Dentin und Zahnschmelz der Zähne und im Knochengewebe konzentriert. Es reichert sich auch in der Bauchspeicheldrüse, der Skelettmuskulatur, den Nieren, dem Gehirn, der Leber und dem Herzen an. Bei einem Erwachsenen beträgt der Tagesbedarf an Magnesium etwa 0,7 g. Das Mg-Ion ist wie das K-Ion ein intrazelluläres Kation. In biologischen Flüssigkeiten und Geweben des Körpers kommt Magnesium sowohl in Form eines Aqua-Ions als auch in proteingebundenem Zustand in einer Menge von < 10 vor2%, d.h. im Wesentlichen ist es ein Mikroelement. Die Konzentration von Mg-Ionen in Zellen ist etwa 2,5-3 mal höher als in extrazellulären Flüssigkeiten. Magnesiumionen spielen eine wichtige biologische Rolle im menschlichen Körper. Aufgrund des kleineren Ionenradius und der höheren Ionisationsenergie von Mg2+ bildet stärkere Bindungen als das Ca-Ion und ist daher ein aktiverer Katalysator für enzymatische Prozesse. Als Teil verschiedener enzymatischer Systeme ist das Mg-Ion deren wesentlicher Bestandteil und Aktivator (Enzyme wie Carboxypeptidase, Cholinesterase und einige andere sind spezifisch für das Mg-Ion). Bei einem Überschuss an Mg kommt es zur ATP-Hydrolyse, die mit einer Reihe enzymatischer Reaktionen verbunden ist, bei denen Hydrophosphathion HPO2 gebildet und eine große Energiemenge freigesetzt wird2+. Kalzium ist ein Makronährstoff. Sein Gesamtgehalt im Körper beträgt 1,4%. Kalzium kommt in jeder Zelle des menschlichen Körpers vor. Der Großteil des Kalziums befindet sich in Knochen- und Zahngewebe. Im Durchschnitt sollte ein Erwachsener 1 g Calcium pro Tag zu sich nehmen, obwohl der Bedarf an Calcium nur 0,5 g beträgt Mit der Nahrung zugeführtes Calcium wird im Darm nur zu 50 % resorbiert. Die relativ schlechte Resorption ist eine Folge der Bildung von schwerlöslichem Calciumphosphat Ca im Magen-Darm-Trakt3(PO4)2 und Calciumsalze von Fettsäuren. Im Körper wird die Konzentration von Ca-Ionen durch Hormone reguliert. In den Knochen und Zähnen eines Erwachsenen befindet sich etwa 1 kg Kalzium in Form eines unlöslichen kristallinen Minerals – Hydroxylapatit Ca10(RO4)6(OH)2 , dessen Bildung bei der Wechselwirkung von Ca-Ionen mit Phosphathionen erfolgt. Im Blut und in der Lymphe kommt Kalzium sowohl in ionisiertem als auch nichtionisiertem Zustand vor – in Kombination mit Proteinen, Kohlenhydraten usw. Der Blutgerinnungsmechanismus besteht aus mehreren Stufen, die vom Vorhandensein von ionisiertem Ca abhängen. Ca-Ionen sind an der Übertragung von Nervenimpulsen, der Muskelkontraktion und der Regulierung der Funktion des Herzmuskels beteiligt. Die Konzentration von Ca-Ionen innerhalb und außerhalb der Zelle beträgt jeweils 106 und (2,25-2,8) 103 mol/l. Da Kalzium im Inneren der Zelle praktisch nicht verbraucht wird, fungiert es als Baustoff im Körper – in Knochen und Zähnen. Das Skelett ist der Hauptspeicher für Kalzium im Körper. 39. Biologische Rolle der d-Elemente der VIB-Gruppe. Ihre Verwendung in der Medizin Chrom kommt in pflanzlichen und tierischen Organismen vor. Der Körper eines Erwachsenen enthält ungefähr 6 g Cr (0,1 %). Chrommetall ist ungiftig, während Cr(III)- und Cr(VI)-Verbindungen gesundheitsschädlich sind. Sie verursachen Hautreizungen, die zu Dermatitis führen. Es besteht die Vermutung, dass Chrom(VI)-Derivate krebserregende Eigenschaften haben. 0,25–0,3 g Kaliumdichromat führen zum Tod. Chrom(VI)-Verbindungen werden als Fungizide (Ätzmittel, Pilz – „Pilz“, Caldere – „abtöten“) eingesetzt. Chrom(III)-Verbindungen wirken sich positiv auf das Pflanzenwachstum aus. Molybdän gehört zu den „Metallen des Lebens“ und ist eines der wichtigsten Bioelemente. Seine Sonderstellung wurde vor 20-25 Jahren von F. Krin und L. Oril festgestellt. Diese Wissenschaftler vertraten die Idee, dass das Leben auf der Erde nicht durch Evolution entstanden ist, sondern dass es von einer unbekannten Zivilisation aus dem Weltraum von Molybdänsternen gebracht wurde, wo Leben lange vor uns existierte. In biochemischen Prozessen ist Molybdän an den Oxidationsstufen VI und VI beteiligt. In diesen Zuständen bildet es stabile Oxo-Formen. Molybdän bildet stabile Oxo-Komplexe und ist damit offenbar Teil der Enzyme, die für die Übertragung von Oxo-Gruppen sorgen. Mo (VI) überwiegt im Blut; wenn der Ligand Sauerstoff ist, werden stabile Isopolymolybdationen gebildet. Ein zu hoher Molybdängehalt in der Nahrung stört den Ca-Stoffwechsel2+ und RO4 , was zu einer Abnahme der Knochenstärke führt – Osteoporose. Möglicherweise kommt es zu einer Bindung in Phosphomolybdänkomplexe. Solche Komplexe können als Säurereste von Heteropolymolybdänsäuren betrachtet werden. Mit Calcium bilden diese Rückstände unlösliche Kristalle. Es ist möglich, dass diese Kristalle die Ablagerung von Harnsäuresalzen auslösen und Gicht verursachen. Gicht verformt die Gelenke, was ihre wörtliche Übersetzung – „Fußfalle“ – rechtfertigt. Neben Sauerstoffkomplexen bildet Molybdän Halogenid- (Hal), Thiocyanat- (NCS) und Cyanid- (CN) Komplexe. Molybdän ist Bestandteil verschiedener Enzyme. Im menschlichen Körper gehören dazu Aldehydhydroxydasen, Xanthindehydrogenasen und Xanthinoxidasen. Das Molekulargewicht von Xanthinoxidase (COX) beträgt 250 a.u. e. m. Dies ist ein molybdänhaltiges Enzym von Säugetieren. Es kann die Oxidation von Xanthin und anderen Purinen sowie Aldehyden katalysieren. Die Umwandlung von Hypoxanthin und Xanthin zu Harnsäure wird durch Xanthinoxidase katalysiert. Es wird angenommen, dass Molybdän während des katalytischen Prozesses eine Bindung mit Stickstoff und Sauerstoff von Xanthin eingeht. Molybdän ist das wichtigste Mikroelement von Pflanzen, da biologisch aktive Substanzen mit seiner Beteiligung für eine milde Stickstofffixierung sorgen: Sie wandeln es in Ammoniak oder stickstoffhaltige Produkte um. Im Vergleich zu anderen industriell wichtigen Metallen hat Molybdän eine geringe Toxizität. Die Aufnahme von Molybdän mit Nahrung beträgt 0,1 - 0,3 mg / Tag, aber die erforderliche tägliche Aufnahme wurde nicht ermittelt. Molybdänmangel verursacht eine Abnahme der Xanthinoxidase-Aktivität im Gewebe. Ein zu hoher Gehalt an Molybdän verursacht Osteoporose. Wolfram ist ein Spurenelement. Seine Rolle im Körper ist nicht gut verstanden. Die anionische Form von Wolfram wird im Magen-Darm-Trakt leicht absorbiert. Wolframmetall und seine kationischen Formen werden vom Körper nicht absorbiert. Es liegen keine Informationen über die Homöostase von Wolfram bei Säugetieren vor. 40. Biologische Rolle von Manganverbindungen. Ihre Verwendung in der Medizin Von den Elementen der Gruppe VIIB ist nur Mangan ein biogenes Element und eines der zehn „Lebensmetalle“, die für den normalen Ablauf von Prozessen in lebenden Organismen notwendig sind. Der Körper eines Erwachsenen enthält 12 mg. Mangan ist in den Knochen konzentriert (43 %), der Rest befindet sich in Weichgeweben, einschließlich des Gehirns. Mangan bildet im Körper Metallkomplexe mit Proteinen, Nukleinsäuren, ATP, ADP, einzelnen Aminosäuren. Enthalten Mangan-Metalloenzyme Arginase, Cholinesterase, Phosphoglucomutase, Pyruvatcarboxylase. Die Bindung von Ammoniak, einem toxischen Produkt der Aminosäureumwandlung im Körper von Säugetieren, erfolgt über die Aminosäure Arginin. Arginase ist ein Enzym, das die Hydrolyse von Arginin in der Leber katalysiert. Dadurch wird Arginin in Harnstoff und die zyklische Aminosäure Ornithin zerlegt. Harnstoff ist eine ungiftige, wasserlösliche Substanz. Es wird über die Blutbahn zu den Nieren transportiert und mit dem Urin ausgeschieden. Der Atomradius von Mangan beträgt 128 pm. Dies erklärt die Tatsache, dass Mangan in Verbindung mit ATP Magnesium (Atomradius 160 pm) ersetzen kann, wodurch die Energieübertragung im Körper erheblich beeinflusst wird. Mg- und Mn-Ionen aktivieren auch Enzyme – Nukleasen. Diese Enzyme katalysieren die Hydrolyse von DNA- und RNA-Nukleinsäuren im Zwölffingerdarm. Dadurch werden diese Biopolymere in Monomereinheiten – Nukleotide – gespalten. Eine solche Nuklease ist insbesondere die Desoxyribonuklease, die die DNA-Hydrolyse nur in Gegenwart von Mg katalysiert2+ oder MP2+. Mangan kann auch Bestandteil anorganischer Verbindungen im Körper sein. Dies ist beispielsweise ein schwerlösliches Mangan-Magnesium-Pyrophosphat MnMgP2O7. Kristalle dieses Salzes sind auf der inneren Oberfläche der Vesikelmembran lokalisiert. Fast der gleiche Wert des Atomradius von Mangan und Eisen erklärt die Fähigkeit von Mangan, Eisen im Erythrozyten-Porphyrin-Komplex zu ersetzen. Aus dem gleichen Grund kann Mangan auch Zink in zinkabhängigen Enzymen ersetzen und damit deren katalytische Eigenschaften verändern. Kaliumpermanganat KMnO4 - die bekannteste Manganverbindung, die in der Medizin verwendet wird. Verwenden Sie wässrige Lösungen, die KMnO enthalten4 0,01-5%. Als Blutstillungsmittel wird eine 5%ige Lösung verwendet. Lösungen von Kaliumpermanganat haben antiseptische Eigenschaften, die durch ihre hohe Oxidationskraft bestimmt werden. Von den anderen Manganverbindungen sind Mangan(II)-Sulfat und Mangan(II)-Chlorid zu nennen, die zur Behandlung von Anämie eingesetzt werden. Es gibt keine Daten über das Vorhandensein von Technetium in lebenden Organismen. Für die Radioisotopendiagnostik werden jedoch Technetiumverbindungen mit Bisphosphonaten verwendet. 41. Die biologische Rolle von Eisenverbindungen. Hämoglobin Eisen ist ein biogenes Element, das im Gewebe von Tieren und Pflanzen vorkommt. Die Gesamtmasse an Eisen im Körper eines Erwachsenen beträgt etwa 5 g, was 0,007 % entspricht. Metallisches Eisen ist wenig toxisch, und Fe(II)-, Fe(III)- und Fe(VI)-Verbindungen sind in großen Mengen gesundheitsgefährdend. Myoglobin, Cytochrome, Katalase sorgen für die Zellatmung. Alle diese Proteine bestehen aus den eigentlichen Proteinteilen und den damit verbundenen aktiven Zentren. Das aktive Zentrum ist eine makrozyklische Komplexverbindung – Häm. Die Verbindung Porphyrin fungiert als makrozyklischer Ligand. An den Ecken des Quadrats befinden sich Spenderstickstoffatome, in deren Mitte sich das Fe-Ion befindet. Im Allgemeinen hat der Komplex eine oktaedrische Konfiguration. Das fünfte Orbital durch den Aminosäurestickstoff (Histidin) dient der Bindung des Häms an das Protein. Hämoglobin besteht aus 4 Proteinmolekülen (Untereinheiten), die ein einzelnes makromolekulares Aggregat bilden. Jede Untereinheit hat eine ähnliche Struktur wie das Myoglobinmolekül. Somit kann Hämoglobin gleichzeitig vier Moleküle O binden2 und Myoglobin - 1. Es gibt auch mehrere Nicht-Häm-Eisen-haltige Proteinkomplexe in Geweben. Dies sind beispielsweise Enzyme – Oxidasen, sowie Speicherproteine (Depots) und Eisentransporter. Überschüssiges Eisen wird im Blut durch das Protein Transferrin transportiert und reichert sich in Form des Proteins Ferritin in verschiedenen Geweben und Organen an, insbesondere in Leber, Milz und Knochenmark. Ferritin besteht aus 24 Proteinmolekülen (Untereinheiten), die eine Kugel mit einem Durchmesser von 12-14 nm bilden. Jede Untereinheit enthält einen Hohlraum von 7 nm Durchmesser, der bis zu 4500 Eisenatome enthält. Somit kann jedes Ferritin-Aggregat ungefähr 100 Eisenatome speichern, was zahlreiche Stoffwechselreaktionen mit diesem Element ermöglicht. Basierend auf den Gesetzen des chemischen Gleichgewichts ist es nicht schwierig, die Funktion von Hämoglobin als Sauerstofftransporter von der Lunge zu den Geweben zu verstehen. Hämoglobin ohne Sauerstoff (Desoxyhämoglobin) ist eine schwache Säure und seine chemische Formel kann als HHb dargestellt werden+. Die Zugabe von Sauerstoff geht mit der Abspaltung eines Protons einher und es entsteht Oxyhämoglobin HbO.2 . In diesem Fall liegt ein Gleichgewicht vor: HHb+ + O2 → HbO2 + N+. Wenn sauerstoffarmes venöses Blut in die Lunge gelangt, wo der Sauerstoffpartialdruck hoch ist (bis zu 20 kPa), erhöht sich seine Löslichkeit gemäß dem Henry-Gesetz. Dies führt nach dem Prinzip von Le Chatelier zu einer Verschiebung des Gleichgewichts nach rechts und zur Bildung von Oxyhämoglobin. Eine zusätzliche Verschiebung des Gleichgewichts nach rechts ist darauf zurückzuführen, dass in der Lunge der pH-Wert erhöht wird (bis 7,5). Infolgedessen wird Desoxyhämoglobin in der Lunge fast vollständig (bis zu 97%) mit Sauerstoff gesättigt und geht in Oxyhämoglobin über. In Kapillaren, die peripheres Gewebe durchdringen, sinkt der Sauerstoffpartialdruck auf 5 kPa und der pH-Wert auf 7,2. Dadurch verschiebt sich das Gleichgewicht nach links. Im aus der Peripherie strömenden Blut ist Hämoglobin nur zu 65 % mit Sauerstoff gesättigt. 42. Die biologische Rolle von Eisenverbindungen. CO Kohlenmonoxid. Die Metallkomplexeigenschaften hämhaltiger Proteine manifestieren sich unter dem Einfluss toxischer Substanzen wie CO (Kohlenmonoxid) und MCN (Cyanid – Salze der Blausäure). Die aus physiologischer Sicht wichtigsten sind eisenhaltige Proteine: Hämoglobin, Myoglobin, Cytochrome, Peroxidasen, Katalase. Hämoglobin ist der Hauptbestandteil der roten Blutkörperchen, sorgt für die äußere Atmung und transportiert Sauerstoff von der Lunge zum Gewebe. Eisen Fe und Kobalt Co sind essentielle Spurenelemente lebender Organismen. Kohlenmonoxid CO ist eines der Produkte der unvollständigen Verbrennung von Kraftstoff. Beim Betrieb von Heizkesseln, Verbrennungsmotoren und beim Rauchen werden erhebliche Mengen dieses Gases freigesetzt. Beim Einatmen von CO wird Luft in der Lunge parallel zu Oxyhämoglobin HbO eingeatmet2 Es entsteht eine Metallkomplexverbindung – Carbonylhämoglobin HbCO. Die Stabilitätskonstante von HbCO ist etwa 200-mal größer als die von HbO2 . Daher „fangen“ bereits kleine Mengen CO einen erheblichen Anteil des Desoxyhämoglobins ab, was zur Folge hat, dass die Sauerstoffversorgung der Organe abnimmt. Es treten Anzeichen einer Hypoxie – Sauerstoffmangel – auf. Nervengewebe ist als erstes betroffen. Um Kohlenmonoxid zu entgiften (die toxische Wirkung zu beseitigen), reicht es in vielen Fällen aus, die Zufuhr zu stoppen und die Sauerstoffzufuhr zu erhöhen – bringen Sie das Opfer an die frische Luft. In diesem Fall funktioniert wieder das Prinzip von Le Chatelier – das Gleichgewicht verschiebt sich in Richtung der Bildung von Oxyhämoglobin. In hohen Konzentrationen blockiert Kohlenmonoxid die hämhaltigen Proteine der Zellatmung, und es ist schwierig, einen tödlichen Ausgang zu vermeiden. Der Wirkungsmechanismus von Cyaniden ist ähnlich, aber ihre Toxizität ist höher als die von CO. Der Eintritt selbst kleinster Mengen dieser Substanzen ins Blut führt zu Atemstillstand und Tod. Die hohe Toxizität von Cyaniden wird durch die hohe Stärke der Fe-CN-Bindung erklärt, die die größere Stabilität von Cyanid-Hämoglobin bestimmt. Die Sauerstoffatmung führt zur Bildung von Wasserstoffperoxid H2O2 . Dieser Stoff hat eine hohe Oxidationsfähigkeit. Bei der Wechselwirkung mit bioorganischen Zellverbindungen entstehen Radikale – sehr aktive Molekülpartikel mit ungesättigter Wertigkeit – und die Peroxidoxidation wird eingeleitet. Unter dem Einfluss von Radikalen werden die wichtigsten Bestandteile der Zelle – Membranen und DNA – zerstört. Im Laufe der biologischen Evolution hat die Natur ein spezielles Protein entwickelt – das Enzym Katalase, das Wasserstoffperoxid zerstört. Dies begrenzt die übermäßige Anreicherung dieser Substanz und verhindert die Zellzerstörung. Die Wirkung von Katalase (CatFe2+ ) kann als Katalysezyklus zweier aufeinanderfolgender Reaktionen dargestellt werden: Katze2+ + N2O2 - Katze Fe2+ × H.2O2 , Katze2+ × H.2O2 + N2O2 → CatFe2+ + 2Н2O2 + O2 . Dadurch werden 2 Wasserstoffperoxidmoleküle zerstört, und das CatFe2+-Biokatalysatormolekül wird freigesetzt und kann in den nächsten Katalysezyklus eintreten. Dieser Vorgang ist sehr schnell. Innerhalb einer Sekunde kann 1 Katalase-Molekül bis zu 20 Zyklen ausführen. 43. Die biologische Rolle von Eisen- und Kobaltverbindungen Bei Eisenmangel im Körper kann sich eine Krankheit entwickeln - Eisenmangelanämie (Anämie). Es besteht ein Sauerstoffmangel im Gewebe, der mit einem Mangel an Eisen für die Synthese von Hämoglobin verbunden ist. Infolgedessen nimmt die Sauerstoffzufuhr zu den peripheren Organen ab, und dementsprechend nimmt die Zellatmung ab und der Stoffwechsel verlangsamt sich. Die Einführung von Eisen(II)-Chlorid oder Eisen(II)-Sulfat als Medikamente reduziert die Schwere der Erkrankung. Für die gleichen Zwecke wird ein feines Pulver aus metallischem Eisen (reduziertes Eisen, bis zu 1 g pro Dosis) verwendet, das in Salzsäure von Magensaft leicht löslich ist. Daher ähnelt die Wirkung dieses Arzneimittels der von Eisen(II)-chlorid. Medikamente, die bioanorganische Komplexe von Eisen mit Zuckern, Nicotinamid und anderen organischen Substanzen sind, sind jedoch wirksamer. Solche Komplexe werden gut in das Blut aufgenommen, was der Grund für ihre pharmakologische Wirksamkeit ist. Es ist interessant festzustellen, dass von der Antike bis zur Gegenwart der sogenannte Eisenwein, ein Getränk, das durch Aufgießen von Traubenwein auf Eisenspäne hergestellt wird, zur Behandlung von Eisenmangelanämie verwendet wird. Offensichtlich löst sich Eisen im Wein (saures Medium) und bildet Komplexe mit natürlichen organischen Substanzen, die es in großen Mengen enthält. Es ist klar, dass der Wirkungsmechanismus des alten Getränks in etwa dem moderner Medikamente entspricht. Kobalt gehört wie Eisen zu den wichtigsten biogenen Elementen. Die Gesamtmasse von Kobalt im Körper eines Erwachsenen beträgt etwa 1,2 mg, was weniger als 10 % entspricht. Etwa 100 mg dieser Masse liegen in Form von Cyanocobalamin (fettlösliches Vitamin B12 ) und seine Analoga. Diese Substanz ist wie das Häm eine makrozyklische Komplexverbindung. Als makrocyclischer Ligand fungiert eine vierzähnige Verbindung, Porphin. R ist ein komplexer organischer Substituent. In Analoga von Cyanocobalamin wirken anstelle des CN-Anions verschiedene organische Substituenten. Die wichtigste Rolle von Vitamin B12 spielt bei der Entwicklung und Bildung von roten Blutkörperchen (Erythropoese) eine Rolle. Vitamin B-Mangel12 (Einnahme von weniger als 3 µg pro Tag) führt zu einer schweren Erkrankung – perniziöser Anämie (Anämie). Es wurde festgestellt, dass Analoga von Cyanocobalamin Aktivatoren sind - Cofaktoren verschiedener Enzyme, die an der Erythropoese beteiligt sind. Der Mangel an Cofaktoren äußert sich im Mangel an Hämoglobin und Erythrozyten. Pflanzen und Tiere können Vitamin B nicht synthetisieren12. Es wird nur von bestimmten Bakterienarten produziert. Diese Bakterien kommen im menschlichen Magen-Darm-Trakt vor. Sie synthetisieren ausreichend Vitamin B12. Perniziöse Anämie ist mit einer gestörten Aufnahme dieses Vitamins ins Blut verbunden. Daher ist die Einnahme von Pillen unwirksam. Eine Injektion von Vitamin (100-200 mcg für 2 Tage) in das Blut verbessert den Zustand des Patienten mit maligner Anämie erheblich. 44. Die Rolle der d-Elemente der IB-Gruppe. Die Verwendung ihrer Verbindungen in der Medizin Kupfer Cu ist ein essentielles Mikroelement für lebende Organismen. Silber Ag und Gold Au sind Spurenelemente. Ihre Verbindungen werden in der Medizin verwendet. Kupfer ist ein biogenes Element, das im Gewebe von Tieren und Pflanzen vorkommt. Die Gesamtmasse an Kupfer im erwachsenen menschlichen Körper beträgt etwa 100 mg, was etwa 0,0001 % entspricht. Ungefähr 30 % dieser Menge befinden sich in den Muskeln. Auch Leber und Gehirn sind reich an Kupfer. Metallisches Kupfer und seine Verbindungen sind giftig. Aus physiologischer Sicht sind die kupferhaltigen Proteine Cytochromoxidase und Superoxiddismutase die wichtigsten. Cytochromoxidase ist eine der Komponenten der Atmungskette, die in Mitochondrienmembranen lokalisiert ist. Sorgt für Zellatmung, indem Sauerstoff am Ende der Atmungskette zu Wasser reduziert wird. Der Körper benötigt täglich 2,5-5,0 mg Kupfer. Bei einem Mangel an Kupfer im Körper kann eine Krankheit entstehen – die Kupfermangelanämie. Kupfer ist für die Aufnahme von Eisen notwendig, insbesondere bei der Synthese der Cytochromoxidase, die sowohl Eisen als auch Kupfer enthält. Bei Kupfermangel ist die normale Entwicklung von Bindegewebe und Blutgefäßen gestört. Vergiftungen sind normalerweise mit einer versehentlichen Überdosierung von Insektiziden, dem Einatmen von Metallpulver und der Einnahme von Kupfersalzlösungen verbunden. Getränke, die in Kupfergefäßen ohne Schutzbeschichtung der Wände gelagert werden, sind eine große Gefahr. Als externes Mittel wird eine 0,25 %ige wässrige Lösung von Kupfersulfat CuSO verwendet.4 bei Schleimhautentzündung und Bindehautentzündung. Kleine Dosen dieses Medikaments können mit Nahrung eingenommen werden, um die Erythropoese bei Anämie zu erhöhen. Silber und Gold Im Körper eines Erwachsenen findet man etwa 1 mg Silber, also etwa 10 % (1 ppm), und bis zu 10 mg Gold, also etwa 10 % (10 ppm). Die antiseptischen Eigenschaften löslicher Silbersalze sind seit der Antike bekannt. Priester wissen seit langem, dass Wasser ("heilig"), wenn es in Silbergefäßen aufbewahrt wird, lange Zeit nicht verdirbt, dh es wird keiner mikrobiellen Kontamination ausgesetzt. Derzeit wird diese Eigenschaft des "silbernen" Wassers von Seeleuten auf Langstreckenreisen genutzt. Starke toxische Manifestationen bei einem Erwachsenen werden beobachtet, wenn 7 g AgNO eingenommen werden.3. In der Medizin werden Medikamente wie kristallines Silbernitrat AgNO03 (Lapis) und seine wässrigen Lösungen seit langem verwendet. Kolloidale metallische Silberpräparate Protargol (8 % Ag) und Collargol (70 % Ag) sind seit langem bekannt, die feine Pulver mit metallischem Glanz sind. Jedes Partikel solcher Pulver ist ein Kristall aus reduziertem metallischem Silber mit einer Größe von weniger als 1 μm mit einer Proteinhülle aus Albumin (Protargol) oder Kollagen (Collargol). Die Proteinhülle schützt die Silberkristalle vor dem Zusammenkleben und sorgt für deren Übergang in das wässrige Medium (solubilisiert). Silberpräparate werden als entzündungshemmende, antiseptische und adstringierende Mittel eingesetzt. Goldpräparate werden auch als wirksame entzündungshemmende Medikamente eingesetzt. Die bekanntesten sind Krizanol mit 30 % Edelmetallgehalt und kolloidales Gold. 45. Biologische Rolle der d-Elemente der Gruppe IIB. Die Verwendung ihrer Verbindungen in der Medizin Zink Zn, Cadmium Cd, Quecksilber Hg sind Spurenelemente. Der Körper eines Erwachsenen enthält 1,8 g Zn, 50 mg Cd, 13 mg Hg. Cadmium und Quecksilber sind Verunreinigungselemente. Etwa 70 % des Quecksilbers sind im Fett- und Muskelgewebe konzentriert. Cadmium ist zu 30 % in den Nieren lokalisiert, der Rest in Leber, Lunge und Bauchspeicheldrüse. Zink ist ein essentielles Element für alle Pflanzen und Tiere. Im Körper eines Erwachsenen befindet sich das meiste Zink in den Muskeln (65 %) und Knochen (20 %). Der Rest der Menge fällt auf Blutplasma, Leber, Erythrozyten. Die höchste Zinkkonzentration in der Prostata. Zink weist keine variable Wertigkeit auf. Offensichtlich nehmen daher seine Biokomplexe an vielen biochemischen Hydrolysereaktionen teil, die ohne Elektronentransfer ablaufen. Das Zn-Ion ist Teil von mehr als 40 Metalloenzymen, die die Hydrolyse von Estern und Proteinen katalysieren. Einer der am besten untersuchten ist der bioanorganische Zinkkomplex - das Enzym Carboanhydrase (Mg = 30), bestehend aus etwa 000 Aminosäureresten. Zink ist kein Bestandteil von Dipeptidasen – Enzymen, die die Hydrolyse von Dipeptiden (Substanzen bestehend aus 2 Aminosäuren) katalysieren. Zink bildet einen bioanorganischen Komplex mit Insulin, einem Hormon, das den Blutzucker reguliert. Der menschliche Bedarf an Zink wird vollständig durch Nahrungsmittel gedeckt: Fleisch, Milchprodukte, Eier. Bei einem Mangel an Zink in Pflanzen wird der Eiweiß- und Kohlenhydratstoffwechsel gestört und die Synthese von Chlorophyll und Vitaminen gehemmt. Zinkmangel wird durch den Einsatz von zinkhaltigen Düngemitteln beseitigt. Die Toxizität von Verbindungen der Gruppe IIB nimmt von Zink zu Quecksilber zu. Wasserlösliche Verbindungen reizen die Haut und führen bei Verschlucken zu Vergiftungen. Auch die Metalle selbst sind giftig – beim Einatmen von Zinkdampf (Luft aus der Zinkproduktion) entsteht „Metall“-Fieber. Eine Vergiftung durch Quecksilberdampf wurde im Mittelalter als „Bluthutmacher-Krankheit“ bezeichnet. Der Quecksilbergehalt in Lebensmitteln (Meeresfrüchte, wie in Japan) führt zur Minomata-Krankheit. Quecksilbertoxizität geht mit der Agglutination (Zusammenkleben) der roten Blutkörperchen und der Hemmung von Enzymen einher. Sublimat verursacht beispielsweise eine Größenänderung, osmotische Zerbrechlichkeit und eine Abnahme der Verformbarkeit der roten Blutkörperchen, die für ihre Bewegung durch die Kapillaren notwendig ist. Die Toxizität von Cadmium hängt mit seiner Affinität zu Nukleinsäuren zusammen. Durch die Bindung an die DNA wird seine Funktion gestört. Chronische Cadmium- und Quecksilbertoxizität können die Knochenmineralisierung beeinträchtigen. Giftige Elemente können Kalzium ersetzen. Dies führt zur Bildung von Apatit mit einer unvollkommenen Struktur aufgrund der Verzerrung der Parameter der kristallinen Komponente des Knochengewebes. Infolgedessen nimmt die Knochenfestigkeit ab. 46. Toxische Eigenschaften von Verbindungen der Gruppe IIB (Zn, Cd, Hg) Verbindungen Zn, Cd, Hg können eine Verletzung des Proteinstoffwechsels verursachen, die sich in der Freisetzung von Plasmaproteinen über die Nieren (bei Proteinurie) äußert. Die toxische Wirkung von Verbindungen der Gruppe IIB auf den Körper wird auch dadurch verursacht, dass diese Metallionen mit den Sulfhydryl-SH-Gruppen von Proteinen, Enzymen und Aminosäuren interagieren. Bei der Wechselwirkung von Metallionen mit SH-Gruppen entstehen schwach dissoziierende und in der Regel unlösliche Verbindungen. Daher führt die Blockierung von Sulfhydrylgruppen zur Unterdrückung der Enzymaktivität und der Proteinfaltung. Zweiwertige Metallionen blockieren gleichzeitig zwei SH-Gruppen. Bei Reaktionen dieser Art fungieren Metallionen als Akzeptor und Schwefel als Elektronendonor. Die ausgeprägteste chemische Affinität zu SH-Gruppen in Quecksilber. Offensichtlich liegt dies daran, dass Quecksilber stärker komplexiert und mit Schwefel stärkere Bindungen eingeht. SH-Gruppen sind Bestandteil von mehr als 100 Enzymen, deren Aktivität durch Blockierung dieser Gruppen unterdrückt werden kann. Daher ist es offensichtlich, wie wichtig es ist, den Blockierungsmechanismus und die Behandlungsmethoden für die Vergiftung des Körpers mit Metallen zu kennen. Es ist bekannt, dass die toxischen Eigenschaften von Elementen von der chemischen Form abhängen, in der sie in den Körper gelangen. Die giftigsten Formen sind diejenigen, die sich in Lipiden auflösen und leicht durch die Membran in die Zelle eindringen. Die Literatur beschreibt einen Fall von Massenvergiftung mit Quecksilber in Japan. Anorganische Quecksilberverbindungen wurden unter Einwirkung von Enzymen von Mikroorganismen in Methylquecksilber umgewandelt. Methylquecksilber reicherte sich in Fischen an und gelangte dann mit der Nahrung in den menschlichen Körper. Methylquecksilber reichert sich allmählich an und verursacht irreversible Zerstörung im Körper und Tod. Die Verwendung von Zink- und Quecksilberverbindungen in der Medizin beruht auf ihrer adstringierenden, ätzenden und antiseptischen Wirkung. Als Augentropfen wird eine 0,25 %ige wässrige Lösung von Zinksulfat ZnSO verwendet.4. In der Zahnheilkunde wird Zinkchlorid zum Kauterisieren von Papillomen, zur Behandlung entzündeter Schleimhäute verwendet. Auch Zinkoxid ZnO wird verwendet. Quecksilber(II)-chlorid (Quecksilberchlorid) ist sehr giftig, und seine wässrigen Lösungen in hohen Verdünnungen (1: 1000) werden zur Desinfektion verwendet. Zur Behandlung von Haut- und Geschlechtskrankheiten werden Salben verwendet, die Quecksilberoxid (II) HgO und Quecksilbersulfid (II) HgS enthalten. Quecksilber(I)-chlorid (Kalomel) ist schwer wasserlöslich und daher leicht giftig. Dieses Salz wird in der Veterinärmedizin als Abführmittel verwendet. Quecksilber ist unter normalen Bedingungen ein flüssiges Metall, das in der Lage ist, andere Metalle aufzulösen. Dabei entstehen harte Legierungen – Amalgame. In der Zahnheilkunde werden Silber- und Cadmiumamalgame seit langem zum Füllen von Zähnen verwendet. Sie sind chemisch inert, erweichen beim Erhitzen leicht und lassen sich daher leicht formen. Ultraviolette Lichtquellen – Quecksilber-Quarzlampen für medizinische Zwecke – enthalten gasförmiges Quecksilber (Dampf). Bei der Bestrahlung mit dem Licht dieser Lampen in Krankenhausräumen werden in der Luft enthaltene Mikroorganismen abgetötet. Mit Hilfe ultravioletter Strahlen werden verschiedene Hautkrankheiten behandelt. So können Metalle der IIB-Gruppe nach Art ihrer Funktion und Wirkung auf den Körper in das lebenswichtige Element Zn und die toxischen Verunreinigungselemente Cd und Hg unterteilt werden. 47. Biologische Rolle der p-Elemente der Gruppe IIIA. Die Verwendung ihrer Verbindungen in der Medizin Bor ist ein Verunreinigungsspurenelement, sein Massenanteil im menschlichen Körper beträgt 105%. Bor ist hauptsächlich in Lunge (0,34 mg), Schilddrüse (0,30 mg), Milz (0,26 mg), Leber, Gehirn (0,22 mg), Nieren, Herzmuskel (0,21 mg) konzentriert. Die biologische Wirkung von Bor ist noch nicht ausreichend untersucht. Bor ist bekanntermaßen in Zähnen und Knochen vorhanden, anscheinend in Form schwerlöslicher Salze der Borsäure mit Metallkationen. Überschüssiges Bor ist schädlich für den menschlichen Körper. Es gibt Hinweise darauf, dass ein Überschuss an Bor Amylasen und Proteinasen hemmt und die Aktivität von Adrenalin reduziert. Gemäß dem Gehalt im menschlichen Körper (105%) gehört Aluminium zu den Mikroelementen der Verunreinigung. Aluminium ist hauptsächlich im Blutserum, in der Lunge, in der Leber, in den Knochen, in den Nieren, in den Nägeln und in den Haaren konzentriert und dringt in die Struktur der Nervenhüllen des menschlichen Gehirns ein. Die tägliche Aufnahme von Aluminium durch einen Menschen beträgt 47 mg. Aluminium beeinflusst die Entwicklung von Epithel- und Bindegewebe, die Regeneration von Knochengewebe, beeinflusst den Phosphoraustausch. Aluminium wirkt auf enzymatische Prozesse ein. Ein Überschuss an Aluminium im Körper hemmt die Synthese von Hämoglobin, da Aluminium aufgrund seiner relativ hohen Komplexierungsfähigkeit die aktiven Zentren von Enzymen blockiert, die an der Hämatopoese beteiligt sind. Es gibt Hinweise darauf, dass Aluminium die Transaminierungsreaktion katalysieren kann. Gallium ist ein Spurenelement der Verunreinigung (der Gehalt im menschlichen Körper beträgt 10-6-10-5%). Die biologische Rolle von Gallium in lebenden Organismen ist fast nicht klar. Thallium ist ein hochgiftiges Element. Das T1-Ion neigt wie Ag+ dazu, starke Verbindungen mit schwefelhaltigen Liganden zu bilden. Dadurch ist es sehr giftig, da es die Aktivität von Enzymen hemmt, die Thiogruppen (SH) enthalten. Selbst sehr geringe Mengen an T1+-Verbindungen verursachen bei Einnahme Haarausfall. Aufgrund der Nähe der Radien K+ und T1+ sie haben ähnliche Eigenschaften und können sich in Enzymen gegenseitig ersetzen. Die Ionen T1 und K sind Synergisten. Dies erklärt die Tatsache, dass die Enzyme Pyruvatkinase und Dioldehydratase nicht nur durch K-Ionen, sondern auch durch T1-Ionen aktiviert werden (das T1-Ion ersetzt das K-Ion im katalytischen Zentrum von Enzymen). Der Synergismus von Thallium und Kalium zeigt sich auch darin, dass sich T1-Ionen wie K-Ionen in Erythrozyten anreichern. Als Gegenmittel bei einer T1-Ionenvergiftung wird ein schwefelhaltiger Ligand, die Aminosäure Cystin, eingesetzt. Abschließend ist festzuhalten, dass die biologische Rolle der p-Elemente der Gruppe IIIA nicht ausreichend untersucht wurde. Es ist jetzt bekannt, dass Bor und Gallium in Pflanzen mit Polyphenolen, Inhibitoren ihrer Entwicklung, interagieren und die Toxizität der letzteren verringern. Die unbestrittene Rolle von Aluminium beim Aufbau von Epithel- und Bindegewebe und darüber hinaus seine Beteiligung an enzymatischen Prozessen, sowohl als Aktivator als auch als Inhibitor, wurde ebenfalls festgestellt. Das T1-Ion hat die Fähigkeit, viele schwefelhaltige Enzyme zu hemmen. Die biologische Aktivität von Elementen der Gruppe IIIA hängt hauptsächlich mit ihrer Fähigkeit zusammen, komplexe Verbindungen mit sauerstoffhaltigen Liganden und unlöslichen Phosphaten zu bilden. 48. Biologische Rolle von p-Elementen der IVA-Gruppe. Die Verwendung ihrer Verbindungen in der Medizin Entsprechend dem Gehalt im menschlichen Körper (21,15 %) gehört Kohlenstoff zu den Makronährstoffen. Es ist ein Bestandteil aller Gewebe und Zellen in Form von Proteinen, Fetten, Kohlenhydraten, Vitaminen, Hormonen. Aus biologischer Sicht ist Kohlenstoff das Organogen Nummer 1. Entsprechend dem Gehalt im menschlichen Körper (103 % ־) gehört Silizium zu den Mikroelementen der Verunreinigung. Das meiste Silizium in Leber, Nebennieren, Haaren, Linse. Da natürliches Siliziumdioxid schwer wasserlöslich ist, gelangt es weniger über den Verdauungstrakt als vielmehr über die Luft als staubförmiges SiOXNUMX über die Lunge in den menschlichen Körper2. Mit einer Verletzung des Siliziumstoffwechsels ist das Auftreten von Bluthochdruck, Rheuma, Geschwüren und Anämie verbunden. In der medizinischen Praxis wird Siliziumkarbid (IV) SiC verwendet - Karborund zum Schleifen von Füllungen und Kunststoffprothesen. Siliziumdioxid SiO2 Bestandteil von Silikatzementen. Es ist zu beachten, dass Staub, der aus Partikeln von Kohle, Siliziumdioxid und Aluminium besteht, bei systematischer Exposition gegenüber der Lunge eine Krankheit verursacht – Pneumokoniose. Bei Einwirkung von Kohlenstaub kommt es zur Anthrakose, einer Berufskrankheit der Bergleute. Wenn Sie S1O-haltigen Staub einatmen2 Es kommt zu Silikose und bei Einwirkung von Aluminiumstaub zu Aluminose. Entsprechend dem Gehalt im menschlichen Körper (10-6-10-5%) Germanium ist ein Spurenelement. Die biologische Rolle ist noch nicht vollständig aufgeklärt. Germaniumverbindungen verstärken die Prozesse der Blutbildung im Knochenmark. Es ist auch bekannt, dass Germaniumverbindungen eine geringe Toxizität aufweisen. Entsprechend dem Gehalt im menschlichen Körper (104 %) Zinn bezieht sich auf Spurenelemente. Zinn gelangt in den menschlichen Körper mit säurehaltigen Lebensmitteln, die in Blechdosen aufbewahrt werden, die mit einer Zinnschicht überzogen sind. Im sauren Milieu löst sich Zinn auf und gelangt als Salz ins Blut, wo es eine toxische Wirkung entfaltet. In Experimenten an Ratten wurde jedoch festgestellt, dass Zinn in geringen Mengen eine stimulierende Wirkung auf das Wachstum von Ratten hat. Dies gibt Anlass zu der Annahme, dass es für den Menschen notwendig ist. Zweifellos erfordert die Aufklärung der biologischen Rolle dieses Mikroelements weitere Untersuchungen. In der medizinischen Praxis werden verschiedene Materialien verwendet, insbesondere zinnhaltige Füllungsmaterialien. So ist Zinn Bestandteil des Silberamalgams (28 %) zur Herstellung von Füllungen. Blei und seine Verbindungen, insbesondere organische, sind hochgiftig. Leitverbindungen beeinflussen die Proteinsynthese, den Energiehaushalt der Zelle und ihren genetischen Apparat. Viele Faktoren begünstigen den Denaturierungsmechanismus. Es wurde festgestellt, dass Blei eines der Elemente ist, deren Vorhandensein in Lebensmitteln die Entstehung von Karies beeinflusst. Mit Nahrung, Wasser und atmosphärischer Luft nimmt ein Mensch täglich bis zu 100 µg Blei auf. Blei lagert sich hauptsächlich im Skelett (bis zu 90 %) in Form von schwerlöslichem Phosphat ab. Der Massenanteil von Blei im menschlichen Körper beträgt 106 %. Eine tägliche Aufnahme von 0,2-2 mg Blei gilt als unbedenklich für den Menschen. In der medizinischen Praxis haben Bleiacetat (Lotionen) und Bleioxid (II) PbO (Bestandteil des einfachen Bleipflasters) als externe adstringierende Antiseptika Anwendung gefunden. 49. Biologische Rolle von p-Elementen der VA-Gruppe. Die Verwendung ihrer Verbindungen in der Medizin (Stickstoff, Phosphor) Der Stickstoffgehalt im menschlichen Körper (3,1 %) gehört zu den Makroelementen. Berücksichtigt man nur die Masse der Körpertrockenmasse (ohne Wasser), dann beträgt der Stickstoffgehalt in den Zellen 8-10 %. Dieses Element ist Bestandteil von Aminosäuren, Proteinen, Vitaminen und Hormonen. Stickstoff bildet polare Bindungen mit Wasserstoff- und Kohlenstoffatomen in Biomolekülen. In vielen bioanorganischen Komplexen (Metalloenzymen) binden Stickstoffatome die anorganischen und organischen Teile des Moleküls über einen Donor-Akzeptor-Mechanismus. Stickstoff bildet zusammen mit Sauerstoff und Kohlenstoff lebenswichtige Verbindungen – Aminosäuren, die gleichzeitig eine Aminogruppe mit basischen Eigenschaften und eine Carboxylgruppe (-COOH) mit sauren Eigenschaften enthalten. Auch in Nukleinsäuremolekülen erfüllt die Aminogruppe eine sehr wichtige Funktion. Die physiologische Bedeutung stickstoffhaltiger Bioliganden – Porphyrine, zum Beispiel Hämoglobin – ist enorm. Der Stickstoffkreislauf findet in der Biosphäre statt. Der Stickstoffkreislauf ist für die Landwirtschaft lebenswichtig. Es ist notwendig, eine weitere biologisch wichtige Eigenschaft von Stickstoff zu beachten - seine Löslichkeit in Wasser ist fast die gleiche wie die von Sauerstoff. Das Vorhandensein von überschüssigem Stickstoff im Blut kann die Ursache für die Entwicklung der Dekompressionskrankheit sein. Mit dem schnellen Aufstieg der Taucher kommt es zu einem starken Druckabfall, die Löslichkeit von Stickstoff im Blut nimmt entsprechend ab (Henry-Gesetz) und Blasen aus elementarem Stickstoff, die das Blut verlassen, verstopfen kleine Gefäße, was zu Lähmungen und zum Tod führen kann. Aufgrund seines Gehalts im menschlichen Körper (0,95 %) wird Phosphor als Makronährstoff eingestuft. Phosphor ist ein organogenes Element und spielt eine äußerst wichtige Rolle im Stoffwechsel. Phosphor ist in Form von Phosphat ein wesentlicher Bestandteil des intrazellulären ATP. Es ist Bestandteil von Proteinen (0,5–0,6 %), Nukleinsäuren, Nukleotiden und anderen biologisch aktiven Verbindungen. Phosphor ist die Grundlage des Skeletts von Tieren und Menschen (Calciumorthophosphat, Hydroxylapatit) und der Zähne (Hydroxylapatit, Fluorapatit). Viele biosynthetische Reaktionen werden aufgrund der Übertragung von Phosphatgruppen von einem hochenergetischen Akzeptor auf einen niederenergetischen Akzeptor durchgeführt. Das Phosphatpuffersystem ist eines der wichtigsten Puffersysteme im Blut. Lebende Organismen können ohne Phosphor nicht auskommen. Die Bedeutung von Phosphor liegt darin begründet, dass Zucker und Fettsäuren ohne vorherige Phosphorylierung von den Zellen nicht als Energiequelle genutzt werden können. Der Austausch von Phosphor im Körper ist eng mit dem Austausch von Calcium verbunden. Dies wird durch eine Abnahme der Menge an anorganischem Phosphor mit einer Zunahme des Calciumgehalts im Blut (Antagonismus) bestätigt. Der tägliche Bedarf des Menschen an Phosphor beträgt 1,3 g. Phosphor ist in Lebensmitteln so weit verbreitet, dass Fälle seines offensichtlichen Mangels (Phosphatmangel) praktisch unbekannt sind. Allerdings kann nicht der gesamte in Lebensmitteln enthaltene Phosphor aufgenommen werden, da seine Aufnahme von vielen Faktoren abhängt: dem pH-Wert, dem Verhältnis zwischen dem Kalzium- und Phosphorgehalt in der Nahrung, dem Vorhandensein von Fettsäuren in der Nahrung, vor allem aber vom Vitamin-D-Gehalt. Eine Reihe von Phosphorverbindungen werden als Arzneimittel verwendet. Es sollte beachtet werden, dass Organophosphorverbindungen, die die C-P-Bindung enthalten, starke Nervengifte sind und Bestandteil chemischer Kampfstoffe sind. 50. Biologische Rolle von p-Elementen der VA-Gruppe (Arsen, Antimon, Wismut). Ihre Verwendung in der Medizin Entsprechend dem Gehalt im menschlichen Körper gehört Arsen zu den Spurenelementen. Es konzentriert sich in Leber, Nieren, Milz, Lunge, Knochen und Haaren. Das meiste Arsen kommt im Gehirngewebe und in den Muskeln vor. Arsen reichert sich in Knochen und Haaren an und wird ihnen über mehrere Jahre nicht vollständig entzogen. Dieses Merkmal dient der forensischen Untersuchung zur Klärung der Frage, ob eine Vergiftung mit Arsenverbindungen vorliegt. Die Bestimmung von Arsen in biologischem Material erfolgt in einem einfachen Gerät nach der Marsh-Reaktion: Dem biologischen Objekt werden Zink und Salzsäure zugesetzt. Der während der Reaktion freigesetzte Wasserstoff reduziert jede Arsenverbindung zu Arsenwasserstoff. Enthält der freigesetzte Wasserstoff eine Beimischung von Arsenwasserstoff, so zersetzt sich AsH beim Erhitzen des Gasgemisches3 : 2Ash3 = 2As° + 3H2. und an den Wänden des Gasfreisetzungsrohrs bildet sich eine schwarz glänzende Beschichtung aus Arsen – ein „Arsenspiegel“. Die Marsh-Reaktion ist sehr empfindlich und ermöglicht den Nachweis von 7-107 Arsen. In relativ großen Dosen sind Arsenverbindungen sehr giftig. Wie bereits erwähnt, beruht die toxische Wirkung von Arsenverbindungen auf der Blockierung von Sulfhydrylgruppen von Enzymen und anderen biologisch aktiven Substanzen. Antimon und Wismut gelten aufgrund ihres Gehalts im menschlichen Körper (10 %) als Mikroelemente. Nach der Klassifikation von V. V. Kovalsky werden Antimon und Wismut als Mitglieder der Gruppe der Mikroelemente eingestuft, die in lebenden Organismen ständig vorkommen, deren physiologische und biochemische Rolle jedoch praktisch unbekannt ist. Die physiologische Rolle von Antimon ähnelt offensichtlich der von Arsen. Synergisten sind Ionen von Arsen As und Antimon Sb und in geringerem Maße Wismut Bi. So ist bekannt, dass in biogeochemischen Provinzen mit einem Überschuss an Arsen in Organismen nicht nur der Gehalt an Arsen, sondern auch an Antimon zunimmt. Gleichzeitig reichern sich beide Elemente in der Schilddrüse der Bewohner an, hemmen deren Funktion und verursachen endemische Kropfbildung. Der Synergismus von Arsen und Antimon ist mit ihrer Fähigkeit verbunden, Verbindungen mit schwefelhaltigen Liganden zu bilden. Wismut neigt eher dazu, mit Liganden zu binden, die Aminogruppen enthalten. So führt das Eindringen löslicher Wismutverbindungen in den Körper zu einer Hemmung der Enzyme Amino- und Carboxypolypeptidase. Die Einnahme von wasserlöslichen Antimonverbindungen wie Stibin SbH3 hat eine ähnliche toxische Wirkung wie Arsenverbindungen. Wismutverbindungen sind auch toxisch, wenn sie injiziert werden. Beispielsweise beträgt die tödliche Dosis für Hunde 6 mg/kg Körpergewicht. Wenn die meisten Antimon- und Wismutverbindungen jedoch in den Verdauungstrakt gelangen, haben sie praktisch keine toxische Wirkung. Die schwache Toxizität dieser Verbindungen beruht auf der Tatsache, dass Sb (III), Bi (III) -Salze im Verdauungstrakt unter Bildung schwerlöslicher Produkte hydrolysiert werden, die nicht von den Wänden des Magen-Darm-Trakts absorbiert werden. Dies ist die Grundlage für die Verwendung von Arzneimitteln aus Antimon und Wismut, beispielsweise basisches Wismutnitrat. 51. Biologische Rolle der p-Elemente der VIA-Gruppe. Die Verwendung ihrer Verbindungen in der Medizin Gemäß dem Gehalt im menschlichen Körper (62 %) gehört Sauerstoff zu den Makronährstoffen. Es ist unverzichtbar und eines der wichtigsten Elemente, die die Grundlage lebender Systeme bilden, dh es ist ein Organogen. Sauerstoff ist Teil einer Vielzahl von Molekülen, die von den einfachsten bis zu Biopolymeren reichen. Die Rolle von Sauerstoff in Lebensprozessen ist groß, da die Oxidation von Nährstoffen (Kohlenhydraten, Proteinen, Fetten) mit Sauerstoff als Energiequelle dient, die für das Funktionieren von Organen und Geweben lebender Organismen erforderlich ist. Die meisten Redoxreaktionen im Körper laufen unter Beteiligung von Sauerstoff und seinen aktiven Formen ab. Die phagozytischen (Schutz-)Funktionen des Körpers sind auch mit dem Vorhandensein von Sauerstoff verbunden, und eine Abnahme des Sauerstoffgehalts im Körper verringert seine Schutzeigenschaften. In Fresszellen (Zellen, die Fremdkörper einfangen und verdauen können) wird Sauerstoff O02 zu Superoxid reduziert. In der medizinischen Praxis wird Sauerstoff zur Inhalation bei schmerzhaften Zuständen mit Sauerstoffmangel (Hypoxie), Erkrankungen der Atemwege, des Herz-Kreislauf-Systems, Vergiftungen mit Kohlenmonoxid (II) CO, Blausäure HCN sowie Erkrankungen mit eingeschränkter Atemfunktion eingesetzt . In der klinischen Praxis weit verbreitet ist die hyperbare Oxygenierung – die Verwendung von Sauerstoff unter hohem Druck. Die allotrope Modifikation von Sauerstoff - Ozon O3 als sehr starkes Oxidationsmittel wird zur Desinfektion von Räumen, Luftdesinfektion und Trinkwasserreinigung verwendet. Gemessen am Gehalt im menschlichen Körper (0,16 %) wird Schwefel als Makronährstoff eingestuft. Es ist wie Sauerstoff lebenswichtig. Der Tagesbedarf eines Erwachsenen an Schwefel beträgt etwa 4-5 g. Schwefel ist Bestandteil vieler Biomoleküle – Proteine, Aminosäuren (Cystin, Cystein, Methionin usw.), Hormone (Insulin), Vitamine (Vitamin B1). Viel Schwefel ist in Carotin in Haaren, Knochen und Nervengewebe enthalten. In lebenden Organismen wird Schwefel, der Bestandteil von Aminosäuren ist, oxidiert. Die Endprodukte dieses Verfahrens sind überwiegend Sulfate. Außerdem werden Thiosulfate, Zementschwefel und Polythionsäuren gebildet. Je nach Inhalt im Körper (10-5-10-7%) Selen ist ein Spurenelement. Einige Forscher halten es für ein lebenswichtiges Element. Selen kommt aus der Nahrung - 55-110 mg pro Jahr. Selen ist hauptsächlich in der Leber und den Nieren konzentriert. Die Selenkonzentration im Blut beträgt 0,001-0,004 mmol / l. Die Verbindung von Selen mit Schwefel in lebenden Organismen ist unbestritten. Bei hohen Dosen reichert sich Selen vor allem in Nägeln und Haaren an, die auf schwefelhaltigen Aminosäuren basieren. Bekannt ist auch die Fähigkeit von Selen, den Körper vor Vergiftungen mit Quecksilber Hg und Cadmium Cd zu schützen. Selen fördert die Bindung dieser toxischen Metalle an andere aktive Zentren, die nicht von ihrer toxischen Wirkung betroffen sind. Interessant ist der Zusammenhang zwischen einem hohen Selengehalt in der Ernährung und einer geringen Krebssterblichkeit. Selen ist in hohen Dosen giftig. Der Abbau von Selenverbindungen bei Tieren führt zur Freisetzung des hochgiftigen Dimethylselens, das nach Knoblauch riecht. 52. Biologische Rolle von p-Elementen der Gruppe VIIA. Die Verwendung ihrer Verbindungen in der Medizin (Fluor und Chlor) Gemessen am Gehalt im menschlichen Körper gehört Chlor (0,15 %) zu den Makroelementen, während die übrigen Elemente dieser Gruppe Mikroelemente sind (Gehalt - 10).5 %). Halogene in Form verschiedener Verbindungen sind Bestandteil des Gewebes von Menschen und Tieren. Chlor und Jod sind unersetzliche Elemente, während der Rest dauerhafte Bestandteile des Gewebes sind. Die Masse an Fluor im menschlichen Körper beträgt etwa 7 mg (~105 %). Fluorverbindungen sind in Knochengewebe, Nägeln und Zähnen konzentriert. Die Zusammensetzung der Zähne enthält etwa 0,01% Fluor, und das meiste davon fällt auf den Zahnschmelz, der mit dem Vorhandensein von schwerlöslichem Fluorapatit darin verbunden ist. Der Mangel an Fluorid im Körper führt zu Zahnkaries. Das Interesse an der biologischen Wirkung von Fluor ist vor allem mit der Problematik von Zahnerkrankungen verbunden, da Fluor die Zähne vor Karies schützt. Die mineralische Basis von Zahngewebe (Dentin) ist Hydroxyapatit, Chlorapatit und Fluorapatit. Sehr oft wird nicht die mit einer Schmelzschicht bedeckte äußere Oberfläche des Zahns zerstört, sondern die inneren Teile des Dentins, die freigelegt werden, wenn der Zahnschmelz beschädigt wird. Es gibt Hinweise darauf, dass, während der Zahnschmelz leicht geschädigt ist, die Einführung von Natriumfluorid die Bildung von Fluorapatit fördert, was die Remineralisierung des begonnenen Schadens erleichtert. Natriumfluorid NaF wird in der medizinischen Praxis als topisches externes Mittel verwendet. Die Verwendung von NaF basiert auf der Bildung von Fluorapatit. Gleichzeitig erfolgt auch die Alkalisierung des Mundhöhlenmilieus, was zur Neutralisation der von Bakterien produzierten Säuren beiträgt. Nicht nur ein Mangel, sondern auch ein Überschuss an Fluorid ist schädlich. Wenn der Fluoridgehalt im Trinkwasser höher ist als die maximal zulässige Norm (1,2 mg/l), wird der Zahnschmelz brüchig, kann leicht zerstört werden und es treten andere Symptome einer chronischen Fluoridvergiftung auf – erhöhte Knochenbrüchigkeit, Knochendeformationen und allgemeine Erschöpfung des Körpers . Die in diesem Fall auftretende Krankheit wird Fluorose (Fluorose) genannt. Der menschliche Körper enthält etwa 100 g (2790 mmol) Chlor. Chloridionen spielen eine wichtige biologische Rolle. Sie aktivieren einige Enzyme, schaffen ein günstiges Umfeld für die Wirkung protolytischer Enzyme des Magensaftes, sorgen für Ionenflüsse durch Zellmembranen und sind an der Aufrechterhaltung des osmotischen Gleichgewichts beteiligt. Chloridion hat einen optimalen Radius zum Eindringen durch die Zellmembran. Dies erklärt seine gemeinsame Beteiligung mit Na- und K-Ionen an der Schaffung eines bestimmten osmotischen Drucks und der Regulierung des Wasser-Salz-Stoffwechsels. Der Tagesbedarf an Natriumchlorid beträgt 5-10 g NaCl ist, wie bereits erwähnt, für die Salzsäureproduktion im Magen notwendig. Neben der wichtigen Rolle der Salzsäure im Verdauungsprozess zerstört sie verschiedene pathogene Bakterien (Cholera, Typhus). Wenn Bakterien mit einer großen Menge Wasser in den Magen gelangen, hat dies aufgrund der Verdünnung von HCl keine antibakterielle Wirkung und die Bakterien überleben. Dies führt zu Krankheiten im Körper. Daher ist Rohwasser während Epidemien besonders gefährlich. Bei einer unzureichenden Menge an Salzsäure im Magen steigt der pH-Wert und die normale Verdauung wird gestört, was die menschliche Gesundheit ernsthaft beeinträchtigt. Bei reduziertem Säuregehalt des Magensaftes wird in der medizinischen Praxis eine verdünnte Salzsäurelösung verwendet. Bei Magenentzündungen (Gastritis), Magengeschwüren steigt die Magensaftsekretion, der Säuregehalt steigt. 53. Biologische Rolle der p-Elemente der Gruppe VIIA. Die Verwendung ihrer Verbindungen in der Medizin (Brom, Jod) Die Masse von Brom im menschlichen Körper beträgt etwa 7 mg. Es ist hauptsächlich in den endokrinen Drüsen lokalisiert, hauptsächlich in der Hypophyse. Die biologische Rolle von Bromverbindungen für die normale Funktion des Körpers ist noch nicht ausreichend aufgeklärt. Bromverbindungen hemmen die Funktion der Schilddrüse und steigern die Aktivität der Nebennierenrinde. Wenn Bromionen in den Körper eingeführt werden, ist das Zentralnervensystem am empfindlichsten. Bromidionen reichern sich gleichmäßig in verschiedenen Teilen des Gehirns an und wirken beruhigend bei erhöhter Erregbarkeit. Sie tragen zur Wiederherstellung des gestörten Gleichgewichts zwischen Erregungs- und Hemmungsvorgängen bei. Bromidionen werden im Magen-Darm-Trakt leicht resorbiert. Die Toxizität von Bromionen ist gering. Aufgrund der langsamen Ausscheidung aus dem Körper (innerhalb von 30-60 Tagen) können sie sich ansammeln (kumulieren), was zur Entwicklung einer chronischen Vergiftung führt, die als Bromismus bezeichnet wird. Bei Anzeichen einer chronischen Bromvergiftung sollten Bromidpräparate sofort abgesetzt werden. Zusätzlich wird eine große Menge Natriumchlorid verabreicht (bis zu 25 g pro Tag), um die Freisetzungsrate von Bromionen zu erhöhen (Prinzip von Le Chatelier), und es wird ein reichliches Getränk verschrieben. Aufgrund unterschiedlicher individueller Empfindlichkeiten variiert die Dosierung von Brompräparaten von 0,05 bis 2,0 g. Jod gehört zu den essentiellen Nährstoffen und seine Verbindungen spielen eine wichtige Rolle bei Stoffwechselprozessen. Jod beeinflusst die Synthese bestimmter Proteine, Fette und Hormone. Der menschliche Körper enthält etwa 25 mg Jod. Mehr als die Hälfte der gesamten Jodmenge im Körper befindet sich in der Schilddrüse. Fast das gesamte in dieser Drüse enthaltene Jod liegt in gebundenem Zustand (in Form von Hormonen) vor und nur etwa 1 % davon liegt in Form von Jodidion vor. Die Schilddrüse ist in der Lage, I im Vergleich zu seinem Plasmagehalt um das 25-fache zu konzentrieren. Die Schilddrüse schüttet die Hormone Thyroxin und Trijodthyronin aus. Eine Unterfunktion der Schilddrüse (Hypothyreose) kann mit einer Abnahme ihrer Fähigkeit zur Akkumulation von Jodidionen sowie mit einem Mangel an Jod in der Nahrung (endemischer Kropf) einhergehen. Bei endemischem Kropf werden Jodpräparate verordnet: (Kaliumjodid KI oder Natriumjodid NaI) in Dosen, die dem täglichen Jodbedarf des Menschen (0,001 g Kaliumjodid) entsprechen. In Gebieten mit Jodmangel wird Kochsalz NaI oder K zugesetzt, um endemische Kropfbildung zu verhindern! (1-2,5 g pro 100 kg). Bei erhöhter Aktivität der Schilddrüse (Hyperthyreose) wird aufgrund einer übermäßigen Synthese von Schilddrüsenhormonen eine abnormal erhöhte Rate von Stoffwechselprozessen beobachtet. Bei der Unwirksamkeit dieser Medikamente zur Behandlung von Hyperthyreose wird ein Präparat aus radioaktivem Jod 131 I verwendet, dessen Strahlung die Follikel der Schilddrüse zerstört und dadurch die übermäßige Hormonsynthese reduziert. Alle Elemente der Gruppe VIIA sind physiologisch aktiv, und Chlor und Jod sind für die lebenswichtige Aktivität des Organismus unentbehrlich. Fluor gilt als ein Element, das für das normale Funktionieren lebender Organismen notwendig ist. Im Körper sind Halogene austauschbar, wobei Fälle von Synergie und Antagonismus beobachtet werden. 54. Aerosole Aerosole sind dispergierte Systeme mit einem gasförmigen Dispersionsmedium. Je nach Aggregatzustand der dispergierten Phase werden Nebel unterschieden – Aerosole mit flüssiger dispergierter Phase; Dämpfe, Staub – Aerosole mit einer festen dispergierten Phase; Smog – Aerosole mit einer gemischten dispergierten Phase. Die Partikelgrößen der dispersen Phase von Aerosolen liegen gemäß der Klassifizierung disperser Systeme zwischen 10 und XNUMX7 um 109 m Wie andere disperse Systeme werden Aerosole durch zwei Methoden erhalten: Kondensation und Dispersion. Kondensationsmethode Die dispergierte Phase wird aus der Dampfphase durch den physikalischen Prozess der Kondensation von Molekülen zu Partikeln kolloidaler Größe erhalten. Dispersionsmethoden Teilchen kolloidaler Größe werden durch Mahlen größerer Aggregate erhalten. Aerosole haben die Fähigkeit, Licht zu streuen. Partikel der dispergierten Phase von Aerosolen haben keine doppelte elektrische Schicht, Partikel der dispergierten Phase tragen jedoch sehr oft eine elektrische Ladung. Die Ladung entsteht durch Reibung oder durch Adsorption von Gasionen. Es ist zu beachten, dass Aerosolpartikel (kleine und große) sehr oft eine Ladung mit entgegengesetztem Vorzeichen tragen. Die Trennung von Partikeln nach Größe in großen Aerosolvolumina nach Höhe kann zur Entstehung eines elektrischen Feldes hoher Intensität führen. So entsteht in den Wolken eine elektrische Entladung – ein Blitz. Aerosole sind kinetisch und aggregativ instabile Systeme, da an der Phasengrenze keine doppelte elektrische Schicht vorhanden ist. Daher koagulieren Aerosole schneller als Lyosole. In der Medizin werden Aerosole in der Inhalationstherapie, zum Schutz geschädigter Haut, zur Desinfektion eingesetzt. Manchmal ist die Bildung von Aerosolen äußerst unerwünscht. Gesundheitsgefährdende Aerosole entstehen in Gießereien, Keramikbetrieben sowie bei der Gewinnung und Verarbeitung verschiedener Mineralien (Erz, Kohle, Asbest etc.). Aerosole, die Kohlepartikel enthalten, verursachen Lungenerkrankungen – Anthrakose, Silizium(IV)-oxid – Silikose, Asbest – Asbestose. Allergische Erkrankungen werden durch Aerosole verursacht, die durch Pflanzenpollen und Staub entstehen, der bei der Verarbeitung von Baumwolle, Flachs, Hanf usw. entsteht. Suspensionen von Bakterien, Schimmelpilzen und Viren – mikrobiologische oder bakterielle Aerosole – sind einer der Übertragungswege von Infektionskrankheiten: Lungenkrankheiten Tuberkulose, Grippe, akute Atemwegserkrankungen. Bei der Kraftstoffverbrennung entstehende Aerosole, deren dispergierte Phase aus Ruß, Harzen, Asche und krebserregenden Kohlenwasserstoffen besteht, wirken sich schädlich auf den menschlichen Körper aus. Smog ist besonders gesundheitsgefährdend. Daher wird der Kampf gegen Staub und Luftverschmutzung immer wichtiger. Die Luftreinigung von Aerosolen wird durch die Einführung abfallfreier Technologien erreicht – das Auffangen von Partikeln der dispergierten Phase mithilfe von Filtern, Zyklonen (Zentrifugalstaubabscheidern) und einem elektrischen Hochspannungsfeld. 55. Emulsionen Emulsionen sind mikroheterogene Systeme, bei denen die dispergierte Phase und das Dispersionsmedium nicht mischbare Flüssigkeiten sind. Die Partikelgrößen der dispergierten Phase – Flüssigkeitströpfchen – reichen von 104 bis 106 µm. Je nach Konzentration der dispergierten Phase unterscheidet man Emulsionen: verdünnt, konzentriert und hochkonzentriert. Je nach Art der dispergierten Phase und des Dispergiermediums gibt es: 1) Emulsionen einer unpolaren Flüssigkeit (DF) in einer polaren Flüssigkeit (DS) – direkte Emulsionen, sogenannte Emulsionen der ersten Art oder Emulsionen vom „Öl/Wasser“-Typ (O/W); 2) Emulsionen einer polaren Flüssigkeit (DF) in einer unpolaren (DS) – inverse Emulsionen, sogenannte Emulsionen zweiter Art oder Emulsionen vom „Wasser/Öl“-Typ (W/O). Hier sind DF und DS die dispergierte Phase bzw. das Dispersionsmedium, „Wasser“ ist jede polare Flüssigkeit, „Öl“ ist unpolar. Emulsionstyp einstellbar: 1) Messung der elektrischen Leitfähigkeit; 2) Mischen mit einem Überschuss einer polaren oder unpolaren Flüssigkeit; 3) Färbung mit wasserlöslichen oder öllöslichen Farbstoffen; 4) durch Benetzen und Verteilen eines Emulsionstropfens auf einer hydrophoben oder hydrophilen Oberfläche. Emulsionen können wie andere disperse Systeme sein erhalten durch Kondensations- und Dispersionsverfahren. Emulsionen als grobe Dispersionen sind kinetisch und aggregativ instabile Systeme. Wenn Tröpfchen der dispergierten Phase zusammenstoßen, verschmelzen sie (Koaleszenz). Als Ergebnis der Koaleszenz trennt sich die Emulsion in zwei zusammenhängende flüssige Phasen. Um die Stabilität von Emulsionen zu erhöhen, werden Stabilisatoren – Emulgatoren – eingesetzt. Hierbei handelt es sich um Tenside, die durch Adsorption an der Grenzfläche die Grenzflächenspannung verringern und einen mechanisch festen Adsorptionsfilm bilden. Handelt es sich bei dem Emulgator um ein ionisches Tensid, so verleiht er den Tröpfchen der dispergierten Phase eine elektrische Ladung gleichen Vorzeichens und die Tröpfchen stoßen sich ab. Die Art der gebildeten Emulsion hängt von den Eigenschaften des Emulgators ab. Das Dispergiermedium ist immer die Flüssigkeit, die den Emulgator am besten löst bzw. benetzt. Als Emulgatoren werden Salze höherer Fettsäuren, Ester höherer Fettsäuren und mehrwertiger Alkohole, langkettige Amine verwendet. Emulsionen sind in der Natur weit verbreitet. Emulsionen sind Milch, Sahne, Sauerrahm, Butter, Eigelb, milchiger Pflanzensaft, Rohöl. In der Medizin werden häufig Emulsionen verwendet, die Heilstoffe enthalten: der erste Typ (O/W) zur inneren Anwendung, der zweite Typ (W/O) zur äußerlichen Anwendung. Es ist bekannt, dass pflanzliche und tierische Fette in emulgierter Form (Milch) besser vom Körper aufgenommen werden. Als Emulgatoren wirken dabei Derivate der Chol- und Desoxycholsäure. Manchmal besteht die Notwendigkeit, die resultierende Emulsion zu zerstören. Das Aufbrechen der Emulsion wird Demulgierung genannt. Die Demulgierung erfolgt durch Temperaturerhöhung und -senkung, Einwirkung eines elektrischen Feldes, Zentrifugation und Zugabe von Elektrolyten und speziellen Substanzen – Demulgatoren. Demulgatoren sind Tenside mit größerer Oberflächenaktivität als Emulgatoren, besitzen jedoch nicht die Fähigkeit, eine mechanisch starke Adsorptionsschicht zu bilden. 56. Kolloidale Tenside Kolloidale Tenside sind Substanzen, die mit dem gleichen Lösungsmittel je nach Bedingungen eine echte und kolloidale Lösung bilden. Wie bereits erwähnt, sind Tensidmoleküle amphiphil. Sie bestehen aus unpolaren und polaren Gruppen. Unpolare Radikale, beispielsweise Kohlenwasserstoffketten, haben keine Affinität zum polaren Lösungsmittel Wasser; für polare Gruppen ist sie recht hoch. Es gibt eine hydrophobe (Van-der-Waals-)Wechselwirkung zwischen unpolaren Gruppen. Mit einer Kettenlänge von ca. 1022 Kohlenstoffatome aufgrund hydrophober Wechselwirkungen von Kohlenwasserstoffradikalen und starker Wechselwirkung polarer Gruppen mit Wasser werden Tensidmoleküle assoziiert und Micellen gebildet. Die Mindestkonzentration eines kolloidalen Tensids, ab der sich Micellen in seiner Lösung bilden, wird als kritische Micellenkonzentration (CMC) bezeichnet. Die Form der resultierenden Micellen hängt von der Konzentration der Lösung ab. Bei niedrigen Konzentrationen an kolloidalem Tensid werden kugelförmige Micellen gebildet. Eine Erhöhung der Konzentration einer kolloidalen Tensidlösung führt zunächst zu einer Erhöhung ihrer Anzahl und dann zu einer Formänderung. Bei höheren Konzentrationen werden statt kugelförmiger Micellen zylindrische und lamellare Micellen gebildet. Der CMC-Wert hängt von verschiedenen Faktoren ab: der Art des kolloidalen Tensids, der Temperatur und dem Vorhandensein von Verunreinigungen durch Fremdstoffe, insbesondere Elektrolyte. CMC kann durch die Eigenschaften der Lösung bestimmt werden, abhängig von der Anzahl und Größe der kinetisch aktiven Partikel, insbesondere durch Änderungen des osmotischen Drucks, der Oberflächenspannung, der elektrischen Leitfähigkeit und der optischen Eigenschaften. Da sich während des Übergangs „echte Lösung – kolloidale Lösung“ die Größe der kinetisch aktiven Partikel (Ionen, Moleküle, Mizellen) und ihre Anzahl ändern, erscheint im Diagramm „Eigenschaft – Konzentration“ ein der CMC entsprechender Wendepunkt. Eine der wichtigsten Eigenschaften kolloidaler Tensidlösungen, aufgrund derer sie in verschiedenen Bereichen der Volkswirtschaft und in der Medizin weit verbreitet sind, ist die Solubilisierung. Der Mechanismus der Solubilisierung besteht in der Auflösung unpolarer Substanzen im hydrophoben Kern von Micellen. Das Phänomen der Solubilisierung wird in verschiedenen Bereichen der Volkswirtschaft häufig genutzt: in der Lebensmittelindustrie, in der pharmazeutischen Industrie (zur Gewinnung flüssiger Formen von Arzneimitteln). Im Wasser-Phospholipid-System bilden sich durch Schütteln und Rühren kugelförmige Mizellen – Liposomen. Phospholipidmoleküle bilden in Liposomen eine Doppelschichtmembran, in der polare Gruppen dem Wasser und unpolare Gruppen einander zugewandt sind. Liposomen können als Modell biologischer Membranen betrachtet werden. Mit ihrer Hilfe ist es möglich, die Permeabilität von Membranen und den Einfluss verschiedener Faktoren darauf für verschiedene Verbindungen zu untersuchen. Liposomen werden weit verbreitet für die gezielte Verabreichung von Arzneimitteln an bestimmte Organe oder betroffene Bereiche verwendet. Liposomen können Medikamente in Zellen transportieren. Liposomale Membranen werden in immunologischen Studien verwendet, um die Wechselwirkung zwischen Antikörpern und Antigenen zu untersuchen. Autoren: Drozdova M.V., Drozdov
▪ Religionsgeschichte. Vorlesungsnotizen
Alkoholgehalt von warmem Bier
07.05.2024 Hauptrisikofaktor für Spielsucht
07.05.2024 Verkehrslärm verzögert das Wachstum der Küken
06.05.2024
▪ Abschnitt der Website Unterhaltungselektronik. Artikelauswahl ▪ Niemand schreibt einen Artikel an den Colonel. Populärer Ausdruck ▪ Artikel Wie erwirbt ein Coca-Cola-Hersteller Coca-Blatt-Extrakt? Ausführliche Antwort ▪ Artikel Snowcards für Sport und Freizeit. Persönlicher Transport ▪ Artikel Installation von Lasereffekten. Enzyklopädie der Funkelektronik und Elektrotechnik
Startseite | Bibliothek | Artikel | Sitemap | Site-Überprüfungen www.diagramm.com.ua |






 Arabic
Arabic Bengali
Bengali Chinese
Chinese English
English French
French German
German Hebrew
Hebrew Hindi
Hindi Italian
Italian Japanese
Japanese Korean
Korean Malay
Malay Polish
Polish Portuguese
Portuguese Spanish
Spanish Turkish
Turkish Ukrainian
Ukrainian Vietnamese
Vietnamese

 Siehe andere Artikel Abschnitt
Siehe andere Artikel Abschnitt 