
|
Vorlesungsunterlagen, Spickzettel
Krankenhaustherapie. Vorlesungsskript: kurz das Wichtigste
Verzeichnis / Vorlesungsunterlagen, Spickzettel Inhaltsverzeichnis
VORTRAG Nr. 1. Erkrankungen des Herz-Kreislauf-Systems. Rheuma Rheumatismus (Sokolsky-Buyo-Krankheit) ist eine systemische entzündliche Erkrankung des Bindegewebes mit überwiegender Lokalisation des Prozesses im Herz-Kreislauf-System, die sich bei dafür prädisponierten Personen (in der Regel sind dies junge Menschen) aufgrund einer akuten Infektion mit entwickelt β-hämolytische Streptokokken der Gruppe A. Diese Definition der Krankheit wurde 1989 von V. A. Nasonov gegeben. Es spiegelt alle charakteristischen Merkmale der Krankheit wider: 1) vorherrschende Schädigung des Herz-Kreislauf-Systems; 2) die Rolle der pathologischen Vererbung; 3) die Bedeutung einer Streptokokkeninfektion. Das Wesen der Krankheit liegt in der Niederlage aller Herzmembranen, vor allem aber des Myokards und des Endokards, mit dem Auftreten einer Deformation des Herzklappenapparats - Herzerkrankungen und der anschließenden Entwicklung einer Herzinsuffizienz. Die Schädigung anderer Organe und Systeme bei Rheumatismus ist von untergeordneter Bedeutung und bestimmt nicht den Schweregrad und die spätere Prognose. Ätiologie. Beta-hämolytische Streptokokken der Gruppe A verursachen Schäden an den oberen Atemwegen. Aus diesem Grund gehen dem Auftreten von Rheuma in der Regel Halsschmerzen, eine Verschlimmerung einer chronischen Mandelentzündung sowie eine erhöhte Menge an Streptokokken-Antigenen und Antistreptokokken-Antikörpern (ASL-O, ASG, ASA, Antidesoxyribonuklease B (Anti-DNase) voraus B)) werden im Blut der Erkrankten nachgewiesen. Ein solcher Zusammenhang mit einer vorangegangenen Streptokokken-Infektion ist besonders ausgeprägt im akuten Rheumaverlauf mit begleitender Polyarthritis. Bei der Entstehung von Rheuma spielen Alter und soziale Faktoren eine Rolle (ungünstige Lebensbedingungen, Mangelernährung), auch eine genetische Veranlagung (Rheuma ist eine polygene Erbkrankheit, die Existenz „rheumatischer“ Familien ist bekannt), die darin besteht, a Hyperimmunantwort auf Streptococcus-Antigene, die Neigung von Patienten zu Autoimmun- und Immunkomplexprozessen. Pathogenese. Bei Rheuma kommt es zu einer komplexen und vielfältigen Immunantwort (sofortige und verzögerte Überempfindlichkeitsreaktionen) auf zahlreiche Streptokokken-Antigene. Wenn eine Infektion in den Körper eindringt, werden Anti-Streptokokken-Antikörper produziert und Immunkomplexe gebildet (Streptokokken-Antigene + Antikörper dagegen + Komplement), die im Blut zirkulieren und sich im Mikrozirkulationsbett ansiedeln. Streptokokken-Toxine und Enzyme wirken sich zudem schädigend auf den Herzmuskel und das Bindegewebe aus. Aufgrund eines genetisch bedingten Defekts im Immunsystem werden Streptokokken-Antigene und Immunkomplexe nicht vollständig und schnell aus dem Körper der Patienten eliminiert. Das Gewebe solcher Patienten neigt verstärkt dazu, diese Immunkomplexe zu fixieren. Dabei spielen auch kreuzreagierende Antikörper eine Rolle, die durch Bildung auf Streptokokken-Antigenen mit Gewebe-, auch Herz-, Körperantigenen reagieren können. Als Reaktion darauf entwickelt sich eine Entzündung auf einer Immunbasis (entsprechend der Art der unmittelbaren Überempfindlichkeit), während die Faktoren, die den Entzündungsprozess implementieren, lysosomale Enzyme von Neutrophilen sind, die Immunkomplexe phagozytieren und gleichzeitig zerstört werden. Dieser Entzündungsprozess ist im Bindegewebe, vorwiegend des kardiovaskulären Systems, lokalisiert und verändert dessen antigene Eigenschaften und das Myokard. Als Ergebnis entwickeln sich Autoimmunprozesse entsprechend der Art der Überempfindlichkeit vom verzögerten Typ, und Lymphozyten, die mit Herzgewebe reagieren, werden im Blut von Patienten gefunden. Diese Zellen sind von großer Bedeutung bei der Entstehung von Organläsionen (hauptsächlich des Herzens). Im Bindegewebe mit Rheuma treten Phasenänderungen auf: Schleimhautschwellung - fibrinoide Veränderungen - fibrinoide Nekrose. Der morphologische Ausdruck von Immunstörungen sind zelluläre Reaktionen - Infiltration durch Lymphozyten und Plasmozyten, die Bildung von rheumatischen oder Ashoff-Talalayevsky-Granulomen. Der pathologische Prozess endet mit Sklerose. Ein weiteres morphologisches Substrat der Herzschädigung bei rheumatischen Herzerkrankungen ist eine unspezifische Entzündungsreaktion ähnlich der in den Gelenken und serösen Häuten: Schwellung des intermuskulären Bindegewebes, Fibrinausschwitzen, Infiltration von Neutrophilen und Lymphozyten. Die Krankheit verläuft in Wellen, die unter dem Einfluss von Infektionen oder unspezifischen Faktoren (Hypothermie, körperlicher Stress, Stress usw.) verschlimmert werden, was mit der Autoimmunnatur des pathologischen Prozesses zusammenhängt. Wenn das Herz betroffen ist, kann sich der Entzündungsprozess auf alle Membranen des Herzens (Pankarditis) oder isoliert auf jede der Membranen ausbreiten. Morphologische Veränderungen bei Rheuma finden sich vor allem im Myokard, so dass die Myokarditis im Frühstadium das Krankheitsbild bestimmt. Entzündliche Veränderungen des Endokards (Valvulitis, verruköse Endokarditis), Schädigungen der Sehnenfilamente und des Faserrings werden 6-8 Wochen nach dem Rheumaanfall klinisch festgestellt. Am häufigsten ist die Mitralklappe betroffen, gefolgt von der Aorten- und der Trikuspidalklappe. Die Pulmonalklappe bei Rheuma ist fast nie betroffen. Klassifikation von Rheuma. Derzeit wurde die 1990 von der All-Union Scientific Society of Rheumatology genehmigte Klassifikation und Nomenklatur von Rheuma übernommen, die die Phase des Prozesses, die klinischen und anatomischen Merkmale der Schädigung von Organen und Systemen sowie die Art des Verlaufs widerspiegelt und der Funktionszustand des Herz-Kreislauf-Systems (siehe Tabelle 1). Klinisches Bild. Alle Manifestationen der Krankheit können in kardiale und extrakardiale unterteilt werden. Aus diesen Positionen lässt sich das Krankheitsbild der Erkrankung beschreiben. Stadium I: Der Zusammenhang der Krankheit mit der übertragenen Infektion wird aufgedeckt. In typischen Fällen steigt die Körpertemperatur 1-2 Wochen nach einer Halsentzündung oder einer akuten Atemwegserkrankung an, manchmal bis auf 38-40 ° C, mit Schwankungen im Laufe des Tages innerhalb von 1-2 ° C und starkem Schweiß (normalerweise ohne Schüttelfrost). Bei wiederholten Rheumaschüben kommt es häufig unter dem Einfluss unspezifischer Faktoren (z. B. Unterkühlung, körperliche Überlastung, Operation) zu einem Wiederauftreten der Erkrankung. Tabelle 1 Klassifikation von Rheuma
Die häufigste Manifestation von Rheuma ist eine Herzschädigung - Rheumatische Herzkrankheit: gleichzeitige Schädigung des Myokards und des Endokards. Bei Erwachsenen ist die rheumatische Herzerkrankung nicht schwerwiegend. Patienten klagen über leichte Schmerzen oder Beschwerden in der Herzgegend, leichte Atemnot bei Belastung, Aussetzer oder Herzklopfen sind deutlich seltener. Diese Symptome sind nicht spezifisch für eine rheumatische Herzerkrankung und können bei anderen Herzerkrankungen auftreten. Die Art solcher Beschwerden wird in den nachfolgenden Phasen der diagnostischen Suche angegeben. Rheumokarditis bei jungen Patienten ist in der Regel schwerwiegend: Von Beginn der Erkrankung an werden schwere Atemnot während des Trainings und in Ruhe, ständige Schmerzen im Herzen und Herzklopfen festgestellt. Es können Symptome eines Kreislaufversagens in einem großen Kreis in Form von Ödemen und Schweregefühl im rechten Hypochondrium (aufgrund einer Lebervergrößerung) auftreten. Alle diese Symptome weisen auf eine schwere diffuse Myokarditis hin. Perikarditis sowie extrakardiale Manifestationen von Rheuma sind selten. Mit der Entwicklung einer trockenen Perikarditis bemerken die Patienten nur ständige Schmerzen im Bereich des Herzens. Bei der exsudativen Perikarditis, die durch die Ansammlung von serös-fibrinösem Exsudat im Herzsack gekennzeichnet ist, verschwindet der Schmerz, da die entzündeten Perikardschichten durch das sich ansammelnde Exsudat getrennt werden. Es tritt Kurzatmigkeit auf, die mit der horizontalen Position des Patienten zunimmt. Aufgrund der Schwierigkeit des Blutflusses zum rechten Herzen tritt in einem großen Kreis eine Stauung auf (Ödem, Schweregefühl im rechten Hypochondrium aufgrund einer Lebervergrößerung). Das charakteristischste Rheuma ist die Niederlage des Bewegungsapparates in Form von rheumatischer Polyarthritis. Die Patienten bemerken schnell zunehmende Schmerzen in großen Gelenken (Knie, Ellbogen, Schulter, Knöchel, Handgelenk), die Unmöglichkeit aktiver Bewegungen, eine Zunahme des Gelenkvolumens. Nach Anwendung von Acetylsalicylsäure und anderen nichtsteroidalen Antirheumatika tritt eine rasche Wirkung mit mehrtägiger, oft mehrstündiger Linderung aller Gelenkmanifestationen ein. Rheumatische Läsionen der Nieren sind ebenfalls äußerst selten und werden nur bei der Untersuchung von Urin festgestellt. Läsionen des Nervensystems bei Rheuma sind selten, hauptsächlich bei Kindern. Die Beschwerden ähneln denen von Enzephalitis, Meningoenzephalitis, zerebraler Vaskulitis einer anderen Ätiologie. Nur "kleine Chorea" verdient Aufmerksamkeit, die bei Kindern (häufiger Mädchen) auftritt und sich in einer Kombination aus emotionaler Labilität und heftiger Hyperkinese des Rumpfes, der Gliedmaßen und der mimischen Muskulatur manifestiert. Das abdominale Syndrom (Peritonitis) tritt fast ausschließlich bei Kindern und Jugendlichen mit akutem primärem Rheumatismus auf. Sie ist gekennzeichnet durch plötzliches Einsetzen, Fieber und Anzeichen von Dysphagie (diffuse oder lokalisierte krampfartige Schmerzen, Übelkeit, Erbrechen, Retention oder häufiger Stuhlgang). Im Stadium II der diagnostischen Suche ist der Nachweis von Anzeichen einer Herzschädigung von geringer Bedeutung. Bei der primären rheumatischen Herzerkrankung ist das Herz in der Regel nicht vergrößert. Die Auskultation zeigt einen gedämpften I-Ton, manchmal das Auftreten eines III-Tons, ein leises systolisches Geräusch an der Spitze. Diese Symptome sind auf Veränderungen im Myokard zurückzuführen. Eine Zunahme der Intensität, Dauer und Persistenz des Geräusches kann jedoch auf die Entstehung einer Mitralklappeninsuffizienz hinweisen. Es ist möglich, die Defektbildung 6 Monate nach Beginn des Anfalls sicher zu beurteilen, während das obige auskultatorische Bild beibehalten wird. Bei Schäden an der Aortenklappe kann ein protodiastolisches Geräusch am Botkin-Punkt zu hören sein und die Klangfülle des II-Tons erhalten bleiben. Erst viele Jahre später, nach der Entstehung einer schweren Aortenklappeninsuffizienz, gesellt sich zu diesem auskultatorischen Zeichen eine Abschwächung (oder Abwesenheit) des II. Tonus im II. Interkostalraum rechts. Bei Patienten mit Polyarthritis wird eine Gelenkdeformität aufgrund einer Entzündung der Synovialmembran und des periartikulären Gewebes sowie Schmerzen beim Abtasten des Gelenks festgestellt. Im Bereich der betroffenen Gelenke können Rheumaknoten auftreten, die sich an den Unterarmen und Schienbeinen oberhalb der Knochenvorsprünge befinden. Dies sind kleine, dichte, schmerzlose Formationen, die unter dem Einfluss der Behandlung verschwinden. Erythema anulare (ein fast pathognomonisches Zeichen für Rheuma) sind rosafarbene, ringförmige Elemente, die nicht jucken und sich auf der Haut der Innenfläche von Armen und Beinen, Bauch, Hals und Rumpf befinden. Dieses Symptom ist extrem selten (bei 1-2 % der Patienten). Rheumatische Lungenentzündung und Pleuritis haben die gleichen körperlichen Anzeichen wie ähnliche Krankheiten banaler Ätiologie. Im Allgemeinen werden derzeit nicht-kardiale Läsionen bei jungen Menschen mit akutem Rheumaverlauf (bei hoher Aktivität - Grad III) äußerst selten beobachtet. Sie sind unscharf exprimiert und können sich während der antirheumatischen Therapie schnell umkehren. In der III. Phase der diagnostischen Suche ermöglichen uns die Daten von Labor- und Instrumentenstudien, die Aktivität des pathologischen Prozesses festzustellen und die Schädigung des Herzens und anderer Organe zu klären. Bei einem aktiven rheumatischen Prozess zeigen Laboruntersuchungen eine unspezifische Akutphase und veränderte immunologische Parameter. Akute Phase-Indikatoren: Neutrophilie mit einer Verschiebung der Leukozyten-Blutformel nach links; eine Erhöhung des Gehalts an 2-Globulinen, gefolgt von einer Erhöhung des Gehalts an - Globulinen; Erhöhung des Fibrinogengehalts; das Auftreten von C-reaktivem Protein; ESR steigt. Bei immunologischen Parametern steigen die Titer der Anti-Streptokokken-Antikörper (Anti-Hyaluronidase und Anti-Streptokinase über 1: 300, Anti-O-Streptolysin über 1: 250). Das EKG zeigt manchmal Rhythmus- und Leitungsstörungen: vorübergehende atrioventrikuläre Blockade (häufiger I-Grad - Verlängerung des P-Q-Intervalls, seltener - II-Grad), Extrasystole, atrioventrikulärer Rhythmus. Bei einer Reihe von Patienten wird eine Abnahme der Amplitude der T-Welle bis zum Auftreten negativer Zähne festgestellt. Diese Rhythmus- und Erregungsleitungsstörungen sind instabil und verschwinden im Laufe der antirheumatischen Therapie schnell wieder. Sind die Veränderungen im EKG hartnäckig und bleiben nach Beseitigung eines rheumatischen Anfalls bestehen, dann sollte man an eine organische Schädigung des Myokards denken. Während der phonokardiographischen Untersuchung werden Auskultationsdaten angegeben: Abschwächung des XNUMX. Tons, Auftreten des XNUMX. Tons, systolisches Geräusch. Im Falle der Entstehung einer Herzerkrankung treten Veränderungen auf dem PCG auf, die der Art der Klappenläsion entsprechen. Röntgen beim ersten Rheumaanfall, es werden keine Veränderungen festgestellt. Lediglich bei schweren rheumatischen Herzerkrankungen bei Kindern und Jugendlichen lässt sich aufgrund einer Erweiterung der linken Herzkammer eine Herzvergrößerung feststellen. Bei der Entwicklung einer rheumatischen Herzerkrankung vor dem Hintergrund einer bestehenden Herzerkrankung wird das Röntgenbild einem bestimmten Defekt entsprechen. Eine echokardiographische Untersuchung bei primärer rheumatischer Herzerkrankung zeigt keine charakteristischen Veränderungen. Nur bei schweren rheumatischen Herzerkrankungen mit Anzeichen einer Herzinsuffizienz im Echokardiogramm zeigen sich Anzeichen, die auf eine Abnahme der kontraktilen Funktion des Myokards und eine Erweiterung der Herzhöhlen hinweisen. Diagnostik. Die Erkennung von primärem Rheuma ist sehr schwierig, da seine häufigsten Erscheinungsformen, wie Polyarthritis und Herzschäden, unspezifisch sind. Derzeit werden am häufigsten die Haupt- und Nebenkriterien für Rheuma der American Heart Association verwendet. Die Kombination von zwei Hauptkriterien oder einem Hauptkriterium und zwei Nebenkriterien weist nur bei einer vorangegangenen Streptokokkeninfektion auf eine höhere Rheumawahrscheinlichkeit hin. Mit dem allmählichen Auftreten von Rheuma ist die von A. I. Nesterov 1973 vorgeschlagene syndromale Diagnose (siehe Tabelle 2) von Bedeutung: klinisches und epidemiologisches Syndrom (Verbindung mit Streptokokkeninfektion); klinisches und immunologisches Syndrom (Anzeichen unvollständiger Genesung, Arthralgie, erhöhte Titer von Antistreptokokken-Antikörpern sowie Nachweis von Dysproteinämie und Indikatoren der akuten Phase); kardiovaskuläres Syndrom (Nachweis einer Karditis sowie extrakardialer Läsionen) (siehe Tabelle 3). Tabelle 2 Kriterien für Rheuma
Tabelle 3 Grade von Rheuma
Differenzialdiagnose. Die rheumatische Polyarthritis muss von der nicht-rheumatischen abgegrenzt werden (siehe Tabelle 4). Tabelle 4 Rheumatische und nichtrheumatische Polyarthritis
Folgende Erkrankungen und Symptome sind im Zusammenhang mit Rheuma verdächtig: 1) Endokarditis; 2) Myokarditis; 3) Perikarditis; 4) Herzfehler; 5) Rhythmus- und Leitungsstörungen; 6) akutes und chronisches Herzversagen; 7) verlängerter subfebriler Zustand; 8) Erythema nodosum; 9) ringförmiges Erythem; 10) subkutane Knötchen; 11) akute allergische Polyarthritis; 12) Chorea. Keines der oben aufgeführten klinischen Syndrome ist spezifisch für diese Krankheit. Erst die Kombination einer Herzpathologie mit mindestens einem extrakardialen Rheumahauptsymptom gibt Anlass zu einem Rheumaverdacht. Die Erkennung der rheumatischen Herzkrankheit selbst erfolgt anhand von Symptomen wie Atemnot und Herzrasen, Müdigkeit, Schmerzen in der Herzgegend und Herzrhythmusstörungen, Geräuschen, manchmal Galopprhythmus und Abschwächung des I-Tons. Von großer Bedeutung bei der Diagnose von rheumatischen Herzerkrankungen ist die Identifizierung der Pathologie im EKG. Bei Rheuma wird es durch Myokarditis, Perikarditis und Herzfehler verursacht. Die dynamische Beobachtung ermöglicht es, irreversible Veränderungen, die für eine Hypertrophie verschiedener Teile des Herzens bei Defekten charakteristisch sind, von vorübergehenden zu unterscheiden, die auf den aktuellen Entzündungsprozess hinweisen. Behandlung. Eine positive Wirkung bei der Behandlung sowie die Vorbeugung der Entstehung von Herzerkrankungen wird durch eine frühzeitige Diagnose und individuelle Behandlung ermöglicht, die auf einer Beurteilung der Art des Verlaufs, der Aktivität des pathologischen Prozesses, der Schwere der Karditis, und die Variante der Herzklappenerkrankung. Wichtig sind der Zustand des Myokards, anderer Gewebe und Organe, der Beruf des Patienten usw. Somit besteht der gesamte Komplex der Behandlung von Rheuma aus einer antimikrobiellen und entzündungshemmenden Therapie, Maßnahmen, die auf die Wiederherstellung der immunologischen Homöostase abzielen. Es wird empfohlen, eine rationale, ausgewogene Ernährung zu verwenden, sich auf die Anpassung an körperliche Aktivität, die Vorbereitung auf die Arbeit und die rechtzeitige chirurgische Behandlung von Patienten mit komplexen Herzfehlern zu konzentrieren. Allen Patienten während der aktiven Phase des Rheumatismus wird Penicillin (1-200 IE für 000 Dosen pro Tag alle 1 Stunden) gezeigt, das eine bakterizide Wirkung auf alle Arten von A-Streptokokken hat. Der Behandlungsverlauf beträgt 500 Wochen während der aktiven Rheumaphase, in Zukunft ist eine Umstellung auf das verlängerte Medikament Bicillin-000 (6 Einheiten) erforderlich. Bei Penicillin-Unverträglichkeit kann Erythromycin 4 mg 2-mal täglich verschrieben werden. Medikamente mit entzündungshemmender Wirkung, die in der modernen Behandlung der aktiven Phase von Rheuma eingesetzt werden, sind Glucocorticosteroide, Salicylsäure, Indolderivate, Derivate der Phenylessigsäure usw. Prednisolon wird mit 20-30 mg pro Tag (für 2 Wochen, dann wird die Dosis alle 2,5-5 Tage um 5-7 mg reduziert, insgesamt für einen Zeitraum von 1,5-2 Monaten) für primäre und rezidivierende mit III und II verwendet grad Aktivität des Prozesses der rheumatischen Herzkrankheit, mit Polyserositis und Chorea, mit der Entwicklung von Herzversagen aufgrund aktiver Karditis. Im letzteren Fall wird Triamcinolon in einer Dosis von 12-16 mg pro Tag bevorzugt, da es das Elektrolytgleichgewicht kaum stört. Corticoid-Mittel beeinflussen den Wasser-Salz-Stoffwechsel, daher sollten Kaliumchlorid 3-4 g / Tag, Panangin und andere bei der Behandlung mit Flüssigkeitsretention verwendet werden - Aldosteron-Antagonisten (Veroshpiron bis zu 6-8 Tabletten pro Tag), Diuretika (Lasix 40-80 mg / Tag, Furosemid 40-80 mg / Tag usw.), mit Euphorie - Beruhigungsmitteln usw. Nichtsteroidale Antiphlogistika werden auch häufig bei Rheuma eingesetzt: Die durchschnittliche Dosis von Acetylsalicylsäure beträgt 3-4 g pro Tag, seltener 5 g pro Tag oder mehr. Indikationen für die Verwendung von Salicylaten: 1) minimale Aktivität, leichte Karditis, hauptsächlich Myokarditis; 2) Langzeitbehandlung von Rheuma, Verdacht auf latenten Verlauf; 3) längere Behandlung mit einer Abnahme der Aktivität im Verlauf des Prozesses und der Beendigung der Anwendung von Kortikosteroiden sowie nach Abschluss der Behandlung in einem Krankenhaus; 4) rezidivierende rheumatische Herzerkrankungen, die vor dem Hintergrund schwerer Herzfehler und Kreislaufversagen auftreten, da Salicylate keine Flüssigkeit zurückhalten können, die Bildung von Blutgerinnseln verhindern und Stimulanzien des Atmungszentrums sind; 5) Verringerung der Wahrscheinlichkeit einer Exazerbation von Rheuma im Frühjahr und Herbst sowie nach interkurrenten Infektionen (zusammen mit Antibiotika). Acetylsalicylsäure wird 1 g 3-4 mal täglich nach den Mahlzeiten für 1-3 Monate oder länger bei normaler Verträglichkeit und vorbehaltlich der Kontrolle von Nebenwirkungen verwendet. Die erfolgreiche Anwendung des Indolessigsäure-Derivats - Indomethacin bei Rheuma seit mehr als 20 Jahren. Es hat eine ausgeprägte therapeutische Wirkung: Subjektive Symptome einer Karditis (Herzschmerzen, Herzklopfen, Atemnot) verschwinden am 8.-10. Tag der Therapie und objektive Anzeichen - am 14.-16. Tag. Das Verschwinden von Polyarthritis und Polyserositis erfolgt noch schneller. Bei der Behandlung von Rheuma ist eine Kombination aus drei Hauptstadien wichtig: Krankenhaus – Klinik – Kurort. Im Krankenhaus erfolgt die Behandlung mit den oben aufgeführten Medikamenten. Nach der Verringerung der Rheumaaktivität und der Normalisierung des Zustands des Patienten werden sie in ein rheumatologisches Sanatorium in die Stufe II überführt. Das Hauptziel dieser Phase ist die Fortsetzung der Behandlung mit nichtsteroidalen entzündungshemmenden Medikamenten, die im Krankenhaus individuell ausgewählt werden, Aminochinolin-Derivate, Bicillin-5, Rehabilitation. Stadium III umfasst die Beobachtung in der Apotheke und die vorbeugende Behandlung. Dies ist die Durchführung therapeutischer Maßnahmen zur endgültigen Beseitigung des aktiven Verlaufs des rheumatischen Prozesses; Durchführung einer symptomatischen Behandlung von Durchblutungsstörungen bei Patienten mit Herzerkrankungen; Lösung von Fragen der Rehabilitation, Arbeitsfähigkeit und Beschäftigung; Umsetzung der Primärprävention von Rheuma und Sekundärprävention des Wiederauftretens der Krankheit. VORTRAG Nr. 2. Erkrankungen des Herz-Kreislauf-Systems. Kardiomyopathie. Dilatative Kardiomyopathie 1. Kardiomyopathie Kardiomyopathie - primäre isolierte Myokardläsionen nicht entzündlicher Natur unbekannter Ätiologie (idiopathisch), die nicht mit Herzklappenfehlern oder intrakardialen Shunts, arterieller oder pulmonaler Hypertonie, koronarer Herzkrankheit oder systemischen Erkrankungen (wie z. B.: Kollagenosen, Amyloidose, Hämochromatose, etc.) und im Endstadium der Erkrankung entwickeln sich eine schwere dekompensierte Herzinsuffizienz und komplexe Störungen des Herzrhythmus und der Durchgängigkeit. Die Klassifikation der Kardiomyopathien ist wie folgt: 1) dilatative Kardiomyopathie: a) idiopathisch; b) giftig; c) ansteckend; d) mit Kollagenosen; 2) hypertroph; 3) restriktiv; 4) arrhythmische Dysplasie des rechten Ventrikels; 5) eine Kombination einer der 4 Arten von Kardiomyopathien mit arterieller Hypertonie. 2. Dilatative Kardiomyopathie Die dilatative Kardiomyopathie (DCM) ist eine Erkrankung des Herzmuskels, die durch eine diffuse Erweiterung aller Herzkammern (hauptsächlich des linken Ventrikels) gekennzeichnet ist, bei der die Pathologie der Pumpfunktion des Herzens im Vordergrund steht und als Folge davon , chronische Herzinsuffizienz (daher der zweite Name kongestiv, wenn das Herz das Blut nicht vollständig pumpen kann und es in den Geweben und Organen des Körpers "stagniert"). Die Muskelwand des Herzens bleibt entweder unverändert oder in unterschiedlichem Maße hypertrophiert. Krankheiten und Faktoren, die der Entwicklung von DCM vorausgingen, sind in der nachstehenden Tabelle beschrieben (siehe Tabelle 5). Tabelle 5 Krankheiten und Faktoren, die der Entwicklung von DCMP vorausgingen
Dies ist die häufigste Form der Schädigung des Herzmuskels. Die Inzidenz beträgt 5-8 Fälle pro 100 Einwohner pro Jahr. Für diese Patienten gibt es keine eindeutige Familienanamnese. Männer erkranken 000-2 Mal häufiger als Frauen. Pathogenese. Durch den Entzündungsprozess im Herzmuskel (Myokarditis) kommt es zum Absterben einzelner Zellen in seinen verschiedenen Teilen. In diesem Fall ist die Entzündung viraler Natur und die vom Virus befallenen Zellen werden zu Fremdstoffen für den Körper. Wenn Antigene im Körper auftreten, entwickelt sich dementsprechend ein Komplex von Immunreaktionen, die auf deren Zerstörung abzielen. Nach und nach werden abgestorbene Muskelzellen durch Bindegewebe ersetzt, das nicht über die dem Myokard innewohnende Fähigkeit zur Dehnbarkeit und Kontraktilität verfügt. Durch den Verlust grundlegender Myokardfunktionen verliert das Herz seine Pumpfunktion. Als Reaktion darauf (als kompensatorische Reaktion) dehnen sich die Herzkammern aus (d. h. sie weiten sich), und im verbleibenden Teil des Myokards kommt es zu einer Verdickung und Verdichtung (d. h. es entwickelt sich seine Hypertrophie). Um die Sauerstoffzufuhr zu den Organen und Geweben des Körpers zu erhöhen, kommt es zu einem anhaltenden Anstieg der Herzfrequenz (Sinustachykardie). Diese kompensatorische Reaktion verbessert nur vorübergehend die Pumpfunktion des Herzens. Die Möglichkeiten der myokardialen Dilatation und Hypertrophie sind jedoch durch die Menge an lebensfähigem Myokard begrenzt und für jeden spezifischen Krankheitsfall individuell. Mit dem Übergang des Prozesses in das Stadium der Dekompensation entwickelt sich eine chronische Herzinsuffizienz. Allerdings kommt in diesem Stadium ein weiterer Ausgleichsmechanismus ins Spiel: Das Gewebe des Körpers erhöht die Entnahme von Sauerstoff aus dem Blut im Vergleich zu einem gesunden Körper. Dieser Mechanismus ist jedoch unzureichend, da eine Abnahme der Pumpfunktion des Herzens zu einer Abnahme der Sauerstoffversorgung von Organen und Geweben führt, die für deren normale Funktion erforderlich ist, während die Menge an Kohlendioxid in ihnen zunimmt. Bei 2/3 der Patienten in den Hohlräumen der Ventrikel bilden sich im Spätstadium der Erkrankung parietale Thromben (aufgrund einer Abnahme der Pumpfunktion des Herzens sowie einer ungleichmäßigen Kontraktion des Myokards in den Herzkammern). ), gefolgt von der Entwicklung einer Embolie im Lungen- oder Körperkreislauf. Pathohistologische und pathomorphologische Veränderungen im Herzen. Die Form des Herzens wird kugelförmig, seine Masse steigt von 500 auf 1000 g, hauptsächlich aufgrund des linken Ventrikels. Das Myokard wird schlaff, stumpf, mit auffälligen weißlichen Bindegewebsschichten, es gibt einen charakteristischen Wechsel von hypertrophen und atrophischen Kardiomyozyten. Mikroskopisch wird eine diffuse Fibrose nachgewiesen, die sowohl mit Atrophie als auch mit Hypertrophie von Kardiomyozyten kombiniert werden kann, bei der das Volumen der Kerne, die Anzahl der Mitochondrien, die Hyperplasie des Golgi-Apparats und die Anzahl der Myofibrillen signifikant ansteigen , frei und mit den Ribosomen des endoplasmatischen Retikulums verbunden, eine Fülle von Glykogenkörnchen. Klinisches Bild. Es gibt keine spezifischen Anzeichen der Krankheit. Das klinische Bild ist polymorph und wird bestimmt durch: 1) Symptome einer Herzinsuffizienz; 2) Rhythmus- und Leitungsstörungen; 3) thromboembolisches Syndrom. Alle diese Phänomene entwickeln sich im Endstadium der Krankheit, und daher bereitet die Erkennung von DCM vor dem Auftreten dieser Symptome erhebliche Schwierigkeiten. In den meisten Fällen wird die Prognose der Krankheit durch die Niederlage der linken Herzkammer bestimmt. Vor dem Einsetzen einer Herzinsuffizienz ist DCM latent. Die häufigsten Beschwerden einer bereits einsetzenden Herzinsuffizienz sind Beschwerden über verminderte Leistungsfähigkeit, erhöhte Müdigkeit, Atemnot bei Belastung und dann in Ruhe. Nachts hat er einen trockenen Husten (das Äquivalent von Herzasthma), später - typische Asthmaanfälle. Die Patienten stellen sich mit charakteristischen Angina-Schmerzen vor. Mit der Entwicklung einer Stauung im systemischen Kreislauf tritt Schweregefühl im rechten Hypochondrium auf (aufgrund einer vergrößerten Leber), Schwellung der Beine. Diagnostik. Ein wichtiges Zeichen für die Diagnose der Erkrankung ist eine deutliche Vergrößerung des Herzens (es liegen keine Anzeichen einer Herzklappenerkrankung oder einer arteriellen Hypertonie vor). Kardiomegalie äußert sich in einer durch Perkussion bedingten Ausdehnung des Herzens in beide Richtungen sowie einer Verschiebung des apikalen Impulses nach links und unten. In schweren Fällen sind ein Galopprhythmus, Tachykardie und Geräusche einer relativen Insuffizienz der Mitral- oder Trikuspidalklappe zu hören. In 20 % der Fälle entwickelt sich Vorhofflimmern. Der Blutdruck ist normalerweise normal oder leicht erhöht (aufgrund einer Herzinsuffizienz). Biochemische Untersuchungen von Blut und Urin können verschiedene toxische Substanzen sowie Vitaminmangel nachweisen. Instrumentelle Forschungsmethoden ermöglichen den Nachweis von: 1) Anzeichen von Kardiomegalie; 2) die Veränderungen in den Kennziffern der zentralen Hämodynamik; 3) Rhythmus- und Leitungsstörungen. Es gibt keine charakteristischen Veränderungen im EKG oder die Verschiebungen sind unspezifisch. Dies sind Anzeichen einer Vergrößerung des Herzens, Leitungsstörungen in Form einer Blockade des vorderen Astes des linken Schenkels des atrioventrikulären Bündels (His-Bündel) oder einer vollständigen Blockade des linken Beins (15% der Fälle ); sowie anhaltende Sinustachykardie (Herzfrequenz übersteigt oft 100 Schläge pro Minute). Das Phonokardiogramm bestätigt auskultatorische Daten in Form eines Galopprhythmus, einer ziemlich häufigen Erkennung eines systolischen Geräuschs (aufgrund einer relativen Insuffizienz der Mitral- oder Trikuspidalklappe). Bei Stauung im Lungenkreislauf zeigt sich ein Akzent des II-Tons. Das Röntgenbild zeigt eine signifikante Zunahme der Ventrikel (oft in Kombination mit einer mäßigen Zunahme des linken Vorhofs) und eine Blutstauung im Lungenkreislauf (kleinen Kreislauf). Verletzungen des Lungenkreislaufs äußern sich in einer Zunahme des Lungengefäßmusters sowie im Auftreten von Transsudat in den Pleurahöhlen, das durch erhöhten Druck in den Lungengefäßen entsteht. Die Methode der Echokardiographie ist eine der Hauptmethoden bei der Diagnose der Krankheit. Die Echokardiographie hilft, eine Dilatation beider Ventrikel, eine Hypokinesie der hinteren Wand des linken Ventrikels und eine paradoxe Bewegung des interventrikulären Septums während der Systole zu erkennen. Darüber hinaus können Sie mit der Echokardiographie die Zunahme der Bewegungsamplitude der unveränderten Mitralklappensegel verdeutlichen. Zusätzliche instrumentelle Studien sind für die Diagnose nicht zwingend erforderlich, aber ihre Ergebnisse ermöglichen es uns, den Grad der hämodynamischen Störungen und die Art der morphologischen Veränderungen im Myokard zu beschreiben. Eine Radioisotopenuntersuchung des Herzens (Myokardszintigraphie) wird durchgeführt, um den Zustand der Pumpfunktion des Herzens zu klären und die Zonen des toten Myokards zu bestimmen. Die Untersuchung von Indikatoren der zentralen Hämodynamik zeigt ein niedriges Minuten- und Schlagvolumen (Minuten- und Schlagindizes), einen Druckanstieg in der Lungenarterie. Angiokardiographisch werden die gleichen Veränderungen wie im Echokardiogramm festgestellt. Eine Live-Myokardbiopsie ist nicht aussagekräftig für die Bestimmung der Ätiologie der Kardiomyopathie. In einigen Fällen kann in der Biopsie ein virales Antigen oder ein Anstieg des LDH-Gehalts sowie eine Abnahme der Energieproduktion durch Mitochondrien nachgewiesen werden. Allerdings kann diese Operationsmethode zur Klärung der Ätiologie der Erkrankung und der weiteren Therapie herangezogen werden. Die Manipulation wird wie folgt durchgeführt: Unter örtlicher Betäubung werden eine große Arterie und Vene durchstochen (punktiert), dann wird ein spezielles Instrument mit einer kleinen Schere am Ende entlang ihres Weges zum Herzen geführt. Durch die Kombination einer Myokardbiopsie mit einer Koronarangiographie (Injektion eines Kontrastmittels in die das Herz versorgenden Koronararterien) kann bei einem Patienten eine koronare Herzkrankheit als eine der DCM-ähnlichen Symptome ausgeschlossen werden. Diese beiden Untersuchungen werden unter Röntgenfernsehkontrolle durchgeführt. Differenzialdiagnose. Sie wird vor allem bei Myokarditis und Myokarddystrophien durchgeführt, also bei Erkrankungen, die manchmal ungerechtfertigterweise als sekundäre Kardiomyopathien bezeichnet werden. Eine Myokardbiopsie leistet eine wichtige Hilfestellung bei der Differentialdiagnose einer dilatativen Kardiomyopathie und einer Herzerkrankung, die mit einer ausgeprägten Zunahme derselben auftritt: 1) bei schwerer diffuser Myokarditis findet sich eine zelluläre Infiltration des Stromas in Kombination mit dystrophischen und nekrotischen Veränderungen in Kardiomyozyten; 2) bei primärer Amyloidose, die mit Herzschäden auftritt (die sogenannte kardiopathische Variante der primären Amyloidose), kommt es zu einer signifikanten Ablagerung von Amyloid im interstitiellen Gewebe des Myokards, verbunden mit einer Atrophie von Muskelfasern; 3) Bei Hämochromatose (einer Krankheit, die durch eine Verletzung des Eisenstoffwechsels verursacht wird) werden Ablagerungen von eisenhaltigem Pigment im Myokard gefunden, verschiedene Grade von Dystrophie und Atrophie von Muskelfasern und eine Proliferation von Bindegewebe werden beobachtet. Als Variante der DCM kommen medikamenteninduzierte und toxische Kardiomyopathien in Betracht. Zahlreiche Wirkstoffe können das Myokard toxisch schädigen: Ethanol, Emetin, Lithium, Cadmium, Kobalt, Arsen, Isoproterenol und andere Gifte. Histopathologische Veränderungen im Gewebe des Herzmuskels erscheinen als fokale Dystrophien. In Zukunft kommt es zur Entwicklung von Mikroinfarkten, begleitet von einer peripheren Entzündungsreaktion. Das auffälligste Beispiel für toxische Kardiomyopathie ist die Kardiomyopathie, die bei Menschen auftritt, die übermäßig viel Bier konsumieren. Es ist auf das darin enthaltene Kobalt zurückzuführen, das dem Bier zugesetzt wird, um den Schaum zu verbessern. Kobalt blockiert die Wirkung von Vitamin B1, und wirkt sich auch direkt auf die Veränderung der enzymatischen Prozesse der Zelle aus. Im akuten Stadium des Verlaufs der Kobalt-Kardiomyopathie werden das Vorhandensein einer hydropischen und fettigen Degeneration, die Zerstörung intrazellulärer Organellen und eine fokale Nekrose von Kardiomyozyten festgestellt. In Zukunft entwickelt sich eine diffuse oder kleinfokale interstitielle Fibrose, das Endergebnis ist die Bildung ausgedehnter Narben. Die Kobalt-Kardiomyopathie ist schwerer als die alkoholische Kardiomyopathie. Wenn die Diagnose rechtzeitig gestellt wird, wird eine klinische Heilung der Patienten beobachtet. Alkoholische Kardiomyopathie. Ethanol hat eine direkte toxische Wirkung auf Kardiomyozyten. Darüber hinaus kommt es bei einer chronischen Ethylvergiftung häufig zu einem Mangel an Ernährung. Es ist bewiesen, dass Alkohol zu einer Umwandlung von Fettsäuren in Kardiomyozyten führt, da es an Energie mangelt, die für ihre Aktivität notwendig ist. Acetaldehyd, das während des Alkoholstoffwechsels gebildet wird, kann ein Faktor für direkte toxische Wirkungen auf die Proteinsynthese sein. Alkoholismus wird auch von der Aktivierung latenter Viren begleitet. Makroskopisch ist das Myokard schlaff, lehmartig, manchmal werden kleine Narben beobachtet. Die Koronararterien sind intakt. Die mikroskopische Untersuchung zeigt eine Kombination aus Dystrophie (hydropisch und fettig), Atrophie und Hypertrophie von Kardiomyozyten, möglicherweise das Vorhandensein von Herden von Kardiomyozytenlyse und Sklerose. Die betroffenen Bereiche des Myokards kontrastieren mit unveränderten. Die elektronenmikroskopische Untersuchung von Herzbiopsieproben zeigt eine zystische Expansion des sarkoplasmatischen Retikulums und des T-Systems der Kardiomyozyten, was charakteristisch für die alkoholische Kardiomyopathie ist. Komplikationen der alkoholischen Kardiomyopathie - plötzlicher Tod infolge von Kammerflimmern oder chronischer Herzinsuffizienz, thromboembolisches Syndrom. Behandlung. Die Therapie von Kardiomyopathien ist eine schwierige Aufgabe, da die spezifischen Ursachen ihres Auftretens nicht bekannt sind. Die allgemeinen Prinzipien der Behandlung von DCM unterscheiden sich nicht wesentlich von der Behandlung chronischer Herzinsuffizienz. Bei sekundärer DCM wird zusätzlich die Vorerkrankung (Herzklappenerkrankung etc.) behandelt und es werden alle Maßnahmen ergriffen, um die Ursachen der DCM zu beseitigen. Im Wesentlichen können wir nur dann über die Behandlung von Patienten mit Kardiomyopathie sprechen, wenn klinische Anzeichen auftreten. Bei Herzinsuffizienz sind Herzglykoside wirkungslos. Die Patienten entwickeln schnell eine Unverträglichkeit gegenüber Arzneimitteln (Glykosidvergiftung), und daher ist es notwendig, Glykoside zu verwenden, die schnell aus dem Körper ausgeschieden werden (Strophanthin, Isolanid). Periphere Vasodilatatoren sind sehr effektiv, insbesondere bei gleichzeitigem Angina-Syndrom (Nitrong, Sustak, Nitrosorbid). Diese Medikamente sollten bei schwerer Herzinsuffizienz verschrieben werden, die mit Glykosiden und Diuretika schwer zu behandeln ist. Beim Angina-Syndrom wird es notwendig, antianginöse Medikamente zu verwenden, vorzugsweise verlängerte Nitrate (Sustak, Nitrong, Nitrosorbid). Adrenoblocker sind wirksam (sie werden verschrieben, wenn keine Anzeichen einer Herzinsuffizienz vorliegen). Von den modernen Methoden der chirurgischen Behandlung von DCMP ist die Herztransplantation (Transplantation) die effektivste. Die Möglichkeiten zur Durchführung dieser Operation sind jedoch erheblich eingeschränkt. Aus diesem Grund wurden als Alternative zur Herztransplantation in der modernen Behandlung zur Erhöhung der Lebenserwartung von Patienten mit DCMP rekonstruktive Operationen entwickelt und durchgeführt, die darauf abzielen, die Insuffizienz der Mitral- und Trikuspidalklappen zu beseitigen. Die operative Beseitigung der Insuffizienz dieser Klappen ermöglicht einige Zeit, den Beginn des Endstadiums der Krankheit zu "verlangsamen". Eine weitere Alternative zur Herztransplantation bei Patienten mit DCM war die teilweise Entfernung der linken Herzkammer zur Verkleinerung (Baptiste-Operation). Vor nicht allzu langer Zeit wurden für die Behandlung von Patienten mit DCMP spezielle Schrittmachermodelle entwickelt, mit denen Sie die Arbeit der Herzkammern synchronisieren können. Dies führt zu einer Verbesserung der Füllung der Herzkammern mit Blut und einer Steigerung der Pumpfunktion des Herzens. Ein separates Problem sollte DCM bei Kindern sein, was 5-10 Fällen pro 100 Kindern pro Jahr entspricht. Es ist bemerkenswert, dass sich die Krankheit in verschiedenen Altersgruppen, einschließlich Säuglingen, entwickeln kann. Die in der Studie einer Gruppe von Kindern erhaltenen Daten sind wie folgt: Die Patienten erhielten 000 Therapieoptionen (Monotherapie mit Prednisolon, Monotherapie mit Digoxin oder Prednisolon + Digoxin). Die Wirksamkeit der Behandlung wurde nach folgenden Kriterien bewertet: Die Herzfrequenz wurde vor und nach der Behandlung bestimmt, die Atemfrequenz, der Zustand der Ejektionsfraktion und die Kontraktilitätsfraktion. Die Analyse der erhaltenen Ergebnisse zeigt, dass die größte Wirkung bei der Behandlung der dilatativen Kardiomyopathie bei Kleinkindern mit einer Kombination aus Kortikosteroiden und Glykosiden (Prednisolon und Digoxin) erzielt wird. Nach Abschluss der Hauptbehandlung (Prednisolon verabreicht 3 mg/kg pro Tag für 2 Tage, Digoxin) gab es eine deutliche Abnahme der Herzfrequenz, eine Abnahme der Kurzatmigkeit. Vor dem Hintergrund der Monotherapie mit Prednisolon kommt es zu einer Abnahme der Herzfrequenz. Eine Monotherapie mit Digoxin führt zu einer Abnahme von Tachykardie und Dyspnoe. Angesichts der Unratsamkeit der Verschreibung von Zytostatika bei kleinen Kindern, da eine signifikante Anzahl von Behandlungskomplikationen beobachtet wurde, ist es in der Pädiatrie optimaler, langwirksame Herzglykoside in Kombination mit Kortikosteroidhormonen bei dilatativer Kardiomyopathie zu verwenden. Vorbeugung. Zur Vorbeugung von DCM gehört der Verzicht auf Alkohol und Kokain sowie die sorgfältige Überwachung der Herzparameter während der Tumor-Chemotherapie. Es ist nützlich, den Körper von klein auf zu härten. Die vollständige Abstinenz von Alkohol bei alkoholischer DCM verbessert die Kontraktilität des Herzens und kann die Notwendigkeit einer Herztransplantation beseitigen. Auch die Tatsache, dass die Diagnose in den meisten Fällen im Stadium der Herzinsuffizienz erfolgt, kann zu negativen Behandlungsergebnissen führen. Eine frühzeitige Diagnose der dilatativen Kardiomyopathie kann mit einer zufälligen (Screening-)Echokardiographie erfolgen, die während der jährlichen ärztlichen Untersuchung durchgeführt wird, sowie bei der Untersuchung von Personen mit erblich belasteten Personen. In diesem Fall ist es möglich, die Wirksamkeit der medikamentösen Behandlung von DCM zu erhöhen. VORTRAG № 3. Erkrankungen des Herz-Kreislauf-Systems. Hypertrophe Kardiomyopathie Die hypertrophe Kardiomyopathie (HCM) ist eine nicht koronare Erkrankung des ventrikulären Myokards (hauptsächlich des linken), gekennzeichnet durch eine massive Hypertrophie ihrer Wände mit Vorwölbung des interventrikulären Septums (IVS) in den Hohlraum des rechten Ventrikels, der erheblich verdickt sein kann , eine Abnahme des Innenvolumens der Ventrikel, eine normale oder erhöhte Kontraktilität des ventrikulären Myokards und eine beeinträchtigte Entspannung (diastolische Dysfunktion). Am häufigsten ist eine isolierte Hypertrophie des interventrikulären Septums (isolierte hypertrophe Subaortenstenose - IHSS) oder des apikalen Teils der Ventrikel. Einstufung. Klassifizierung von HCM nach Lokalisierung der Hypertrophie (ED Wigle et al., 1985 mit Ergänzungen). I. LV-Hypertrophie. 1) Asymmetrische Hypertrophie, bei der eine Myokardhypertrophie einzelner Wände oder Segmente der Ventrikel auftritt (einschließlich IVS-Hypertrophie - 90% mit oder ohne Obstruktion des Ausflusstrakts des linken Ventrikels, mittventrikulär - 1%, apikale Hypertrophie des linken Ventrikels - 3 %, Hypertrophie der freien Wand linker Ventrikel und hinterer Teil des IVS - 1 %). 2) Symmetrische (konzentrische) Hypertrophie des linken Ventrikels, wenn sich die Myokardhypertrophie auf alle Wände der Ventrikel erstreckt, tritt in 5% der Fälle auf. II. Hypertrophie der Bauchspeicheldrüse. Wenn die Myokardhypertrophie den normalen Blutabfluss aus den Herzkammern verhindert, spricht man von einer obstruktiven Form der HCM. In anderen Fällen ist HCM nicht obstruktiv. Ätiologie. Die Krankheit kann entweder angeboren oder erworben sein. Angeborene HCM wird autosomal-dominant vererbt. Innerhalb derselben Familie können verschiedene Formen und Varianten von HCM beobachtet werden. Am häufigsten wird eine asymmetrische Hypertrophie des interventrikulären Septums vererbt. Die erworbene Form der HCM tritt bei älteren Patienten mit arterieller Hypertonie in der Vorgeschichte auf. Die Prävalenz beträgt 0,02-0,05 %. Die Gründe für die Entwicklung erworbener HCM sind nicht vollständig geklärt. Gemäß einer der vorgeschlagenen Hypothesen entwickeln Personen mit erworbener HCM in der pränatalen Phase einen Defekt in den adrenergen Rezeptoren des Herzens, die an der Regulation der Herzaktivität, insbesondere der Herzfrequenz, beteiligt sind. Infolgedessen wird die Empfindlichkeit gegenüber Noradrenalin und ähnlichen Hormonen, die die Herzfrequenz erhöhen, deutlich erhöht, was die Entwicklung einer Myokardhypertrophie bei ihnen und schließlich HCM beeinflusst. Pathohistologisches Bild. Desorientierte, falsche, chaotische Anordnung von Kardiomyozyten und Myofibrillen in Kardiomyozyten, Myokardfibrose ist eine Verletzung der Architektur des Herzmuskels. Pathogenese. Hämodynamische Störungen entstehen aufgrund einer beeinträchtigten diastolischen Funktion des Herzens. Während der Diastole fließt aufgrund ihrer Dichte und Starrheit nicht genügend Blut in die Ventrikel (insbesondere die linke), was zu einem schnellen Anstieg des enddiastolischen Drucks führt. Sowohl eine erhöhte Myokardsteifheit als auch ein erhöhter intraventrikulärer Druck führen dazu, dass während der Systole weniger Blut aus dem Ventrikel ausgestoßen wird. Für eine ausreichende Sauerstoffversorgung der Organe und Gewebe des Körpers (bei normaler Funktion des Herz-Kreislauf-Systems) muss für die Durchführung jeder Belastung die Blutabgabe aus dem Herzen zunehmen. Dementsprechend steigt die Herzfrequenz als Reaktion auf die Belastung an. Mit der Entwicklung von HCM leidet die Füllung des Herzens mit Blut in Ruhe und mit einer Erhöhung der Herzfrequenz während der Belastungsperiode wird es noch negativer beeinflusst. Als Folge davon kommt es bei HCM zu keiner ausreichenden Steigerung der Pumpfunktion des Herzens während der Belastung. Körperliche Aktivität bei HCM beeinflusst den Anstieg des intraventrikulären Drucks, was zu einem Druckanstieg im oberen linken Vorhof sowie in den Gefäßen des kleinen (pulmonalen) Kreislaufs führt. Unter diesen Bedingungen entwickeln sich Hyperfunktion und Hypertrophie des linken Vorhofs und später - pulmonale Hypertonie ("passiv"). Infolgedessen tritt Atemnot auf, die proportional zum Belastungsgrad ist. Da bei Belastung der Blutausstoß aus der linken Herzkammer nicht mit der Belastungszunahme korrespondiert, leidet zunächst der Blutfluss in den Herzkranzgefäßen, die den Herzmuskel selbst versorgen. Eine wichtige Rolle spielt auch die Tatsache, dass bei HCM eine Diskrepanz zwischen einer signifikanten Masse von hypertrophiertem Myokard und der Möglichkeit einer koronaren Blutversorgung besteht, die dieselbe bleibt wie bei gesunden Menschen. Die Abnahme des Blutflusses durch die Koronararterien führt zum Auftreten von Angina pectoris in der Mitte und in der linken Brusthälfte, die zum linken Arm unter dem linken Schulterblatt ausstrahlt. Wie Kurzatmigkeit wird Angina pectoris durch körperliche Anstrengung hervorgerufen. In einigen Fällen von HCM während des Trainings verschlechtert sich auch die zerebrale Blutversorgung, was zu einer Synkope führt. Es sollte beachtet werden, dass es zur Verringerung des Anstiegs des intraventrikulären Drucks während des Trainings einen Kompensationsmechanismus gibt, dessen Funktionsweise darauf beruht, dass sich der Hohlraum des linken Vorhofs ausdehnt und die Dicke seiner Wände zunimmt. Dadurch kommt es bei Belastung zu einer zusätzlichen Füllung der linken Herzkammer mit Blut. Dies ist jedoch nur eine vorübergehende Kompensation, da die Reserve des linken Vorhofs als "Pumpe" unbedeutend ist und eine signifikante Erweiterung des Hohlraums des linken Vorhofs zur Entwicklung von Vorhofflimmern führt. Klinisches Bild. HCM zeichnet sich durch eine extreme Vielfalt an Symptomen aus, die zu Fehldiagnosen führen. Das Vorliegen und der Zeitpunkt von Beschwerden bei HCM werden hauptsächlich durch zwei Faktoren bestimmt: die Form der HCM und den Ort der Läsion. Die stärkste Kammer des Herzens ist die linke Herzkammer, daher können bei einer Hypertrophie der Myokardwände längere Zeit keine Beschwerden auftreten. Eine isolierte Schädigung der rechten Herzkammer ist äußerst selten. Bei der nicht-obstruktiven Form der HCM, wenn nichts den Blutabfluss aus dem Ventrikel stört, kann der Patient keine Beschwerden haben. Manchmal kann es zu Kurzatmigkeit (bei erheblicher körperlicher Anstrengung), Unterbrechungen der Herztätigkeit sowie einem unregelmäßigen Herzschlag kommen. Bei der obstruktiven Form der HCM wird der Blutausstoß aus dem Herzen während des Trainings aufgrund des Vorhandenseins einer Behinderung des Blutabflusses aus der Herzkammer signifikant reduziert. Die typischen Beschwerden sind hier Atemnot bei Anstrengung, Angina pectoris und Ohnmachtsanfälle. Die Krankheit zeichnet sich durch ein langsames Fortschreiten der Beschwerden ab dem Zeitpunkt ihres Auftretens aus. Aufgrund der Ähnlichkeit von Beschwerden (Schmerzen in der Herzgegend und hinter dem Brustbein) und Studiendaten (starkes systolisches Geräusch) werden rheumatische Herzerkrankungen und koronare Herzerkrankungen am häufigsten falsch diagnostiziert. Das Krankheitsbild der HCM ist: 1) Anzeichen einer ventrikulären Myokardhypertrophie (hauptsächlich links); 2) ein Zeichen einer unzureichenden diastolischen Ventrikelfunktion; 3) variable Anzeichen einer Obstruktion des linksventrikulären Ausflusstrakts. Diagnostik. Bei der diagnostischen Suche ist die Erkennung eines systolischen Geräusches, eines veränderten Pulses und eines verschobenen apikalen Impulses von größter Bedeutung. Das auskultatorische Bild des Herzens bei Patienten mit obstruktiver HCM weist eine Reihe von Merkmalen auf: Der maximale Ton des systolischen Geräuschs (Auswurfgeräusch) wird am Botkin-Punkt bestimmt und an der Herzspitze ist die Stärke des Geräuschs proportional der Grad der Obstruktion, ihre Intensivierung tritt auf, wenn der Patient abrupt aufsteht, sowie während des Valsalva-Tests; Der II-Ton bleibt immer erhalten; Geräusche werden nicht an den Gefäßen des Halses ausgeführt. Der Puls ist normalerweise hoch und schnell. Dies ist auf das Fehlen einer Verengung der Abflusswege aus dem linken Ventrikel zu Beginn der Systole zurückzuführen, aber dann tritt mit der Kontraktion kräftiger Muskeln eine „funktionelle“ Verengung der Abflusswege auf, wodurch der Puls entsteht Welle nimmt vorzeitig ab. Der Spitzenschlag hat in etwa 1/3 der Fälle einen "doppelten" Charakter: Zuerst wird bei der Palpation ein Schlag durch die Kontraktion des linken Vorhofs gefühlt, dann durch die Kontraktion des linken Ventrikels. Um diese Eigenschaft des Spitzenschlags leichter identifizieren zu können, wird die Palpation am besten durchgeführt, wenn der Patient auf seiner linken Seite liegt. Für die Diagnose von HCM sind Echokardiographiedaten von größter Bedeutung, um die anatomischen Merkmale der Erkrankung, den Schweregrad der Myokardhypertrophie und die Obstruktion des Ausflusstrakts des linken Ventrikels zu klären. Die folgenden Anzeichen zeigen sich: asymmetrische Hypertrophie des IVS, ausgeprägter im oberen Drittel, seine Hypokinese; systolische Bewegung des vorderen Mitralklappensegels in anteriorer Richtung; Kontakt des vorderen Mitralklappensegels mit dem IVS in der Diastole. Unspezifische Anzeichen sind: Hypertrophie des linken Vorhofs, Hypertrophie der hinteren Wand des linken Ventrikels, eine Abnahme der durchschnittlichen Geschwindigkeit der diastolischen Abdeckung des vorderen Mitralklappensegels. Im EKG finden sich spezifische Veränderungen nur bei ausreichend ausgeprägter linksventrikulärer Hypertrophie. Durch die Aufzeichnung eines EKGs über 24 Stunden (Holter-Monitoring) werden bestehende Herzrhythmusstörungen erkannt. Ein EKG-Test mit einer dosierten körperlichen Aktivität auf einem Fahrradergometer oder Laufband ermöglicht es Ihnen, die Schwere der Krankheitssymptome, ihre Prognose und die Entwicklung einer geeigneten Behandlung zu beurteilen. Eine isolierte Hypertrophie des IVS verursacht eine Zunahme der Amplitude der Q-Zacke in den linken Brustableitungen (V5-6), was die Differentialdiagnose mit fokalen Veränderungen aufgrund eines Myokardinfarkts erschwert. Eine geringe Breite der Q-Welle ermöglicht jedoch den Ausschluss eines Myokardinfarkts.Im Verlauf der Entwicklung einer hämodynamischen Überlastung des linken Vorhofs kann das EKG Anzeichen einer linksatrialen Hypertrophie zeigen: Verbreiterung der P-Welle für mehr als 0,10 s, eine Zunahme in ihrer Amplitude das Auftreten einer zweiphasigen P-Welle in Ableitung V1 wobei die zweite Phase in Amplitude und Dauer zunimmt. Die Röntgendiagnostik ist nur im fortgeschrittenen Stadium der Erkrankung wichtig, wenn eine Vergrößerung des linken Ventrikels und des linken Vorhofs, eine Erweiterung des absteigenden Teils der Aorta festgestellt werden kann. Auf dem Phonokardiogramm bleiben die Amplituden der Töne I und II erhalten, was ein differenzielles Zeichen der HCM von der Stenose der Aortenöffnung ist, und es wird auch ein systolisches Geräusch unterschiedlicher Schwere festgestellt. Invasive Untersuchungsmethoden (Sondierung des linken Herzens, Kontrastangiographie) sind derzeit nicht zwingend erforderlich, da die Echokardiographie recht zuverlässige Informationen für die Diagnosestellung liefert. Manchmal werden diese Methoden jedoch in kontroversen Fällen zur Klärung der Diagnose oder zur Vorbereitung von Patienten auf eine Operation eingesetzt. Die Herzsondierung wird unter Röntgenfernsehkontrolle verwendet. Technik zur Durchführung des Verfahrens: Durch Punktion einer großen Arterie unter örtlicher Betäubung mit weiterem Einführen eines speziellen Katheters in die Herzhöhle wird der Druckgradient (Differenz) zwischen der linken Herzkammer und der abgehenden Aorta gemessen. Normalerweise sollte dieser Gradient nicht sein. Allerdings besteht bei der HCM eine Druckdifferenz zwischen der linken Herzkammer und der Aorta von 50 bis 150 mmHg. Art., ein Anstieg des enddiastolischen Drucks in der Höhle des linken Ventrikels bis zu 18 mm Hg. Kunst. Der Druckgradient nimmt nach der Einführung von β-Blockern ab. Außerdem wird während der Sondierung des Herzens ein Kontrastmittel in die Kammer des Ventrikels injiziert (Ventrikulographie), um seine anatomischen Merkmale zu untersuchen. Bei einer Reihe von Patienten (in der Regel sind dies Personen über 40 Jahre) wird gleichzeitig vor Herzoperationen eine Angiographie der Herzkranzgefäße (Koronarangiographie) zur Abklärung der Ätiologie der Angina pectoris und zum Ausschluss einer begleitenden koronaren Herzkrankheit eingesetzt. Behandlung. Grundlage der medikamentösen Behandlung von HCM sind Medikamente, die die Durchblutung der Herzkammern in der Diastole verbessern. Bei diesen Medikamenten handelt es sich um eine Gruppe von β-Blockern (Anaprilin, Atenolol, Metoprolol und Propranolol, 160–320 mg/Tag usw.) und eine Gruppe von Calciumionenantagonisten (Verapamil, jedoch mit Vorsicht). Novokinamid und Disopyramid senken außerdem die Herzfrequenz und wirken antiarrhythmisch. Zu Beginn der Behandlung werden kleine Dosen dieser Medikamente verwendet, dann wird die Dosierung schrittweise auf die vom Patienten maximal verträgliche Dosis erhöht. β-Blocker werden bei Diabetes mellitus, Asthma bronchiale und einigen anderen Erkrankungen mit Vorsicht angewendet. Bei der Behandlung mit diesen Medikamenten ist eine ständige Überwachung des Blutdrucks und der Pulsfrequenz erforderlich. Gefährlich ist ein Druckabfall unter 90/60 mm Hg. Kunst. und Herzfrequenz unter 55 pro Minute. Wenn ein Patient gefährliche Arrhythmien hat, die nicht mit β-Blockern oder Kalziumionenantagonisten behandelt werden können, werden bei der Behandlung dieser Patienten zusätzlich andere Antiarrhythmika eingesetzt. Die Ernennung von Antikoagulanzien wird bei paroxysmalen Arrhythmien und Vorhofflimmern sowie bei Vorhandensein von Blutgerinnseln in den Herzkammern (Warfarin usw.) empfohlen. Während der Behandlung mit diesen Medikamenten müssen regelmäßig eine Reihe von Indikatoren des Blutgerinnungssystems überwacht werden. Bei einer erheblichen Überdosierung von Antikoagulanzien sind äußere (nasale, uterine usw.) und innere Blutungen (Hämatome usw.) möglich. Eine chirurgische Behandlung wird bei Patienten mit obstruktiver HCM durchgeführt, wenn die medizinische Behandlung nicht wirksam ist oder wenn der Gradient zwischen dem linken Ventrikel und der Aorta mehr als 30 mm Hg beträgt. Kunst. (Die Operation der Myotomie oder Myektomie wird durchgeführt - Exzision oder Entfernung eines Teils des hypertrophierten Myokards des linken Ventrikels). Ein Mitralklappenersatz und eine nicht-chirurgische IVS-Ablation werden ebenfalls durchgeführt. Vorbeugung. Alle Patienten mit HCM, insbesondere solche mit obstruktiver Form, sind kontraindiziert bei Sportarten, die die körperliche Aktivität über einen kurzen Zeitraum deutlich steigern können (Leichtathletik, Fußball, Hockey). Die Prävention der Krankheit liegt in einer frühzeitigen Diagnose, die es ermöglicht, frühzeitig mit der Behandlung der Krankheit zu beginnen und die Entwicklung einer schweren Myokardhypertrophie zu verhindern. Es ist zwingend erforderlich, bei genetischen Verwandten des Patienten eine Echokardiographie durchzuführen. Wichtig für die Diagnose sind auch Screening-EKG- und EchoCG-Screenings, die im Rahmen einer jährlichen ärztlichen Untersuchung durchgeführt werden. Bei Patienten mit einer obstruktiven Form der HCM ist es notwendig, einer infektiösen Endokarditis vorzubeugen (Antibiotikaprophylaxe etc.), da das Vorliegen einer Obstruktion die Voraussetzungen für die Entwicklung dieser lebensbedrohlichen Erkrankung schafft. VORTRAG № 4. Erkrankungen des Herz-Kreislauf-Systems. Restriktive Kardiomyopathie Restriktive Kardiomyopathie (RCMP) - (vom lateinischen Wort "restrictio" - "Einschränkung") - eine Gruppe von Erkrankungen des Myokards und des Endokards, bei denen infolge ausgeprägter Fibrose und Elastizitätsverlust aus verschiedenen Gründen eine feste Einschränkung der Füllung vorliegt der Ventrikel in der Diastole. Die Füllung der Ventrikel erfolgt in der Phase der frühen Füllung, gefolgt von der Stabilisierung des intraventrikulären Drucks. Die Krankheit wird von einer unzureichenden Blutfüllung des Herzens begleitet, was weiter zur Entwicklung einer chronischen Herzinsuffizienz führt. Die restriktive Kardiomyopathie ist die am wenigsten untersuchte und am wenigsten verbreitete aller Kardiomyopathien. RCMP schließt ein: Leflers parietale fibroplastische Endokarditis (gefunden in Ländern mit gemäßigtem Klima, beschrieben von W. Loffler et al., 1936) und Endomyokardfibrose (gefunden in Ländern des tropischen Afrikas, beschrieben von D. Bedford et E. Konstman). Bisher wurden sie als zwei unabhängige pathologische Prozesse betrachtet. Das pathomorphologische Bild bei diesen Erkrankungen unterscheidet sich jedoch kaum. Ursachen von RCM. Primäre RCM ist sehr selten und die einzige nachgewiesene Ursache für ihr Auftreten ist das sogenannte hypereosinophile Syndrom (Morbus Leffler, parietale fibroplastische Endokarditis Leffler). Sie tritt hauptsächlich bei Männern im Alter von 30 bis 40 Jahren auf. Beim hypereosinophilen Syndrom kommt es zu einer Entzündung des Endokards, die im Laufe der Zeit zu einer erheblichen Verdichtung des Endokards und seiner rauen Haftung am angrenzenden Myokard führt, was zu einer starken Abnahme der Dehnbarkeit des Herzmuskels führt. Das Lefler-Syndrom ist außerdem durch eine anhaltende Eosinophilie über 6 Monate oder länger gekennzeichnet (1500 Eosinophile pro 1 mm).3), Schädigung innerer Organe (Leber, Nieren, Lunge, Knochenmark). In der überwiegenden Mehrheit der Fälle ist der Ursprung von RCMP aus anderen Gründen sekundär, von denen die häufigsten sind: 1) Amyloidose - eine Krankheit, die mit einer Verletzung des Proteinstoffwechsels im Körper verbunden ist; gleichzeitig wird in den Geweben verschiedener Organe ein abnormales Protein (Amyloid) gebildet und in großen Mengen abgelagert; wenn das Herz geschädigt ist, verursacht Amyloid eine Abnahme seiner Kontraktilität und Dehnbarkeit; 2) Hämochromatose - eine Verletzung des Eisenstoffwechsels im Körper, begleitet von einem erhöhten Eisengehalt im Blut, dessen Überschuss in vielen Organen und Geweben, einschließlich des Myokards, abgelagert wird, wodurch seine Dehnbarkeit abnimmt; 3) Sarkoidose - eine Krankheit unbekannter Ätiologie, gekennzeichnet durch die Bildung von Zellhaufen (Granulomen) in Organen und Geweben; am häufigsten sind Lunge, Leber, Lymphknoten und Milz betroffen; und sich entwickelnde Granulome im Myokard führen zu einer Abnahme seiner Dehnbarkeit; 4) Endokarderkrankungen (Endokardfibrose, Endokardfibroelastose usw.), wenn es zu einer signifikanten Verdickung und Verdichtung des Endokards kommt, was auch zu einer starken Einschränkung der myokardialen Dehnbarkeit führt. Insbesondere die Fibroelastose des Endokards kann nur bei Säuglingen auftreten; Diese Krankheit ist aufgrund der frühen Entwicklung einer schweren Herzinsuffizienz nicht mit dem Leben vereinbar. Pathogenese. Bei RCM leidet die Myokardcompliance aus verschiedenen Gründen. Dadurch nimmt die Füllung der Ventrikel mit Blut ab und der intraventrikuläre Druck steigt deutlich an. Im Gegensatz zur HCM ist die Wahrscheinlichkeit einer kompensatorischen Myokardhypertrophie bei einer restriktiven Kardiomyopathie jedoch gering. So kommt es nach einiger Zeit zu einer Stagnation des Lungenkreislaufs und die Pumpfunktion des Herzens lässt nach, was zu einer allmählichen Flüssigkeitsansammlung im Körper, der Entwicklung anhaltender Schwellungen der Beine, Hepatomegalie und Aszites führt. Wenn sich die Verdichtung des Endokards auf die atrioventrikulären Klappen (Mitral- und Trikuspidalklappe) erstreckt, wird dies durch die Entwicklung ihrer Insuffizienz verstärkt und führt aufgrund ihrer verringerten Kontraktilität und Dehnbarkeit auch zu Thrombosen in den Herzhöhlen. Die Ausbreitung von Fragmenten dieser Blutgerinnsel mit dem Blutkreislauf kann zu Thromboembolien und Verstopfungen großer Gefäße, Herzinfarkten innerer Organe führen. Mit der Ausbreitung pathologischer Einschlüsse des Myokards in die Zone des Reizleitungssystems des Herzens können verschiedene Störungen in der Leitung des Herzimpulses auftreten, begleitet von der Entwicklung von Blockaden. Bei RCMP werden auch häufig verschiedene Arten von Arrhythmien beobachtet. Auf der Grundlage des oben Gesagten können wir schließen, dass die Krankheit aus pathogenetischer Sicht in 3 Stadien verläuft. Stufe I - nekrotisch - eosinophile Infiltration des Myokards und anderer Organe. Stadium II - thrombotisch - die Bildung von Blutgerinnseln in den Hohlräumen des linken und rechten Ventrikels, die Entwicklung thromboembolischer Komplikationen und die allmähliche Verdickung des Endokards hauptsächlich in den apikalen Regionen und in der Nähe der atrioventrikulären Klappen. Stadium III - fibrös, gekennzeichnet durch eine Verdickung des Endokards bis zu mehreren Millimetern, Myokardfibrose wird exprimiert - hauptsächlich subendokardiale Bereiche. Die Höhle ist aufgrund organisierter Thromben teilweise obliteriert, es werden Fibrose der Mitralklappenspitzen und Mitralinsuffizienz festgestellt. Ausgeprägte Vorhofdilatation. Es wird eine restriktive diastolische Dysfunktion beobachtet. Klinisches Bild. Die Manifestationen der Krankheit sind äußerst polymorph und werden durch Symptome von Durchblutungsstörungen im kleinen oder großen Kreis (je nach vorherrschender Schädigung des rechten oder linken Ventrikels) bestimmt. Beschwerden können ausbleiben oder auf eine Stauung im Lungen- oder Körperkreislauf zurückzuführen sein. Die Patienten klagen in der Regel über Kurzatmigkeit, die zuerst bei körperlicher Anstrengung auftritt, und im weiteren Verlauf der Krankheit wird Kurzatmigkeit in Ruhe beobachtet. Aufgrund einer Abnahme der Pumpfunktion des Herzens klagt der Patient über Müdigkeit und schlechte Belastungstoleranz. Mit der Zeit kommen Schwellungen der Beine, eine vergrößerte Leber und Bauchwassersucht hinzu. In regelmäßigen Abständen tritt ein unregelmäßiger Herzschlag auf, und mit der Entwicklung anhaltender Blockaden kann es zu Ohnmachtsanfällen kommen. Das erste Stadium der Entwicklung der Krankheit (nekrotisch) ist durch das Auftreten von Fieber, Gewichtsverlust, Husten, Hautausschlag und Tachykardie gekennzeichnet. Diagnostik. RCM zu erkennen ist äußerst schwierig. Über diese Pathologie kann man erst nach Ausschluss einer Reihe ähnlicher Erkrankungen (wie idiopathische Myokarditis vom Abramov-Fiedler-Typ, exsudative Perikarditis, Herzklappenfehler) mit Sicherheit sprechen. Bei der Untersuchung von Patienten mit RCMP werden Symptome gefunden, die für kongestive Herzinsuffizienz (Ödeme, Hepatomegalie und Aszites) charakteristisch sind, sowie ein ausgeprägtes Pulsieren der Halsvenen. Letzteres ist auf die Schwierigkeit der Blutversorgung des Herzens aufgrund der schlechten myokardialen Dehnbarkeit zurückzuführen. Bei der Auskultation ist die Erkennung einer Herzzunahme, eines leisen spätsystolischen Geräuschs und eines lauten frühen III-Tons (aufgrund der schnellen Füllung der Ventrikel während der Diastole) von großer Bedeutung. Herzgeräusche werden auch bei Patienten mit atrioventrikulärer Klappeninsuffizienz festgestellt. Eine EKG-Untersuchung zeigt eine mäßige Hypertrophie des ventrikulären Myokards sowie verschiedene Rhythmus- und Leitungsstörungen des Herzimpulses, unspezifische Veränderungen der T-Welle im EKG. Die Echokardiographie ist eine der informativsten Methoden zur Diagnose der Krankheit, mit deren Hilfe eine Verdickung des Endokards, eine Veränderung der Füllung der Herzkammern, eine Abnahme der Pumpfunktion des Herzens, eine schnelle Bewegung des vorderen Segels der Mitralklappe während der Diastole und eine schnelle frühe Bewegung der hinteren Wand des linken Ventrikels nach außen festgestellt werden. Mit der Magnetresonanztomographie können Sie Informationen über die Anatomie des Herzens gewinnen, pathologische Einschlüsse im Myokard bestimmen und die Dicke des Endokards messen. Bei der Untersuchung der Parameter der zentralen Hämodynamik wird ein erhöhter Füllungsdruck in beiden Ventrikeln festgestellt, wobei der Enddruck im linken den im rechten Ventrikel übersteigt. Die Ventrikulographie zeigt eine erhöhte Kontraktion des linken Ventrikels, glatte Konturen seiner Wände, manchmal mit einem Füllungsdefekt in der Spitze (Hinweis auf Obliteration). In einigen Fällen werden Vertiefungen im Bereich der Papillarmuskeln festgestellt. Es gibt Anzeichen einer Herzklappeninsuffizienz, insbesondere der Mitral- oder Trikuspidalklappe. Differenzialdiagnose. Bei der Differenzialdiagnose der RCM ist es sehr wichtig, die Ähnlichkeit der Erkrankung in den äußeren Erscheinungsformen mit der konstriktiven Perikarditis zu berücksichtigen, die Behandlungsmethode dieser Erkrankungen ist jedoch diametral entgegengesetzt. Die intravitale Biopsie des Myokards und Endokards wird in der Regel gleichzeitig mit der Herzsondierung durchgeführt, was bessere Informationen zur Klärung der Art der Erkrankung und zur weiteren Behandlung ermöglicht. In äußerst seltenen Fällen, wenn die oben genannten Diagnosemethoden eine Unterscheidung zwischen RCM und konstriktiver Perikarditis nicht ermöglichen, wird eine direkte Inspektion des Perikards auf dem Operationstisch durchgeführt. Alle Patienten mit RCMP benötigen eine umfassende klinische, biochemische und zusätzliche Untersuchung, um nicht-kardiale Ursachen der Erkrankung zu bestimmen. Behandlung. Die Behandlung der Krankheit bereitet erhebliche Schwierigkeiten. Die meisten Medikamente, die zur Behandlung von Herzinsuffizienz eingesetzt werden, bringen möglicherweise nicht die gewünschten Ergebnisse, da es aufgrund der Krankheitsmerkmale nicht möglich ist, eine signifikante Verbesserung der Myokardcompliance zu erreichen (in einigen Fällen werden Calciumionenantagonisten verschrieben). für diese Zwecke). Diuretika (Aldacton) werden eingesetzt, um überschüssige Flüssigkeit im Körper auszuscheiden. Um anhaltende Erregungsleitungsstörungen zu beseitigen, kann die Installation (Implantation) eines dauerhaften Herzschrittmachers erforderlich sein. Dies wird durch Krankheiten wie Sarkoidose und Hämochromatose verursacht, die zur Entwicklung von sekundärem RCMP führen und einer Selbstbehandlung unterliegen. Bei der Behandlung von Sarkoidose werden hormonelle Medikamente (Prednisolon usw.) und bei Hämochromatose regelmäßig Aderlass (um die Eisenkonzentration im Körper zu reduzieren) verwendet. Die Behandlung der myokardialen Amyloidose hängt direkt von den Ursachen ihres Auftretens ab. Es ist ratsam, gerinnungshemmende Medikamente gegen Thrombosen in den Herzkammern zu verwenden. In Fällen von RCMP, die durch eine Endokardschädigung verursacht werden, wird auf eine chirurgische Behandlung zurückgegriffen. Während der Operation wird nach Möglichkeit der veränderte Teil des Endokards entfernt. In einigen Fällen wird bei Insuffizienz der atrioventrikulären Klappen deren Prothese durchgeführt. Einige Formen der amyloiden Myokardschädigung werden mit einer Herztransplantation behandelt. Prävention von RCMP. Leider gibt es nur begrenzte vorbeugende Maßnahmen gegen diese Krankheit. Vor allem die frühzeitige Erkennung potenziell vermeidbarer Ursachen von Amyloidose, Sarkoidose, Hämochromatose etc. ist zur Erreichung dieser Ziele von großer Bedeutung. VORTRAG Nr. 5. Erkrankungen des Herz-Kreislauf-Systems. Infektiöse Endokaditis Infektiöse Endokarditis (IE) - eine Krankheit, die in einer polyposis-ulzerativen Läsion des Herzklappenapparates (oft mit der Entwicklung einer Klappeninsuffizienz) oder des parietalen Endokards (seltener ist das Endothel der Aorta oder der nächsten großen Arterie betroffen) besteht. Die Krankheit wird durch verschiedene pathogene Mikroorganismen verursacht und geht mit einer systemischen Läsion der inneren Organe (Nieren, Leber, Milz) vor dem Hintergrund einer veränderten Reaktivität des Körpers einher. Für diesen pathologischen Vorgang finden sich bisher in verschiedenen Druckschriften die früher verwendeten Begriffe "bakterielle Endokarditis", "protrahierte septische Endokarditis". Es ist jedoch der Begriff "infektiöse Endokarditis", der sie ersetzt hat, der die Ursache der Krankheit besser widerspiegelt, die durch eine Vielzahl von Mikroorganismen verursacht wird - bakterielle Erreger, Rickettsien, Viren und Pilze. Die Zahl der Patienten mit IE nimmt weltweit zu. Dies ist auf das Vorliegen sogenannter Risikogruppen (Patienten mit atherosklerotischen, rheumatischen, traumatischen Klappenverletzungen, Herz- oder Klappenfehlern, Ventrikelseptumdefekt, Aortenstenosen) zurückzuführen, da bei krankhaft veränderten Patienten leichter Infektionen auftreten Herzklappe oder Endokard. Ätiologie. Die pathogenen Erreger der Krankheit sind am häufigsten die Kokkengruppe der Mikroorganismen - Streptokokken (Viridans-Streptokokken wurden zuvor in 90 % der Fälle isoliert), Staphylokokken (golden, weiß), Enterokokken, Pneumokokken. Durch den weit verbreiteten Einsatz von Antibiotika hat sich in den letzten Jahren das Spektrum der mikrobiellen Krankheitserreger verändert. Die Krankheit kann durch gramnegative Flora (Escherichia coli, Pseudomonas aeruginosa, Proteus, Klebsiella) verursacht werden; es gibt Hinweise auf die wichtige Rolle pathogener Pilze, Sarcinus, Brucella und Viren. Durch diese Krankheitserreger verursachte Krankheiten sind schwerwiegender, insbesondere eine Endokarditis, die durch eine Pilzinfektion verursacht wird (tritt normalerweise aufgrund des irrationalen Einsatzes von Antibiotika auf). Bei einer Reihe von Patienten wird jedoch der wahre Erreger der Krankheit nicht nachgewiesen (die Häufigkeit negativer Blutkulturergebnisse beträgt 20–50 %). Häufig tritt eine Infektion an der Stelle einer Klappenprothese auf – das sogenannte prothetische IE, das sich hauptsächlich innerhalb von 2 Monaten nach einer Herzklappenersatzoperation entwickelt. In diesem Fall ist der Erreger der Krankheit meistens Streptokokken-Natur. So sind die Infektions- und Bakteriämiequellen bei IE sehr unterschiedlich (Operationen in der Mundhöhle, Operationen und diagnostische Eingriffe im Urogenitalbereich, chirurgische Eingriffe am Herz-Kreislauf-System (einschließlich Klappenersatz), längerer Verbleib des Katheters in einer Vene, häufige intravenöse Infusionen und endoskopische Untersuchungsmethoden, chronische Hämodialyse (arteriovenöser Shunt), intravenöse Arzneimittelverabreichung). Es gibt sogenannte primäre IE, die sich an intakten Klappen entwickelt haben, sowie IE vor dem Hintergrund angeborener und erworbener Veränderungen des Herzens und seines Klappenapparats - sekundäre Endokarditis. Diese Veränderungen ermöglichen es, Patienten in separate Risikogruppen einzuteilen: Herzfehler (angeboren und erworben), Mitralklappenprolaps, arteriovenöse Aneurysmen, Postinfarkt-Aneurysmen, Shunts, Zustand nach Operationen am Herzen und großen Gefäßen. Pathogenese. Der Mechanismus der Entstehung von IE ist komplex und unzureichend untersucht, die Hauptpunkte bei der Entstehung der Krankheit können jedoch identifiziert werden. Wenn es im Körper unter dem Einfluss einer veränderten humoralen und lokalen (zellulären) Immunität mit einer Perversion immunologischer Reaktionen, verschiedener endogener und exogener Faktoren zu einem Infektionsherd kommt, entwickelt sich eine Bakteriämie. Aus dem Blut gelangen Mikroorganismen in die Herzklappen und bilden dort einen sekundären Infektionsherd. Die Fixierung und Vermehrung von Mikroorganismen auf dem Endokard wird durch eine Reihe von Faktoren erleichtert: eine vorherige Veränderung des Gewebes und der Oberfläche der Klappe, das Vorhandensein thrombotischer Massen darauf, die unter dem Einfluss der direkten schädigenden Wirkung des Blutstroms entstehen wenn sich sein intrakardialer Kreislauf unter Bedingungen bestehender Herzerkrankungen ändert. Gleichzeitig „kleben“ verschiedene Blutzellen (Blutplättchen usw.) an der Stelle der traumatischen Verletzung und bilden Zellwucherungen, die an Eiszapfen erinnern, die an der Klappe hängen. Diese Vegetationen werden für Infektionen verfügbar, die in das Gefäßbett eingedrungen sind. Die Verformung der Klappen aufgrund des Auftretens eines großen Druckgradienten, die Enge des Lochs und Änderungen der Blutflussgeschwindigkeit tragen ebenfalls zur Einführung von Infektionserregern in das Endokard unter Bildung eines Infektionsherds bei. Wenn eine zuvor intakte Klappe beschädigt wird, treten Veränderungen auf, die die normalen Eigenschaften einzelner Abschnitte dieser Klappe stören (Schwellung tritt auf), exsudative oder proliferative Prozesse ("interstitielle Valvulitis" - präklinische Phase). In der Entwicklung der Krankheit kann Stadium III unterschieden werden. Stufe I (infektiös-toxisch) verläuft mit unterschiedlichem Schweregrad der Vergiftung. Es gibt ein Wachstum von Bakterien, die Zerstörung von Klappen, was zur Entwicklung von Herzkrankheiten führt; Im gleichen Stadium kommt es häufig zu einer Verallgemeinerung des Prozesses aufgrund der hämatogenen Ausbreitung der Infektion - Höckerstücke oder Kolonien von Mikroorganismen können sich von der Klappe lösen, die Höcker können reißen. Die Ablösung von Stücken mikrobieller Klappenvegetation trägt zur Einführung infizierter Emboli in verschiedene Teile des Gefäßbetts bei und verschlimmert septische Manifestationen. Teile der Klappe oder mikrobielle Vegetationen zirkulieren mit Blut durch den Körper, wenn sie in das Gehirn eindringen, verursachen sie Hirninfarkte, die von Lähmungen, Paresen und verschiedenen anderen neurologischen Störungen begleitet werden. Die zerstörte Klappe kann ihre Funktion nicht mehr erfüllen, und bald kommt es zu einem blitzschnell einsetzenden Herzversagen. Stadium II - immuninflammatorisch, bei dem an den Klappen fixierte Mikroorganismen eine verlängerte Autosensibilisierung und hyperergische Schädigung der Organe und Gewebe des Körpers verursachen (Immunverallgemeinerung des Prozesses). Während dieser Zeit zirkulieren Immunkomplexe im Blut und werden in Geweben (Herz, Nieren, Leber, Blutgefäße) fixiert. Immun- und Autoimmunerkrankungen verursachen die Entwicklung von Vaskulitis und Viszeritis (Immunkomplexnephritis, Myokarditis, Hepatitis, Kapillaritis usw.). Stadium III - dystrophisch - tritt mit dem Fortschreiten des pathologischen Prozesses auf: Die Funktionen einer Reihe von Organen sind gestört, es kommt zu Herz- und Nierenversagen, was den Krankheitsverlauf weiter verschlimmert. Einstufung. Derzeit wird die Klassifikation und Nomenklatur der IE verwendet, die die klinische Form, die Verlaufsvariante, den Aktivitätsgrad, die pathogenetische Phase sowie die klinische und morphologische Form der Erkrankung widerspiegelt (siehe Tabelle 6). Tabelle 6 Klassifizierung von IE
Außerdem wird zwischen aktivem und inaktivem (geheiltem) IE unterschieden. Es gibt auch eine chirurgische Klassifikation, in der sie unterscheiden: 1) die Läsion ist auf die Klappensegel beschränkt; 2) die Läsion erstreckt sich über die Klappe hinaus. Akute IE (schnell fortschreitend, entwickelt sich über 8-10 Wochen) ist selten, normalerweise bei Personen, die zuvor keine Herzerkrankung hatten, und manifestiert sich klinisch durch das Bild einer allgemeinen Sepsis. Mit modernen Behandlungsmethoden ist es möglich, es in subakut zu übersetzen. Subakute IE (am häufigsten) dauert 3-4 Monate, bei adäquater medikamentöser Therapie kann eine Remission eintreten. Rückfälle der Krankheit sind jedoch möglich. Die protrahierte IE dauert viele Monate mit Exazerbations- und Remissionsperioden und ist durch milde klinische Manifestationen, geringfügige Laborparameter und allgemeine Störungen gekennzeichnet. Die Krankheit spricht in der Regel gut auf die Behandlung an. Bei ungünstigem Verlauf treten schwere Komplikationen auf und die Patienten sterben an fortschreitender Herzinsuffizienz, was zu einer zunehmenden septischen Vergiftung führt. Klinisches Bild. Je nach Erreger der Infektion kann IE plötzlich auftreten und sich schnell entwickeln (Staphylococcus aureus, Enterokokken) oder latent beginnen (Viridans-Streptokokken). Manifestationen von IE werden in Form von Syndromen dargestellt. 1) Syndrom entzündlicher Veränderungen und Septikämie (Fieber, Schüttelfrost, hämorrhagische Hautausschläge, Veränderungen der Blutparameter in der akuten Phase: Leukozytose mit Verschiebung nach links, Anstieg der ESR, Auftreten von C-reaktivem Protein, Anstieg von Fibrinogen, α2-Globuline. 2) Syndrom der allgemeinen Vergiftung des Körpers (Schwäche, Schwitzen, Kopfschmerzen, Myalgie und Arthralgie, Appetitlosigkeit, Blässe der Haut mit ikterischem Anflug). 3) Syndrom der Klappenschädigung (Herzkrankheitsbildung). 4) Syndrom der "Labor"-Immunstörungen (Vorhandensein von Immunkomplexen, die im Blut zirkulieren oder in den Nieren, dem Myokard, den Blutgefäßen fixiert sind; Hypergammaglobulinämie; das Auftreten von Rheumafaktoren; Nachweis von Anti-Gewebe-Antikörpern). 5) Syndrom thromboembolischer Komplikationen (fokale Nephritis, Myokardinfarkt, Milz, Darm, Thromboembolie im Gehirn, Gefäße der unteren Extremitäten usw.). 6) Syndrom der Generalisierung von Läsionen (diffuse Glomerulonephritis, Myokarditis, Hepatitis, Vaskulitis usw.). Der Schweregrad dieser Syndrome ist unterschiedlich. Es hängt von der Art des IE-Verlaufs, dem Stadium, der Art des Erregers ab. Zum Beispiel ist Staphylokokken-IE durch eine hohe Aktivität des Prozesses, schwere Symptome einer allgemeinen Vergiftung und die Entwicklung von eitrigen Komplikationen gekennzeichnet. Pilz-Endokarditis wird normalerweise von einem embolischen Verschluss großer Arterien, insbesondere der unteren Extremitäten, begleitet. Ein typisches Krankheitsbild ist charakteristisch für IE, verursacht durch Streptococcus viridans. Der Ausbruch der Krankheit ist oft mit einer akuten Infektion oder Verschlimmerung einer chronischen Infektion sowie mit einer Reihe von medizinischen Manipulationen verbunden. Besonders charakteristisch ist die Kombination einer Erhöhung der Körpertemperatur unterschiedlichen Ausmaßes (von anhaltendem Fieber bis zu subfebrilem Zustand oder normaler Temperatur) mit Schüttelfrost und Schweißausbrüchen. Der Patient beschwert sich gleichzeitig über das Vorhandensein eines infektiösen Prozesses und einer Intoxikation sowie über thromboembolische Komplikationen einer Herzschädigung. Patienten können eine Vorgeschichte von Episoden einer Langzeit-Antibiotikabehandlung haben (dies tritt auf, wenn IE bei zuvor behandelten Patienten wieder auftritt). Diagnostik. Von größter Bedeutung für eine korrekte Diagnose ist die Erkennung einer Schädigung der Herzklappen durch Veränderungen im Auskultationsmuster bereits bestehender Herzfehler; das Auftreten von „zusätzlichem“ Lärm. Es zeigen sich charakteristische Läsionen der Haut und der Schleimhäute: Milchkaffee-Hautfarbe, Blutungen, positive Hecht- (Prise) und Konchalovsky-Rumpel-Leede-Symptome (Tourniquet) sowie Osler-Knoten – schmerzhafte hyperämische dichte Knötchen auf der Palmaroberfläche und Fingerkuppen, Lukin-Libman-Zeichen (Lukin-Flecken) – Blutung an der Übergangsfalte der Bindehaut. Bei IE wird häufig eine Splenomegalie beobachtet. Ein erheblicher Gewichtsverlust (manchmal 15–20 kg) ist sehr typisch. In seltenen Fällen entwickelt sich eine Perikarditis (ein leises Reibungsgeräusch im Pleurabereich, das durch fibrinöse Ablagerungen am Herzbeutel verursacht wird). Bei der körperlichen Untersuchung kann ein erhöhter Blutdruck festgestellt werden, was auf die Entwicklung einer diffusen Glomerulonephritis hinweist. Manchmal werden Anzeichen einer Funktionsstörung des Zentralnervensystems (Parese, Hyperkinese, pathologische Reflexe usw.) als Folge einer Embolie von Hirngefäßen festgestellt. In diesem Fall ist der häufigste Diagnosefehler die Beurteilung eines bestimmten Syndroms als Manifestation einer eigenständigen Krankheit (z. B. wird bei ausgeprägten Anzeichen einer Leberschädigung eine Hepatitis diagnostiziert usw.). Die Diagnose der IE basiert jedoch in erster Linie auf der Früherkennung des Erregers der Erkrankung. Dazu werden die folgenden Labor- und Instrumentenstudien verwendet. 1) Der Erhalt einer positiven Blutkultur ist das wichtigste diagnostische Zeichen von IE. Auch in diesem Fall ist eine Analyse notwendig, um das wirksamste Antibiotikum auszuwählen. Mindestens 2-3 von ihnen sind erforderlich, um die Diagnose zu bestätigen. Von großer Bedeutung sind die Technik der Blutentnahme und -kultur, der Zeitpunkt der Inokulation (vorzugsweise auf Höhe des Fiebers), die Verwendung von angereicherten Medien. 2) Durchführung von NBT (Nitrobluttetrazolium-Test) - Diagnostik systemischer bakterieller Infektionen, die es ermöglicht, bakterielle Infektionen von anderen entzündlichen Erkrankungen zu unterscheiden. Das Verfahren basiert auf der Reduktion von löslichem NBT-Farbstoff durch Neutrophile zu einem unlöslichen Formazan-Präzipitat. Wenn die Anzahl NBT-positiver Zellen mehr als 10 % beträgt, gilt der Test als positiv. 3) Klinischer Bluttest zum Nachweis von Akute-Phase-Indikatoren: ein Anstieg der ESR auf 50 mm / h oder mehr, Leukozytose mit einer Verschiebung der Leukozytenformel nach links oder (im Stadium II) Leukopenie und hypochrome Anämie können nachgewiesen werden. Diagnostisch wertvoll ist der Nachweis von Histiozyten im Blut aus dem Ohrläppchen. Ihr Inhalt von mehr als 6 im Sichtfeld kann zugunsten von IE sprechen. Ein biochemischer Bluttest zeigt eine Erhöhung des Gehalts an Fibrinogen, α2-Globuline und α-Globuline - bis zu 30-40%. 4) Identifizierung von immunologischen Veränderungen: Hypergammaglobulinämie, zirkulierende Immunkomplexe, Abnahme des Komplementtiters, Auftreten von Rheumafaktor (Antiglobulin), erhöhte Reaktion der imperious Transformation von Lymphozyten mit PHA (Phytohämagglutinin) und bakteriellen Antigenen, Nachweis von Anti-Gewebe-Antikörpern. 5) Eine Urinanalyse wird durchgeführt, um die Läsionen verschiedener Organe und Systeme zu klären, wenn eine Glomerulonephritis festgestellt wird, die sich durch Proteinurie, Cylindrurie und Hämaturie manifestiert. Eine Erhöhung des Gehalts an Bilirubin, Transaminasen weist auf Leberschäden hin. 6) Ein direktes diagnostisches Zeichen von IE – das Vorhandensein von Vegetation auf den Herzklappen – wird durch Echokardiographie erkannt. Aus der ganzen Vielfalt der Symptome sollten daher die Haupt- und Nebensymptome unterschieden werden. Die Hauptkriterien für die Diagnose von IE: 1) Fieber mit einer Temperatur über 38 ° C mit Schüttelfrost; 2) Lukin-Flecken; 3) Osler-Knötchen; 4) Endokarditis an unveränderten Klappen (primär) oder vor dem Hintergrund rheumatischer und angeborener Herzfehler. infektiöse Myokarditis; 5) multiple arterielle Thromboembolien, Rupturen von mykotischen Aneurysmen mit Blutungen; 6) Splenomegalie; 7) positive Blutkultur; 8) ein ausgeprägter positiver Effekt durch den Einsatz von Antibiotika. Zusätzliche Kriterien für die Diagnose von IE: 1) eine Erhöhung der Körpertemperatur auf 38 ° C, Abkühlung; 2) Blutungen auf der Haut; 3) schneller Gewichtsverlust; 4) asymmetrische Arthritis der kleinen Gelenke der Hände, Füße; 5) Anemisierung; 6) ESR über 40 mm/h; 7) stark positiver SRV; 8) das Vorhandensein von Rheumafaktor; 9) α-Globuline über 25 %; 10) Erhöhung des Gehalts an Immunglobulinen M, E und A. Differenzialdiagnose. Obwohl Thromboembolien am häufigsten bei IE beobachtet werden, sollten andere Ursachen für Embolien in der Arterie des systemischen Kreislaufs nicht ausgeschlossen werden: transmuraler Myokardinfarkt und Herzaneurysma, idiopathische Abramov-Fiedler-Myokarditis und Vorhofflimmern unterschiedlicher Genese, die jedoch hauptsächlich bei rheumatischer Stenose beobachtet werden der linken atrioventrikulären Öffnung. Differenzialdiagnostisch von größter Bedeutung sind rheumatische und infektiöse Endokarditiden (Tabelle 7). Tabelle 7 Differentialdiagnostische Kriterien für rheumatische Endokarditis und prolongierte IE
Zu den charakteristischen Symptomen von IE gehört eine vergrößerte Milz. Bei Amyloidose ist jedoch eine große, feste, schmerzlose Milz zu sehen; weich, schmerzlos zeigt seine septische Hyperplasie an. Schmerzen werden bei einem subkapsulären Milzinfarkt festgestellt. Splenomegalie kann eine der Manifestationen von portaler Hypertension bei Rechtsherzinsuffizienz sein. In diesem Fall wird es mit Aszites und Hepatomegalie kombiniert. Eine Zunahme der Lebergröße bei längerer IE wird häufig beobachtet. Die septische Hyperplasie ist durch eine relativ geringe Vergrößerung und weiche Konsistenz der Leber gekennzeichnet. Es gibt fettige Degeneration und äußerst selten - Leberinfarkte. Am häufigsten ist eine Zunahme der Leber mit venöser Stauung bei Rechtsherzversagen verbunden. Bei fehlendem Aszites wird die Stauung retrospektiv durch eine Abnahme der Lebergröße nach Behandlung mit Herzglykosiden und Diuretika erkannt. Behandlung. Die Behandlung der IE sollte unter Berücksichtigung bakteriologischer Daten so früh und etiotrop wie möglich erfolgen. Bevor antibakterielle Medikamente in der medizinischen Praxis weit verbreitet waren, starben die meisten Patienten mit IE an einer Infektion und ihren Komplikationen. Mittlerweile sind mehr als 80 % erfolgreich geheilt. Doch bei fast 20 % ist die medikamentöse Behandlung wirkungslos und sie entwickeln bald eine Herzinsuffizienz, die nahezu unbehandelbar ist. In diesem Zusammenhang ist eine Kombination aus konservativer und chirurgischer Behandlung ratsam. Zur Behandlung der IE in allen Altersgruppen werden in erster Linie Antibiotika eingesetzt, die eine bakterizide Wirkung auf Mikroorganismen haben, vorzugsweise in individualisierter Dosierung je nach Konzentration des Antibiotikums im Blut und der Empfindlichkeit des Erregers dagegen. Das Medikament der ersten Wahl ist nach wie vor Penicillin. Es hat eine geringe Toxizität, wodurch es bei relativ hohen Dosierungen über einen langen Zeitraum verwendet werden kann. Die Tagesdosis - bis zu 20 IE wird intravenös und intramuskulär verabreicht. Es sollte jedoch nicht ausgeschlossen werden, dass bei älteren und senilen Patienten bei Behandlung mit Penicillin und anderen Antibiotika in hohen Dosen häufig eine kardiotoxische Wirkung beobachtet wird: Auftreten oder Verstärkung von Herzversagen, Herzschmerzen, Tachykardie. Wenn die Dosis reduziert oder das Medikament geändert wird, hören diese Phänomene auf. Bei unbekannter Ätiologie beginnt die Behandlung mit hohen Dosen von Benzylpenicillin intramuskulär oder intravenös bis zu 18-000 Einheiten oder mehr, einer Kombination mit Streptomycin bis zu 000 g / m pro Tag oder Aminoglykosiden (Gentamicin, Tobramycin in einer Menge von 20-000 mg / Tag) verwendet wird. kg pro Tag). Bei fehlender Wirkung oder nach Bestimmung des Erregers werden halbsynthetische Penicilline verwendet (Oxacillin, Methicillin oder Ampicillin intramuskulär bis zu 000 g / Tag). Цефалоспорины также являются базисными препаратами, применяемыми для лечения ИЭ: наиболее часто используют клафоран, цефамизин (1-4 г/сутки, внутримышечно и внутривенно), а также цепорин (6-12 г/сутки) и кефзол (до 4-10 г внутривенно usw.). Fusidin hat eine gute Anti-Staphylokokken-Wirkung, in einigen Fällen ist es bei der Resistenz von Mikroorganismen gegen andere Antibiotika wirksam (10-16 g / Tag). Eine Antibiotikabehandlung wird über einen Zeitraum von 1,5 bis 2 Monaten verschrieben, bis die Infektion vollständig beseitigt ist. Nach Beseitigung der Infektion verbessert sich der Allgemeinzustand des Patienten, die Vegetation verschwindet laut Echokardiographie und mikrobiologischer Bestätigung. Bei reduzierter Immunreaktivität des Organismus werden antibakterielle Mittel mit passiver Immuntherapie (z. B. bei Staphylokokken-Endokarditis - mit Antistaphylokokken-Plasma oder Antistaphylokokken-α-Globulin) unter Verwendung von Immunmodulatoren (Thymalin, T-Aktivin usw.) kombiniert. Zur Vorbeugung von Thrombosen, beispielsweise bei Endokarditis, die sich vor dem Hintergrund einer angiogenen Sepsis entwickelt hat, wird eine kontrollierte Hypokoagulation mit Heparin (20-000 IE intravenös oder subkutan) erzeugt. Zur Hemmung proteolytischer Enzyme wird Contrical verwendet (bis zu 25-000 IE intravenös). Wenn die valvuläre IE zur Entstehung einer Herzklappenerkrankung beigetragen hat oder die Manifestationen der Erkrankung trotz massiver Antibiotikatherapie nicht verschwinden, ist eine chirurgische Behandlung ratsam. Ein weiteres Argument für einen chirurgischen Eingriff sind wiederholte Embolien aus den durch Infektion zerstörten Herzklappensegeln. Manchmal geht die Infektion über die Grenzen des Klappenrings hinaus und bildet Abszesse, was auch eine Indikation für eine chirurgische Behandlung ist. Das Hauptziel der Operation ist der Erhalt der eigenen Klappe des Patienten. Manchmal beschränken sie sich auf das Entfernen von Vegetationen, das Nähen von Klappenbrüchen usw. Wenn die Klappe unter dem Einfluss einer Infektion fast vollständig zerstört wird, wird sie durch eine künstliche (Prothese) unter Verwendung mechanischer und biologischer Prothesen ersetzt. Vorbeugung. Die Vorbeugung von IE besteht in der rechtzeitigen Sanierung chronischer Infektionsherde in der Mundhöhle, den Mandeln, im Nasopharynx und in den Nasennebenhöhlen sowie in der Anwendung einer aktiven antibakteriellen Therapie bei akuten Streptokokken- und Staphylokokkenerkrankungen (Angina pectoris usw.). Es wird empfohlen, den Körper abzuhärten. Alle Patienten mit Herzklappenerkrankungen sowie mit Klappenprothesen sollten am Tag vor und kurz nach jedem Eingriff prophylaktisch Antibiotika einnehmen, danach kann eine Infektion in die Blutbahn gelangen. Eine stationäre Überwachung von Personen, die eine akute Streptokokken- oder Staphylokokkeninfektion hatten, ist erforderlich. VORTRAG Nr. 6. Erkrankungen der Atemwege. Bronchialasthma Eine erschöpfende Definition von Asthma existiert bis heute nicht, die vollständigste Definition dieser Krankheit wurde jedoch 1982 von G. B. Fedoseev gegeben. der wichtigste und obligatorische pathogenetische Mechanismus davon ist eine veränderte bronchiale Reaktivität aufgrund spezifischer (immunologischer) und (oder) unspezifischer, angeborener oder erworbener Mechanismen, und das wichtigste (obligatorische) klinische Zeichen ist ein Asthmaanfall und (oder) ein Asthma Zustand (asthmatischer Status) aufgrund von Krampf der glatten Bronchialmuskulatur, Hypersekretion, Dyskrinie und Ödem der Bronchialschleimhaut. Ätiologie. Bei der Entstehung von Asthma spielt das Zusammenspiel mehrerer Faktoren eine wichtige Rolle. In dieser Hinsicht gibt es zwei Formen von Asthma – atopisches (von lateinisch athopia – „erbliche Veranlagung“) und infektiös-allergisches. Die erbliche Veranlagung beruht auf der Assoziation bestimmter Histokompatibilitätsantigene (HLA) mit der Schwere des Asthmas, wobei eine Zunahme der Schwere der Erkrankung besonders häufig bei Trägern von B-Antigenen beobachtet wird35 und B40. Interne Faktoren bei der Entwicklung der Krankheit sind biologische Defekte im Immunsystem, im endokrinen System, im vegetativen Nervensystem, in der bronchialen Sensibilität und Reaktivität, in der mukoziliären Clearance, im pulmonalen Gefäßendothel, im Rapid-Response-System (Mastzellen usw.), im Metabolismus von Arachidonsäure, usw. Zu den externen Faktoren gehören: 1) infektiöse Allergene (Viren, Bakterien, Pilze, Hefe usw.); 2) nicht infektiöse Allergene (Pollen, Staub, Industrie, Medizin, Lebensmittel; Allergene von Zecken, Insekten und Tieren); 3) mechanische und chemische Reizstoffe (Metall-, Holz-, Silikat-, Baumwollstaub; Dämpfe von Säuren, Laugen; Dämpfe usw.); 4) meteorologische und physikalisch-chemische Faktoren (Änderungen der Lufttemperatur und -feuchtigkeit, Schwankungen des Luftdrucks, des Erdmagnetfelds, körperliche Anstrengung usw.); 5) stressige, neuropsychische Wirkungen und körperliche Aktivität. Infektionserreger können nicht nur allergen wirken, sondern auch die Empfindlichkeitsschwelle des Körpers gegenüber nicht infektiösen (atopischen) Allergenen senken, die Durchlässigkeit der Atemwegsschleimhaut für sie erhöhen; eine Veränderung der Reaktivität von Zielzellen (Mastzellen, Basophilen, Monozyten etc.) und Effektorsystemen zu bilden. Pathogenese. Eine veränderte bronchiale Reaktivität ist ein zentraler Zusammenhang in der Pathogenese der Erkrankung und kann primär oder sekundär sein. Im ersten Fall können Veränderungen der Reaktivität angeboren oder durch direkte Einwirkung chemischer, mechanischer, physikalischer Faktoren und Infektionen erworben sein. Sekundäre Veränderungen der bronchialen Reaktivität sind Ausdruck von Veränderungen in der Reaktivität des körpereigenen Immun-, Hormon- und Nervensystems. Wenn wir also über die Pathogenese der Alzheimer-Krankheit sprechen, können wir zwei Gruppen von Mechanismen unterscheiden: immunologische und nicht-immunologische. Immunologische Mechanismen dominieren in den allermeisten Fällen den Krankheitsverlauf. Verletzungen des immunkompetenten Systems in der Schleimhaut der Atemwege, die nach den Typen I, III und IV von Überempfindlichkeitsreaktionen auftreten, d.h. bei einer Veränderung der humoralen und zellulären Immunität, führen zu einer Veränderung der bronchialen Reaktivität. Gleichzeitig nimmt das sekretorische IgA ab, das Phagozytosesystem wird gestört, die T-Suppressor-Funktion der Lymphozyten nimmt ab, die Produktion von Interferon nimmt ab, was letztendlich zu einer Abnahme der körpereigenen antiviralen Abwehr führt. Typ I (atopisch, reaginisch oder anaphylaktisch). Als Reaktion auf die Aufnahme von Exoallergen-Antigenen (Pollen, tierische und pflanzliche Proteine, Bakterien und Medikamente) in den Körper kommt es zu einer erhöhten Produktion von IgE (Reagine), die an Mastzellen (primäre Effektorzellen) fixiert und angereichert werden. Dies ist das immunologische Stadium von AD. Anschließend entwickelt sich das pathochemische Stadium des Prozesses - Degranulation von Mastzellen mit Freisetzung von vasoaktiven, bronchospastischen und chemotaktischen Substanzen (Histamin, Serotonin, verschiedene chemotaktische Faktoren usw.). Dies sind primäre Mediatoren, die auf Blutgefäße und Zielzellen (sekundäre Effektorzellen) wirken - Eosinophile, Neutrophile, Blutplättchen, Makrophagen-Monozyten. Letztere sezernieren bei Kontakt mit primären Mediatoren sekundäre Mediatoren (Leukotriene, Prostaglandine, Thromboxane, plättchenaktivierender Faktor und andere Substanzen aus der Gruppe der Eicosanoide). Unter dem Einfluss biologisch aktiver Substanzen beginnt das pathophysiologische Stadium der Pathogenese: Die Durchlässigkeit des Mikrozirkulationsbetts nimmt zu, was zur Entwicklung von Ödemen, serösen Entzündungen und Bronchospasmen führt. Klinisch manifestiert sich dies durch eine akute Verletzung der bronchialen Durchgängigkeit und die Entwicklung eines Asthmaanfalls. Die Typ-III-Reaktion (Immunkomplex-Typ oder Arthus-Phänomen) entwickelt sich unter dem Einfluss von Exoallergenen und Endoallergenen (Autoallergene, die durch Denaturierung von Proteinen der Bronchiolen und Alveolen als Folge einer infektiösen oder allergischen Entzündung und der Wirkung verschiedener Reizstoffe gebildet werden). Die Reaktion erfolgt in der Zone des überschüssigen Antigens unter Beteiligung präzipitierender Antikörper, die zu den Immunglobulinen der Klassen O und M gehören. Die schädigende Wirkung des gebildeten Antigen-Antikörper-Komplexes wird durch Komplementaktivierung, die Freisetzung lysosomaler Enzyme, realisiert. Es kommt zu einer Schädigung der Basalmembranen, einem Krampf der glatten Muskulatur der Bronchien, einer Vasodilatation und einer Zunahme der Durchlässigkeit der Mikrogefäße. Typ IV (zelluläre Hypersensitivität vom verzögerten Typ) ist dadurch gekennzeichnet, dass sensibilisierte Lymphozyten schädigend wirken. In diesem Fall sind die Mediatoren der allergischen Reaktion Lymphokine (wirken auf Makrophagen, Epithelzellen), lysosomale Enzyme und ein aktiviertes Kininsystem. Unter dem Einfluss dieser Substanzen entwickeln sich Ödeme, Schwellungen der Schleimhaut, Bronchospasmus, Hyperproduktion von viskosen Bronchialsekreten. Die Folge ist eine akute Verletzung der Durchgängigkeit der Bronchien, die sich in einem Erstickungsanfall äußert. Nicht-immunologische Mechanismen sind die primäre Veränderung der bronchialen Reaktivität als Ergebnis angeborener und erworbener biologischer Defekte. Nicht-immunologische Mechanismen wirken auf primäre oder sekundäre Effektorzellen oder auf die Rezeptoren der glatten Muskulatur der Bronchien, Blutgefäße, Zellen der Bronchialdrüsen. Dadurch verändert sich die Reaktionsfähigkeit von Zielzellen und vor allem Mastzellen, was mit einer übermäßigen Produktion biologisch aktiver Substanzen (Histamin, Leukotriene etc.) einhergeht. Als Reaktion auf ihre Freisetzung entwickeln sich Bronchospasmus, Schwellung der Schleimhaut, Hyper- und Diskrinie der Bronchialdrüsen. All dies verändert die Durchgängigkeit der Bronchien dramatisch und verursacht einen Asthmaanfall. Der Bronchialwiderstand kann sich reflexartig bedingt und bedingungslos verändern. Beispielsweise werden Verstopfungen, die durch den Kontakt mit kalter Luft, das Einatmen reizender Gase und Stäube sowie durch körperliche Aktivität entstehen, durch Bronchospasmen über den Vagusreflex verursacht. Ursachen für Bronchospasmen können auch eine Schädigung der Effektorzonen des vagalen bronchokonstriktiven Reflexes oder eine Blockade β-adrenerger Rezeptoren sein. Kürzlich sprechen sie über eine besondere Rolle bei der Pathogenese von Verletzungen der bronchialen Durchgängigkeit bei Glucocorticoid-Insuffizienz und disovarischen Störungen. Ein Mangel an Glukokortikosteroiden führt zur Entwicklung einer Hyperreaktivität von Mastzellen, einer Abnahme der Katecholaminsynthese und einer Aktivierung von Prostaglandinen F2a, sowie eine Verletzung des immunkompetenten Systems (hier sprechen wir über die komplexe Beteiligung an der Pathogenese von AD und immunologischen und nicht-immunologischen Mechanismen). Hyperöstrogenämie und Hypoprogesteronämie wirken auf α- und β-adrenerge Rezeptoren, erhöhen die Aktivität der ersteren und verringern die Aktivität der letzteren. Einstufung. Das Vorherrschen des einen oder anderen Mechanismus in der Pathogenese von Asthma ermöglicht es uns, seine verschiedenen pathogenetischen Merkmale zu identifizieren. Derzeit wird die von G. B. Fedoseev (1982) vorgeschlagene Klassifizierung verwendet. Stadien der AD-Entwicklung. I - Präasthma (Zustände, die die Entwicklung bedrohen: akute und chronische Bronchitis, akute und chronische Lungenentzündung mit Elementen von Bronchospasmus in Kombination mit vasomotorischer Rhinitis, Urtikaria). II – klinisch gebildeter BA (wird als solcher nach dem ersten Anfall oder dem unmittelbaren Einsetzen des Status asthmaticus betrachtet). BA-Formulare: 1) immunologisch; 2) nicht-immunologisch. Pathogenetische Mechanismen (klinische und pathogenetische Varianten) von AD: 1) atopisch; 2) infektionsabhängig; 3) Autoimmun; 4) deshormonell; 5) neuropsychisches Ungleichgewicht; 6) adrenerges Ungleichgewicht; 7) cholinerges Ungleichgewicht; 8) primäre veränderte bronchiale Reaktivität. Bei einem Patienten ist eine Kombination mehrerer klinischer und pathogenetischer Varianten möglich. In einer solchen Situation ist es notwendig, zum Zeitpunkt der Untersuchung die Hauptvariante für diesen Patienten hervorzuheben, was für eine adäquate Therapie wichtig ist. Im Laufe eines langen BA-Verlaufs ist eine Veränderung des Pathogenesemechanismus möglich. Schweregrad von BA: 1) milder Verlauf (Exazerbationen sind selten, 2-3 mal im Jahr, kurzfristige Asthmaanfälle werden durch die Einnahme verschiedener Bronchodilatatoren im Inneren gestoppt); 2) moderat (häufigere Exazerbationen 3-4 Mal im Jahr, Asthmaanfälle sind schwerer und werden durch Injektionen von Medikamenten gestoppt); 3) schwerer Verlauf (gekennzeichnet durch häufige und anhaltende Exazerbationen, schwere Anfälle, die sich oft in einen asthmatischen Zustand verwandeln). Die Einteilung der BA nach Schweregrad des Verlaufs ist bedingt. Bei einem milden BA-Verlauf kann der Patient also an einem plötzlich entstandenen Status asthmaticus versterben. Phasen des BA-Studiums: 1) Exazerbation (das Vorhandensein von wiederkehrenden Asthmaanfällen oder asthmatischen Zuständen); 2) abklingende Exazerbation (Schübe werden seltener und milder, körperliche und funktionelle Krankheitszeichen sind weniger ausgeprägt als in der Exazerbationsphase); 3) Remission (typische Manifestationen von BA verschwinden: Asthmaanfälle treten nicht auf; bronchiale Durchgängigkeit wird vollständig oder teilweise wiederhergestellt). Komplikationen: 1) pulmonal: Emphysem, Lungeninsuffizienz, Atelektase, Pneumothorax, Status asthmaticus usw.; 2) extrapulmonal: Cor pulmonale (kompensiert und dekompensiert mit der Entwicklung einer Rechtsherzinsuffizienz), Myokarddystrophie usw. Klinisches Bild. Das charakteristischste Anzeichen von Asthma sind Beschwerden über Erstickungsanfälle (Atembeschwerden hauptsächlich beim Ausatmen), Kurzatmigkeit und Husten verschiedener Art (trocken, paroxysmal oder mit der Freisetzung von zähem Auswurf). Die Entwicklung einer bronchopulmonalen Infektion führt zu einem Anstieg der Körpertemperatur. Die daraus resultierenden Schwierigkeiten bei der Nasenatmung sind Ausdruck einer allergischen Rhinosinusopathie (vasomotorische Rhinitis, Polyposis), die meist in der Präasthmaphase auftritt. Anamnesedaten helfen dabei, einen Zusammenhang zwischen der Entwicklung von Anfällen und der Exposition gegenüber bestimmten Allergenen und anderen Faktoren herzustellen. Meistens handelt es sich um eine Infektion der Atemwege, insbesondere bei einer Verschlimmerung der Erkrankung. Aus der Anamnese erfahren sie über den Einfluss körperlicher Anstrengung (z. B. zügiges Gehen, Lachen etc.), Veränderungen meteorologischer Faktoren (z. B. Kälte, hohe Luftfeuchtigkeit etc.), disovariale Störungen, berufliche Faktoren auf das Auftreten von Asthma Anschläge. Die Untersuchung einer allergischen Vorgeschichte trägt zur Diagnose einer atopischen BA-Variante bei. In solchen Fällen sind Verschlimmerungen der Krankheit saisonal (häufiger im Frühjahr und Sommer), begleitet von Rhinitis, Konjunktivitis. Solche Patienten haben Urtikaria, Quincke-Ödem; Nahrungsmittelunverträglichkeit, eine Reihe von Arzneimitteln werden nachgewiesen; Es besteht eine erbliche Veranlagung zu allergischen Erkrankungen. Daten aus der Anamnese erlauben oft den Nachweis des sogenannten Aspirin-Asthma. In diesem Fall gibt es keine erbliche Form von allergischen Erkrankungen. Solche Patienten sind besorgt über eine beeinträchtigte Nasenatmung (polypöse Wucherungen), und das charakteristischste Symptom ist eine Unverträglichkeit gegenüber nichtsteroidalen entzündungshemmenden Arzneimitteln (Acetylsalicylsäure, Indomethacin usw.), die Asthmaanfälle verursachen. In diesem Fall kann bereits von einem Prostaglandin-Mechanismus der AD ausgegangen werden. Daten zur Entwicklung des Asthmastatus in der Vergangenheit weisen auf die Schwere des Krankheitsverlaufs hin und weisen auf die Notwendigkeit einer Kortikosteroidtherapie hin. Diagnostik. Von großer Bedeutung ist die Identifizierung extrapulmonaler Manifestationen von Allergien, Anzeichen einer Bronchoobstruktion, Komplikationen von Asthma und anderen Erkrankungen, die mit Bronchospasmus-Anfällen einhergehen. Bei der Untersuchung der Haut können allergische Manifestationen festgestellt werden: Urtikaria, papulöse erythematöse Hautausschläge, was auf eine immunologische Variante von BA hinweist. Die Kombination von Asthma mit Ekzemen, Neurodermitis, Psoriasis prädisponiert zu schwerem Asthma. Oft ist es möglich, eine Verletzung der Nasenatmung zu erkennen. Rhinitis und Polypen gelten als Präasthma. Sinusitis und andere Sinusitis können Ersticken verursachen. Die körperliche Untersuchung der Lunge, oft aufgrund einer zugrunde liegenden chronischen Bronchitis, kann Anzeichen eines Emphysems zeigen, was zur Entwicklung einer chronischen Ateminsuffizienz und eines Cor pulmonale führt. Auskultatorische Anzeichen einer Bronchialobstruktion werden festgestellt: eine Veränderung der Atmung (langes Ausatmen, trocken, meist Keuchen, Keuchen), forcierte Ausatmung, die einen latenten Bronchospasmus (Auftreten oder Anstieg von trockenem Keuchen) offenbart. Die Auskultation der Lunge muss in der Position des liegenden Patienten durchgeführt werden: Die Anzahl der trockenen Rasseln nimmt mit ihrem "vagalen" Mechanismus zu. Ständig in einem bestimmten Bereich abgehörtes, feucht stimmhaftes ("knisternde"), fein blubberndes Rasseln kann auf eine entwickelte Pneumosklerose hindeuten. Eine objektive Untersuchung des Patienten zeigt Symptome anderer Krankheiten ("Schmetterling" auf der Gesichtshaut, Lymphadenopathie in Kombination mit Leber- und Milzanstieg, anhaltender Blutdruckanstieg, anhaltendes Fieber usw.), bei denen Anfälle von Bronchospasmen treten auf, die sich durch Ersticken äußern (systemischer Lupus erythematodes, noduläre Periarteriitis). Dann wird die angebliche AD-Diagnose unwahrscheinlich. Die Spirographie zeigt die charakteristischen Zeichen einer obstruktiven Bronchialobstruktion: eine Abnahme des forcierten Exspirationsvolumens in der ersten Sekunde (FEV1), eine Abnahme des Tiffno-Koeffizienten (FEV1 zu VC als Prozentsatz) und der Prozentsatz von FEV1 zu FZhEL. Während einer Exazerbation von BA überschreiten das Lungenrestvolumen (RLV) und die funktionelle Residualkapazität (FOC) das Ausgangsniveau um 100 % oder mehr. Bei der Analyse des Spirogramms werden Anzeichen einer tracheobronchialen Dyskinesie festgestellt, die durch das Vorhandensein einer Kerbe im oberen Teil der absteigenden Farbe des Spirogramms (Kolbet-Wyss-Symptom) zur Verletzung der bronchialen Durchgängigkeit beitragen. Die Pneumotachometrie zeigt das Vorherrschen der Inspirationskraft gegenüber der Exspirationskraft, was charakteristisch für eine Bronchialobstruktion ist. Gemäß der Pneumotachographie mit der Konstruktion der Fluss-Volumen-Kurve wird eine Verletzung der bronchialen Durchgängigkeit auf der Ebene der großen, mittleren und kleinen Bronchien getrennt diagnostiziert. Das Auftreten eines erhöhten bronchialen Widerstands, aufgezeichnet mittels Spirographie, Pneumotachometrie und Pneumotachographie, als Reaktion auf körperliche Aktivität, Einatmen von kalter Luft, Reizgasen und Acetylcholin weist auf eine veränderte bronchiale Reaktivität hin. Allergologische Tests werden mit einer Reihe verschiedener nicht infektiöser und infektiöser Allergene durchgeführt und nur außerhalb der Verschlimmerung der Krankheit durchgeführt. Um die provokative Wirkung des Allergens zu beurteilen, werden Hautallergietests durchgeführt (Auftragen, Skarifizieren und intradermale Methoden zum Auftragen des Allergens), das Allergen kann auf die Bindehaut des Auges, die Nasenschleimhaut, aufgetragen werden. Am zuverlässigsten ist die spezifische Diagnose von Asthma - die Identifizierung einer spezifischen bronchialen Hyperreaktivität mit Hilfe von Inhalationsprovokationstests. Allerdings sollte man nicht aus den Augen verlieren, dass dieser Verabreichungsweg einen schweren Asthmaanfall oder die Entwicklung eines Status asthmaticus provozieren kann. Für die spezifische Diagnostik der BA, zum Beispiel wenn eine allergologische Testung nicht möglich ist, wird auch ein Radioimmunosorbent-Test eingesetzt, der eine Quantifizierung von IgE-Antikörpern ermöglicht. Laboruntersuchungen helfen, die vorgeschlagene Diagnose zu bestätigen, die Entwicklung der Krankheit und die Wirksamkeit der Behandlung zu bewerten. Das wichtigste diagnostische Kriterium für Asthma ist das Auftreten von Eosinophilen im Sputum, aber dies ist ein unspezifisches Symptom, es kann als Manifestation einer allgemeinen allergischen Reaktion des Körpers dienen. Diagnostisch wertvoll ist auch der Nachweis von Kurshman-Spiralen und Charcot-Leiden-Kristallen im Sputum. Laborstudien belegen das Vorhandensein eines aktiven Entzündungsprozesses und den Grad seiner Schwere im Hinblick auf einen Anstieg der Indikatoren der akuten Phase. Bei einer Zunahme der Ateminsuffizienz bei Exazerbation von Asthma und Status asthmaticus ist es wichtig, den Säure-Basen-Zustand und die Blutgaszusammensetzung zu untersuchen. Röntgenuntersuchung diagnostiziert Infektionsherde (in den Nasennebenhöhlen, Zähnen, Gallenblase) und das Vorhandensein von akuten (Lungenentzündung) oder Exazerbation eines chronischen Entzündungsprozesses in der Lunge, Emphysem und Pneumosklerose. EKG-Daten belegen Anzeichen für die Entwicklung eines kompensierten Cor pulmonale - Hypertrophie des rechten Herzens. Differenzialdiagnose. BA wird vom Herzasthma unterschieden (siehe Tabelle 8). Tabelle 8 Differentialdiagnose von AD
Außerdem muss zwischen infektiös-allergischem und atopischem Asthma unterschieden werden (siehe Tabelle 9). Tabelle 9 Infektiös-allergisches und atopisches Asthma
Behandlung. Bei der Behandlung von Asthma wird ein schrittweises Vorgehen empfohlen, was durch die unterschiedliche Schwere des Verlaufs bei verschiedenen Personen und beim gleichen Patienten erklärt wird. Stadium 1 ist das am wenigsten schwere Asthma, Stadium 4 das schwerste. Stufe 1: Ein milder intermittierender Verlauf, bei dem Asthmasymptome bei Exposition gegenüber einem Auslöser (z. B. Pollen oder Tierhaare) oder aufgrund körperlicher Betätigung auftreten. Eine langfristige Anwendung von entzündungshemmenden Arzneimitteln bei der Behandlung solcher Patienten ist nicht angezeigt. Die Behandlung besteht aus prophylaktischen Medikamenten, falls erforderlich (inhalatives β2Agonisten, Cromoglycat, Nedocromil oder Anticholinergika). Gelegentlich erfordern schwerere und anhaltende Exazerbationen eine kurze Behandlung mit oralen Kortikosteroiden. Wenn sich Asthma mit häufigeren Symptomen und einem erhöhten Bedarf an Bronchodilatatoren manifestiert, muss zur nächsten Stufe übergegangen werden. Stufe 2. Leicht anhaltender Verlauf. Die Primärtherapie umfasst entzündungshemmende Medikamente, inhalative Kortikosteroide, Natriumcromoglycat oder Nedocromil-Natrium. Die Dosierung von Kortikosteroiden beträgt 200-500 Mikrogramm Beclomethasondipropionat oder Budesonid pro Tag. Zur symptomatischen Behandlung inhaliertes β2-Agonisten, aber nicht mehr als 3-4 mal am Tag. Bei schwereren und länger andauernden Exazerbationen wird eine kurze Behandlung mit oralen Kortikosteroiden durchgeführt. Wenn die Symptome trotz einer Anfangsdosis von inhalativen Kortikosteroiden anhalten, sollte die Dosis von Beclomethasondipropionat auf 750-800 Mikrogramm pro Tag erhöht werden. Eine Alternative zur Erhöhung der Dosis inhalierter Hormone, insbesondere zur Kontrolle nächtlicher Asthmaanfälle, ist jedoch die Zugabe von langwirksamen Bronchodilatatoren, die nachts eingenommen werden (in einer Dosis von inhalativen Kortikosteroiden von mindestens 500 Mikrogramm). Stadium 3 ist durch einen moderaten Schweregrad von BA gekennzeichnet. Solche Patienten benötigen eine tägliche Einnahme von prophylaktischen entzündungshemmenden Arzneimitteln. Die Dosis von inhalativen Kortikosteroiden beträgt 800-2000 mcg in Kombination mit langwirksamen Bronchodilatatoren. Sie können lang wirkende Theophylline (mit ständiger Überwachung ihrer Konzentration nicht mehr als 5-15 µg / ml), oral und inhalativ β verwenden2lang wirkende Agonisten. Symptomatisch ernennen β2-kurz wirksame Agonisten oder alternative Medikamente (Stadium 2). Stadium 4. Schweres Asthma, wenn es nicht vollständig unter Kontrolle ist. In diesem Fall ist das Ziel der Behandlung, bestmögliche Ergebnisse zu erzielen. Die Primärbehandlung umfasst hochdosierte inhalative Kortikosteroide (zwischen 800 und 2000 Mikrogramm Beclomethasondipropionat pro Tag) in Kombination mit langwirksamen Bronchodilatatoren. Gegebenenfalls ist inhaliertes β zur Linderung der Symptome indiziert.2-kurz wirkende Agonisten (nicht mehr als 3-4 mal täglich). Eine schwerere Exazerbation kann eine Behandlung mit oralen Kortikosteroiden erfordern, die in minimalen Dosen oder jeden zweiten Tag verschrieben werden. Um die Entwicklung von Nebenwirkungen zu verhindern, werden hohe Dosen von inhalativen Kortikosteroiden über einen Abstandshalter verabreicht. Schritt 5 beinhaltet die Reduzierung unterstützender Medikamente. Dies ist möglich, wenn das Asthma mindestens 3 Monate unter Kontrolle bleibt, was dazu beiträgt, das Risiko von Nebenwirkungen zu verringern und die Anfälligkeit des Patienten für die geplante Behandlung zu erhöhen. "Reduktion" der Behandlung wird unter ständiger Kontrolle von Symptomen, klinischen Manifestationen und Indikatoren der Atemfunktionen durchgeführt, indem die letzte Dosis oder zusätzliche Medikamente schrittweise reduziert (aufgehoben) werden. Angriffe stoppen. Ein leichter Anfall kann zu Hause mit kurzwirksamen Bronchodilatatoren behandelt werden. Die Behandlung wird bis zum vollständigen Verschwinden der Symptome durchgeführt. Mittelschwere und schwere Anfälle erfordern nicht nur ausreichende Dosen kurzwirksamer Bronchodilatatoren (inhalatives β2-kurz wirkende Agonisten), sondern auch die Ernennung von systemischen Kortikosteroiden. Wenn der Patient Hypoxämie hat, sollte Sauerstoff verabreicht werden. Zur Behandlung von Asthmaanfällen in einem medizinischen Zentrum oder Krankenhaus werden hohe Dosen von inhaliertem β2Agonisten durch einen Vernebler. Die Verwendung eines Aerosol-Inhalators mit abgemessener Dosis durch einen Abstandshalter ist sehr effektiv. Kortikosteroide werden vorzugsweise oral und nicht intravenös verabreicht. Bei Verwendung von Theophyllin oder Aminophyllin in Kombination mit hohen Dosen von β2-Agonisten zusätzliche bronchodilatatorische Wirkung ist nicht vorgesehen, aber das Risiko von Nebenwirkungen steigt. Theophylline können nur in Abwesenheit von β verwendet werden2-Agonisten können jedoch intravenös mit einer Rate von 6 mg/kg Aminophyllin (oder 5 mg/kg Theophyllin) mit einer konstanten Dosis von 0,5–1,0 mg/kg pro Stunde für 24 Stunden verabreicht werden2Kurz wirkende Agonisten können auch Epinephrin verwenden, aber bei seiner Verwendung sind erhebliche Nebenwirkungen möglich. Inhalative Mukolytika, Beruhigungsmittel und Antihistaminika, Magnesiumsulfat, Brustphysiotherapie, Flüssigkeitszufuhr mit großen Flüssigkeitsmengen für Erwachsene und ältere Kinder werden zur Behandlung von Asthmaanfällen nicht empfohlen, um verstärkten Husten zu vermeiden. Vorbeugung. Die primäre Asthmaprävention umfasst die Behandlung von Patienten in einem Zustand vor Asthma, die Identifizierung biologischer Defekte bei praktisch gesunden Personen mit einer Familienanamnese, die eine Gefahr für das Auftreten von Asthma darstellen, die Beseitigung potenziell gefährlicher Allergene, Reizstoffe und anderer Faktoren aus dem Asthma Umgebung von Patienten, die zur Entwicklung der Krankheit führen können. Bei der Behandlung von Patienten in einem Zustand von Preasthma ist es notwendig, die Infektionsherde zu desinfizieren, allergische Rhinosinusopathie zu behandeln, verschiedene Methoden der nicht-medikamentösen Behandlung anzuwenden, einschließlich Akupunktur und Psychotherapie, Bewegungstherapie, Barotherapie und Spa-Behandlung. Es ist die Durchführung der spezifischen und nicht spezifischen Hyposensibilisierung vorgeführt. VORTRAG Nr. 7. Erkrankungen des Atmungssystems. Chronische Bronchitis Die chronisch obstruktive Bronchitis ist eine diffuse nicht allergische entzündliche Läsion des Bronchialbaums, verursacht durch anhaltende Reizwirkung auf die Bronchien verschiedener Wirkstoffe, die einen progressiven Verlauf hat und durch obstruktive Lungenventilation, Schleimbildung und die Drainagefunktion der Bronchien gekennzeichnet ist Baum, der sich durch Husten, Auswurf und Atemnot äußert. Wenn ein Patient mehr als 3 Jahre lang mindestens 2 aufeinanderfolgende Monate an den meisten Tagen Sputum abhustet, spricht man nach der WHO-Definition von einer chronischen Bronchitis (CB). Chronische Bronchitis wird in primäre und sekundäre unterteilt. Primäre chronische Bronchitis ist eine eigenständige Erkrankung, die nicht mit anderen bronchopulmonalen Prozessen oder Schäden an anderen Organen und Systemen verbunden ist, bei denen eine diffuse Läsion des Bronchialbaums vorliegt. Sekundäre CB entwickelt sich vor dem Hintergrund anderer Erkrankungen - sowohl pulmonal (Tuberkulose, Bronchiektasen usw.) als auch extrapulmonal (Urämie, kongestive Herzinsuffizienz usw.). Meistens ist es lokaler Natur (segmental). Betrachten Sie primäre HB. Ätiologie. Sowohl exogene Faktoren (Tabakrauch, Luftverschmutzung, ungünstige berufliche Bedingungen, klimatische und infektiöse Faktoren) als auch endogene Faktoren (Pathologie des Nasopharynx, beeinträchtigte Atmung durch die Nase, wiederholte akute Atemwegserkrankungen, akute Bronchitis und fokale Infektionen der oberen Atemwege) spielen eine Rolle bei der Entwicklung von CB-Signalwegen, erblicher Veranlagung und Stoffwechselstörungen (Fettleibigkeit). Pathogenese. Unter dem Einfluss exogener und unter Beteiligung endogener Faktoren im Tracheobronchialbaum verändern sich die strukturellen und funktionellen Eigenschaften der Schleimhaut und der Submukosaschicht, es kommt zu einer Entzündung der Schleimhaut und die Durchgängigkeit und Drainagefunktion der Bronchien wird gestört. Strukturelle und funktionelle Veränderungen der Schleimhaut und der Submukosaschicht äußern sich in Hyperplasie und Überfunktion von Becherzellen, Bronchialdrüsen, Hypersekretion von dickem und zähem Schleim, was zu einer Störung des mukoziliären Transportsystems führt. Die Menge an produziertem sekretorischem IgA-Lysozym und Lactoferrin ist reduziert. Es entwickelt sich ein Ödem der Schleimhaut und dann - Atrophie und Metaplasie des Epithels. Eine Entzündung der Schleimhaut wird durch verschiedene Reizstoffe in Kombination mit einer Infektion (viral und bakteriell) verursacht. In der Luft enthaltene chemische Stoffe (Schadstoffe) wirken schädigend auf die Atemwege, es kommt zu Schleimhautschwellungen und zu einer Hemmung der Aktivität des Flimmerepithels. Dies führt zu einer Verletzung der Evakuierung und einer Abnahme der Barrierefunktion der Bronchialschleimhaut. Der katarrhalische Inhalt wird durch katarrhalisch-eitrig und dann eitrig ersetzt. Die Ausbreitung des Entzündungsprozesses auf die distalen Abschnitte des Bronchialbaums stört die Surfactant-Produktion und reduziert die Aktivität von Alveolarmakrophagen, die Fremdpartikel phagozytieren. Ist der bei einer Entzündung auftretende Bronchospasmus ausgeprägt, dann entwickelt sich eine bronchospastische (nicht allergische) Komponente. Die damit verbundene Infektion während der Exazerbation der Entzündung trägt zur Entwicklung einer asthmatischen (allergischen) Komponente bei, die es ermöglicht, ein solches CB einem Prä-Asthma zuzuordnen. Das obstruktive Syndrom entwickelt sich aufgrund einer Kombination mehrerer Faktoren: 1) Krämpfe der glatten Muskulatur der Bronchien als Folge irritierender Wirkungen exogener Faktoren und entzündlicher Veränderungen der Schleimhaut; 2) Hypersekretion von Schleim, Veränderungen seiner rheologischen Eigenschaften, die zu einer Störung des mukoziliären Transports und einer Verstopfung der Bronchien mit einem viskosen Geheimnis führen; 3) Epithelmetaplasie von zylindrischem bis stratifiziertem Plattenepithel und dessen Hyperplasie; 4) Verstöße gegen die Herstellung von Tensiden; 5) entzündliches Ödem und Schleimhautinfiltration; 6) Kollaps der kleinen Bronchien und Verödung der Bronchiolen; 7) allergische Veränderungen der Schleimhaut. Wenn großkalibrige Bronchien an dem Prozess beteiligt sind (proximale Bronchitis), wird keine Bronchialobstruktion ausgedrückt. Bei einer Schädigung kleiner und mittlerer Bronchien tritt jedoch eine ausgeprägte Verletzung der bronchialen Durchgängigkeit auf. Bei einer isolierten Läsion kleiner Bronchien (distaler Bronchitis) ohne Hustenrezeptoren kann Kurzatmigkeit jedoch der einzige Hinweis auf eine entwickelte Bronchitis sein, und Husten tritt auf, wenn größere Bronchien an dem Prozess beteiligt sind. Verschiedene Verhältnisse von Veränderungen in der Schleimhaut verursachen die Bildung einer bestimmten klinischen Form: 1) bei katarrhalischer nicht obstruktiver Bronchitis überwiegen oberflächliche Veränderungen der strukturellen und funktionellen Eigenschaften der Schleimhaut; 2) bei mukopurulenter (eitriger) Bronchitis überwiegen die Prozesse der infektiösen Entzündung. Es ist aber auch möglich, dass eine lang anhaltende katarrhalische Bronchitis durch Hinzufügung einer Infektion schleimig-eitrig werden kann usw. Bei der nicht-obstruktiven Variante aller klinischen Formen der chronischen Bronchitis sind Ventilationsstörungen leicht ausgeprägt; 3) obstruktive Störungen treten zunächst nur vor dem Hintergrund einer Verschlimmerung der Erkrankung auf und werden durch entzündliche Veränderungen der Bronchien, Hyper- und Dyskrinie, Bronchospasmus (reversible Komponenten der Obstruktion) verursacht, bleiben dann aber konstant bestehen, während das obstruktive Syndrom zunimmt langsam. Bei der obstruktiven chronischen Bronchitis überwiegen Schleimhaut- und Submukosaverdickungen, Ödeme und Hypersekretion, außerdem sind anhaltende Ventilationsstörungen charakteristisch. Entwickelte Obstruktion der kleinen Bronchien führt zu Emphysem. Dabei durchläuft HB eine gewisse Evolution. Als Folge der Entwicklung von Emphysem und Pneumosklerose wird eine ungleichmäßige Belüftung der Lunge festgestellt, es bilden sich hyper- und hypoventilierte Bereiche. In Kombination mit lokalen entzündlichen Veränderungen führt dies zu einem gestörten Gasaustausch, Atemversagen, arterieller Hypoxämie und pulmonaler Hypertonie, gefolgt von der Entwicklung des wichtigsten lebensbedrohlichen Zustands - des rechtsventrikulären Versagens. Einstufung. Derzeit gibt es keine allgemein anerkannte Klassifizierung von CB. Wichtig ist die Einteilung der CB in obstruktive und nicht-obstruktive Varianten, bei denen sich jeweils ein katarrhalischer (schleimiger), katarrhalisch-eitriger oder eitrig-entzündlicher Prozess entwickeln kann. Die Klassifizierung umfasst auch seltene Formen - hämorrhagisches und fibrinöses CB. Je nach Grad der Bronchialschädigung unterscheiden sie: bei einer vorherrschenden Läsion große Bronchien (proximale Bronchitis) und bei einer vorherrschenden Läsion kleiner Bronchien (distale Bronchitis) (N. R. Paleev, 1985). Klinisches Bild. Die Hauptsymptome von CB sind Husten, Auswurf und Atemnot. Bei einer Verschlimmerung der Erkrankung oder aufgrund einer Hypoxie mit der Entwicklung von Lungenversagen und anderen Komplikationen werden allgemeine Symptome festgestellt (Schwitzen, Schwäche, erhöhte Körpertemperatur, Müdigkeit usw.). Husten ist die typischste Manifestation der Krankheit. Aufgrund der Beschaffenheit und Konsistenz des Auswurfs kann man von einer Variante des Krankheitsverlaufs ausgehen. Bei der nicht obstruktiven Variante der katarrhalischen Bronchitis geht der Husten mit der Freisetzung einer kleinen Menge schleimigen, wässrigen Auswurfs einher (normalerweise morgens, nach dem Training oder aufgrund verstärkter Atmung). Zu Beginn der Krankheit stört der Husten den Patienten nicht; Das Auftreten von paroxysmalem Husten weist auf die Entwicklung einer Bronchialobstruktion hin. Der Husten nimmt einen bellenden Ton an und ist paroxysmaler Natur mit ausgeprägtem exspiratorischem Kollaps der Luftröhre und der großen Bronchien. Bei eitriger und schleimig-eitriger Bronchitis sind die Patienten eher besorgt über das Abhusten von Sputum. Im Falle einer Verschlimmerung der Krankheit nimmt der Auswurf einen eitrigen Charakter an, seine Menge nimmt zu, manchmal wird der Auswurf mit Schwierigkeiten ausgeschieden (aufgrund einer Bronchialobstruktion während der Verschlimmerung). Bei der obstruktiven Variante der Bronchitis ist der Husten unproduktiv und hackend, begleitet von Atemnot, mit etwas Auswurf. Kurzatmigkeit tritt bei allen Patienten mit chronischer Bronchitis zu unterschiedlichen Zeiten auf. Das Auftreten von Atemnot bei „Langzeithusten“-Patienten mit anfänglich erheblicher körperlicher Anstrengung deutet auf eine zusätzlich bronchiale Obstruktion hin. Mit fortschreitender Erkrankung wird die Atemnot ausgeprägter und konstanter, d.h. es entwickelt sich eine respiratorische (pulmonale) Insuffizienz. Bei der nicht-obstruktiven Variante schreitet CB langsam voran, Atemnot tritt meist 20-30 Jahre nach Ausbruch der Erkrankung auf. Solche Patienten beheben fast nie den Ausbruch der Krankheit, sondern weisen nur auf das Auftreten von Komplikationen oder häufigen Exazerbationen hin. Es gibt eine Vorgeschichte von Überempfindlichkeit gegen Kälte, und die meisten Patienten berichten über langjähriges Rauchen. Bei einer Reihe von Patienten ist die Krankheit mit Berufsrisiken bei der Arbeit verbunden. Bei der Analyse einer Hustenanamnese muss sichergestellt werden, dass der Patient keine andere Pathologie des Bronchopulmonalapparats (Tuberkulose, Tumore, Bronchiektasen, Pneumokoniose, systemische Erkrankungen des Bindegewebes usw.) hat, die von denselben Symptomen begleitet werden. Manchmal weist eine Anamnese auf eine Hämoptyse aufgrund einer leichten Anfälligkeit der Bronchialschleimhaut hin. Rezidivierende Hämoptysen weisen auf eine hämorrhagische Form der Bronchitis hin. Darüber hinaus kann Hämoptyse bei chronischer, langfristiger Bronchitis das erste Symptom von Lungenkrebs oder Bronchiektasen sein. Diagnostik. Die Auskultation zeigt schweres Atmen (mit der Entwicklung eines Emphysems kann es geschwächt werden) und trockenes, vereinzeltes Keuchen, dessen Klangfarbe vom Kaliber der betroffenen Bronchien abhängt (keuchendes, beim Ausatmen deutlich hörbares Keuchen ist charakteristisch für eine Schädigung kleiner Bronchien). ). Änderungen der Auskultationsdaten sind bei chronischer nicht-obstruktiver Bronchitis in Remission minimal und am ausgeprägtesten während einer Exazerbation des Prozesses (Nassrasseln unterschiedlichen Kalibers, die nach einem guten Husten und Auswurf verschwinden können). Mit einer Verschlimmerung der obstruktiven Bronchitis nimmt die Atemnot zu, die Phänomene des Atemversagens nehmen zu. Ein eitriges zähflüssiges Geheimnis erschwert die Durchgängigkeit der Bronchien zusätzlich. Die obstruktive Komponente, die sich sowohl der katarrhalischen als auch der mukopurulenten Form der Bronchitis angeschlossen hat und während der Zeit der Exazerbation oder im Laufe ihrer Entwicklung den Verlauf der Bronchitis erheblich verschlimmert. Zeichen einer Bronchialobstruktion: Verlängerung der Exspirationsphase mit ruhiger und vor allem forcierter Atmung; Keuchen beim Ausatmen (besser auskultierbar bei forcierter Atmung und in Rückenlage); Symptome eines obstruktiven Lungenemphysems. In fortgeschrittenen Fällen von chronischer Bronchitis und mit zusätzlichen Komplikationen treten Anzeichen eines Lungenemphysems, respiratorischer und kardialer (rechtsventrikulärer) Insuffizienz - dekompensiertes Lungenherz auf: Akrozyanose, Pastosität oder Schwellung der Beine und Füße, Veränderungen der Nägel in die Form von Uhrgläsern und die Endphalangen der Hände und Füße - in Form von Trommelstöcken, Schwellung der Halsvenen, Pulsieren in der Magengegend aufgrund des rechten Ventrikels, Akzent des II-Tons im II-Interkostal Raum links vom Brustbein, Lebervergrößerung. Beeinflusst das Krankheitsbild und die Hinzufügung einer asthmatischen (allergischen) Komponente, wenn eine Ähnlichkeit mit Asthma bronchiale besteht. Labor- und instrumentelle Indikatoren haben je nach Prozessstufe unterschiedliche Aussagekraft. In der Anfangsphase der Erkrankung oder in der Remissionsphase dürfen keine Veränderungen auftreten. Diese Indikatoren sind jedoch von großer Bedeutung, um die Aktivität des Entzündungsprozesses zu identifizieren; Abklärung der klinischen Form der Erkrankung; Identifizieren von Komplikationen; Differentialdiagnose bei Krankheiten mit ähnlichen klinischen Symptomen. Bei allen Patienten mit chronischer Bronchitis wird eine Röntgenuntersuchung der Brustorgane durchgeführt, in der Regel treten jedoch auf Röntgenaufnahmen keine Veränderungen in der Lunge auf. Aufgrund der Entwicklung einer Pneumosklerose kann es zu einer Maschenverformung des Lungenmusters kommen. Bei einem langen Verlauf des Prozesses zeigen sich Anzeichen eines Emphysems. Mit der Entwicklung des Lungenherzens erscheint eine Ausbuchtung des Stammes der Lungenarterie auf der linken Kontur des Schattens des Herzens, eine Erweiterung der Basalarterien, gefolgt von ihrer kegelförmigen Verengung und einer Abnahme des peripheren Durchmessers Geäst. Die Röntgenuntersuchung spielt eine wichtige Rolle bei der Diagnose von Komplikationen (akute Lungenentzündung, Bronchiektasen) und bei der Differentialdiagnose bei Erkrankungen mit ähnlichen Symptomen. Bronchographie wird nur verwendet, um Bronchiektasen zu diagnostizieren. Die Bronchoskopie ist von großer Bedeutung für die Diagnostik der chronischen Bronchitis und deren Abgrenzung zu Erkrankungen mit ähnlichem Krankheitsbild. Es bestätigt das Vorhandensein eines entzündlichen Prozesses; klärt die Art der Entzündung (die Diagnose einer hämorrhagischen oder fibrinösen Bronchitis wird erst nach dieser Studie gestellt); zeigt Funktionsstörungen des Tracheobronchialbaums (es ist besonders wichtig, den Ausatmungskollaps zu identifizieren - Dyskinesie der Luftröhre und der großen Bronchien); hilft bei der Identifizierung organischer Läsionen des Bronchialbaums. Darüber hinaus können Sie mit der Bronchoskopie den Inhalt der Bronchien oder Spülungen für mikrobiologische, parasitologische und zytologische Untersuchungen erhalten. Die Untersuchung der Funktion der äußeren Atmung wird durchgeführt, um restriktive und obstruktive Störungen der Lungenventilation zu identifizieren. Gemäß dem Spirogramm wird der Tiffno-Index berechnet (das Verhältnis des forcierten Ausatmungsvolumens in 1 s - FEV1 zur Vitalkapazität der Lunge - VC in Prozent) und ein Indikator für die Luftgeschwindigkeit - PSV (das Verhältnis der maximalen Ventilation der Lunge - MVL zu VC). Mit der Entwicklung des obstruktiven Syndroms nehmen die absoluten Geschwindigkeitsindikatoren der äußeren Atmung (MVL und FEV) ab1), Überschreitung des VC-Reduktionsgrades; der Tiffno-Index sinkt und der Bronchialwiderstand bei Exspiration steigt. Laut Pneumotachometrie zeigt sich das Überwiegen der Inspirationskraft gegenüber der Exspirationskraft als frühes Zeichen einer bronchialen Obstruktion. Die Identifizierung von Verletzungen der bronchialen Durchgängigkeit auf verschiedenen Ebenen des Bronchialbaums ist mit Hilfe spezieller Pneumotachographen möglich, die es ermöglichen, eine "Fluss-Volumen" -Kurve zu erhalten. Die periphere Obstruktion ist durch eine signifikante Abnahme der Fluss-Volumen-Kurve im Bereich geringer Lautstärke gekennzeichnet. Auch die gemeinsame Beurteilung von Bronchialwiderstand und Lungenvolumen hilft, den Grad der Obstruktion zu bestimmen. Bei einer Obstruktion auf Höhe der großen Bronchien kommt es zu einer Zunahme des Residualvolumens der Lunge (RLV), die totale Lungenkapazität (TLC) nimmt nicht zu. Bei peripherer Obstruktion werden ein signifikanterer Anstieg des TRL und ein Anstieg des TRL beobachtet. Um den Anteil des Bronchospasmus am Gesamtanteil der Bronchialobstruktion zu ermitteln, werden nach einer Reihe von pharmakologischen Tests die Ventilation und die Atmungsmechanik untersucht. Nach Inhalation von Bronchodilatator-Aerosolen verbessert sich die Beatmungsleistung bei Vorliegen einer spastischen Komponente der Atemwegsobstruktion. Eine Radiopulmonographie mit dem radioaktiven Isotop 133Xe wird durchgeführt, um eine ungleichmäßige Belüftung im Zusammenhang mit einer Obstruktion der kleinen Bronchien zu erkennen. Dies ist das früheste diagnostische Zeichen dieser Art von Bronchialobstruktion. Eine Elektrokardiographie ist notwendig, um eine Hypertrophie des rechten Ventrikels und des rechten Vorhofs zu erkennen, die sich bei pulmonaler Hypertonie entwickelt. Eine ausgeprägte Abweichung der QRS-Achse nach rechts, eine Verschiebung der Übergangszone nach links (R / S < 1 in V4-V6), S-Typ-EKG werden erkannt; hohe scharfe P-Welle in den Ableitungen VF, III, II. Ein klinischer Bluttest zeigt eine sekundäre Erythrozytose, die aus einer chronischen Hypoxie mit der Entwicklung einer schweren Lungeninsuffizienz resultiert. "Akutphase" -Indikatoren werden mäßig ausgedrückt: ESR ist normal oder mäßig erhöht, Leukozytose ist gering, sowie die Verschiebung der Leukozytenformel nach links. Als Hinweis auf allergische Manifestationen ist eine Eosinophilie möglich. Die Untersuchung von Sputum und Bronchialinhalt hilft, den Schweregrad der Entzündung festzustellen. Bei schwerer Entzündung ist der Inhalt eitrig oder eitrig-schleimig, enthält viele Neutrophile und einzelne Makrophagen, dystrophisch veränderte Zellen des Flimmer- und Plattenepithels sind schwach vertreten. Bei mäßiger Entzündung ist der Inhalt eher schleimig-eitrig; die Anzahl der Neutrophilen wird reduziert, die Anzahl der Makrophagen, Schleim- und Bronchialepithelzellen nimmt zu. Bei leichter Entzündung ist der Bronchialinhalt schleimig, abgeschuppte Zellen des Epithels und der Bronchien überwiegen; Makrophagen und Neutrophile sind wenige. Die mikrobiologische Untersuchung von Sputum und Bronchialinhalt ist wichtig, um die Ätiologie von Exazerbationen einer chronischen Bronchitis und die Wahl einer antimikrobiellen Therapie zu identifizieren. Differenzialdiagnose. Tabelle 10 Differenzialdiagnostische Kriterien für CB
Behandlung. Beinhaltet eine Reihe von Maßnahmen, die sich während der Verschlimmerung und Remission der Krankheit unterscheiden. Während der Verschlimmerung chronischer Erkrankungen werden zwei Behandlungsrichtungen unterschieden: etiotrop und pathogenetisch. Die etiotrope Behandlung zielt darauf ab, den Entzündungsprozess in den Bronchien zu beseitigen: Indiziert ist eine Therapie mit Antibiotika, Sulfanilamid-Medikamenten, Antiseptika, Phytonziden usw. Die Behandlung beginnt mit Antibiotika der Penicillin-Reihe (Penicillin, Ampicillin) oder einer Gruppe von Cephalosporinen (Cefamesin , tseporin), und in Ermangelung einer Wirkung werden Antibiotika der Gruppe Reserve (Gentamicin usw.) verwendet. Der am meisten bevorzugte Verabreichungsweg ist intratracheal (Aerosol oder Füllung mit einer Larynxspritze durch ein Bronchoskop). Die pathogenetische Behandlung zielt darauf ab, die Lungenventilation zu verbessern; Wiederherstellung der bronchialen Durchgängigkeit; Kontrolle der pulmonalen Hypertonie und des rechtsventrikulären Versagens. Die Wiederherstellung der Lungenventilation wird neben der Beseitigung des Entzündungsprozesses in den Bronchien durch Sauerstofftherapie und Bewegungstherapie erleichtert. Die Hauptsache bei der Behandlung von chronischer Bronchitis - die Wiederherstellung der Durchgängigkeit der Bronchien - wird durch die Verbesserung ihrer Drainage und die Beseitigung von Bronchospasmen erreicht. Zur Verbesserung der Bronchialdrainage werden Expektorantien (heißes alkalisches Getränk, Abkochungen von Kräutern, Mukaltin usw.), Mukolytika (Acetylcystein, Bromhexin; mit eitriger viskoser Sekretion - Aerosole proteolytischer Enzyme - Chymopsin, Trypsin) verschrieben; therapeutische Bronchoskopie verwendet wird. Zur Beseitigung von Bronchospasmus wird Eufillin (intravenös, in Zäpfchen, Tabletten), Ephedrin, Atropin verwendet; Einzeltermine in einem Aerosol von Sympathomimetika sind möglich: Fenoterol, Orciprenalinsulfat (Asthmopenta) und ein neues Inlandsmedikament "Soventol", Anticholinergika: Atrovent, Troventol. Wirksame Präparate mit verlängertem Aminophyllin (Teopec, Teodur, Theobelong usw.) - 2 mal täglich. In Ermangelung der Wirkung einer solchen Therapie werden kleine Dosen von Kortikosteroiden oral (10-15 mg Prednisolon pro Tag) oder intratracheal (Hydrocortisonsuspension - 50 mg) verabreicht. Als zusätzliche Therapie ernennen Sie: 1) Antitussiva: bei unproduktivem Husten - Libexin, Tusuprex, Bromhexin, bei Hackhusten - Codein, Dionin, Stoptussin; 2) Medikamente, die die Widerstandskraft des Körpers erhöhen: Vitamine A, C, Gruppe B, biogene Stimulanzien. Derzeit werden bei der Behandlung von chronischer Bronchitis zunehmend immunkorrigierende Medikamente eingesetzt: T-Aktivin oder Thymalin (100 mg subkutan für 3 Tage); innen - Catergen, Natriumnucleinat oder Pentoxyl (innerhalb von 2 Wochen), Levamisol (Decaris). Physiotherapeutische Behandlung: Verschreiben Sie Diathermie, Calciumchlorid-Elektrophorese, Quarz im Brustbereich, Brustmassage und Atemübungen. Bei mittelschwerer und schwerer Bronchitis sind viele Patienten zusammen mit Anti-Rezidiv- und Sanatoriumsbehandlungen gezwungen, ständig eine unterstützende medikamentöse Behandlung zu erhalten. Die Erhaltungstherapie zielt darauf ab, die bronchiale Durchgängigkeit zu verbessern, die pulmonale Hypertonie zu senken und das rechtsventrikuläre Versagen zu bekämpfen. Es werden die gleichen Medikamente wie in der Zeit der Exazerbation verschrieben, nur in kleineren Dosen, in Kursen. Prognose. Die Prognose für eine vollständige Genesung ist ungünstig. Die ungünstigste Prognose haben obstruktive CB und CB mit überwiegender Schädigung der distalen Bronchien, die schnell zur Entwicklung eines Lungenversagens und zur Bildung eines Cor pulmonale führt. Die günstigste Prognose besteht bei oberflächlichem (katarrhalischem) CB ohne Obstruktion. VORTRAG Nr. 8. Erkrankungen des Atmungssystems. Lungenentzündung Pneumonie ist eine akute infektiöse und entzündliche Erkrankung fokaler Natur, bei der die Atemwege und das interstitielle Bindegewebe der Lunge am pathologischen Prozess beteiligt sind. Классификация Е. В. Гембицкого (1983 г.). Nach Ätiologie: 1) bakteriell (zeigt den Erreger an); 2) viral (zeigt den Erreger an); 3) Kornit; 4) Rickettsien; 5) Mykoplasmen; 6) Pilz; 7) gemischt; 8) infektiös-allergisch; 9) unbekannte Ätiologie. Nach Pathogenese: 1) primär (unabhängiger akuter Entzündungsprozess); 2) sekundär (Komplikation von Erkrankungen des Herz-Kreislauf-Systems mit Durchblutungsstörungen im Lungenkreislauf, chronische Erkrankungen der Nieren, des Blutsystems, des Stoffwechsels, Infektionskrankheiten oder Entwicklung vor dem Hintergrund chronischer Atemwegserkrankungen). Klinische und morphologische Merkmale: 1) Parenchym (bei Pneumokokken-Pneumonie): croupös; fokal; 2) Zwischenraum. Nach Lokalisation und Ausdehnung: einseitig; zweiseitig. Nach Schweregrad: extrem schwer; schwer; mäßig; mild und abortiv. Stromabwärts: scharf; langwierig (radiologische und klinische Auflösung der Lungenentzündung). Ätiologie. Большинство пневмоний имеет инфекционное происхождение. Пневмонии аллергические и обусловленные действием физических или химических факторов встречаются редко. Бактериальные пневмонии диагностируются чаще у лиц среднего и пожилого возраста; вирусные пневмонии - у молодых. В этиологии первичных бактериальных пневмоний ведущая роль принадлежит пневмококкам. В период эпидемии гриппа возрастает роль вирусно-бактериальных ассоциаций (чаще стафилококков), а также условно-патогенных микроорганизмов. Bei der sekundären Pneumonie spielen gramnegative Bakterien (Klebsiella pneumoniae und Influenza-Bazillus) die führende ätiologische Rolle; Beim Auftreten einer Aspirationspneumonie ist die Bedeutung einer anaeroben Infektion groß. Pathogenese. Инфекционный возбудитель попадает извне в респираторные отделы легких через бронхи: ингаляционно и аспирационно (из носо- или ротоглотки). Гематогенным путем возбудитель попадает в легкие преимущественно при вторичных пневмониях или при тромботическом генезе пневмоний. Лимфогенное распространение инфекции с возникновением пневмонии наблюдается лишь при ранениях в грудную клетку. Es gibt auch einen endogenen Mechanismus für die Entstehung von Entzündungen im Lungengewebe aufgrund der Aktivierung der Mikroflora in der Lunge. Seine Rolle ist bei sekundärer Pneumonie groß. Die Entwicklung einer Lungenentzündung wird durch ungünstige Faktoren der äußeren und inneren Umgebung erleichtert, unter deren Einfluss die allgemeine unspezifische Resistenz des Körpers abnimmt (Unterdrückung der Phagozytose, Produktion von Bakteriolysinen usw.) und Unterdrückung lokaler Abwehrmechanismen (gestörte mukoziliäre Clearance, Abnahme der phagozytischen Aktivität von Alveolarmakrophagen und Neutrophilen usw.) . Auch allergischen und autoallergischen Reaktionen kommt in der Pathogenese der Pneumonie eine bedeutende Bedeutung zu. Saprophyten und pathogene Mikroorganismen, die zu Antigenen werden, tragen zur Produktion von Antikörpern bei, die auf den Zellen der Schleimhaut der Atemwege fixiert sind, wo die Antigen-Antikörper-Reaktion auftritt, die zu Gewebeschäden und der Entwicklung des Entzündungsprozesses führt. In Gegenwart gemeinsamer antigener Determinanten von Mikroorganismen und Lungengewebe oder wenn Lungengewebe durch Viren, Mikroorganismen, Toxine und toxische Substanzen geschädigt wird, was zur Manifestation seiner antigenen Eigenschaften führt, entwickeln sich autoallergische Prozesse. Diese Prozesse tragen zu einem längeren Bestehen pathologischer Veränderungen und einem langwierigen Krankheitsverlauf bei. Klinisches Bild. Основные синдромы: 1) Vergiftung (allgemeine Schwäche, Müdigkeit, Kopf- und Muskelschmerzen, Atemnot, Herzklopfen, Blässe, Appetitlosigkeit); 2) ein Syndrom allgemeiner entzündlicher Veränderungen (Hitzegefühl, Schüttelfrost, Fieber, Veränderungen des Blutbildes in der akuten Phase: Leukozytose mit Verschiebung der Leukozytenformel nach links, Anstieg der ESR, Fibrinogenspiegel, α2-Globuline, das Auftreten von C-reaktivem Protein); 3) ein Syndrom entzündlicher Veränderungen im Lungengewebe (Auftreten von Husten und Auswurf, Verkürzung des Perkussionsgeräusches), vermehrtes Zittern der Stimme und Bronchophonie, Veränderungen in der Frequenz und Art der Atmung, Auftreten von feuchten Rasseln, radiologische Veränderungen; 4) Syndrom der Beteiligung anderer Organe und Systeme. Die Schwere dieser Manifestationen charakterisiert die Schwere des Verlaufs einer Pneumonie (siehe Tabelle 11). Tabelle 11 Symptome und Verlauf einer Lungenentzündung
In verschiedenen Stadien des Verlaufs einer Lungenentzündung kann sich das klinische Bild durch das Hinzufügen bestimmter Komplikationen ändern: pulmonal und extrapulmonal. Lungen: Abszessbildung; Pleuritis (para- und metapneumonisch), seltener - Pleuraempyem; der Beitritt einer asthmatischen Komponente, die Bildung eines Lungenödems und die Entwicklung eines akuten Atemversagens ist möglich. Extrapulmonale Komplikationen: infektiös-toxischer Schock (mit Symptomen eines akuten vaskulären, akuten linksventrikulären und Nierenversagens, Ulzerationen der Schleimhaut des Verdauungstrakts und Blutungen, Entwicklung einer disseminierten intravasalen Gerinnung; infektiös-allergische Myokarditis; infektiöse Endokarditis; Perikarditis; Meningitis oder Meningoenzephalitis, Nephritis, Hepatitis Bei schwerer croupöser Pneumonie können sich Vergiftungspsychosen entwickeln, bei konfluierender totaler Pneumonie akutes Lungenherz. Die Hauptbeschwerden eines Patienten mit Lungenentzündung: Husten, Auswurf, Brustschmerzen, verschlimmert durch Atmen und Husten, Atemnot, beeinträchtigtes allgemeines Wohlbefinden, Fieber. Husten kann trocken oder mit Auswurf (schleimig, schleimig-eitrig, eitrig-schleimig, blutig) sein. "Rostiger" Auswurf ist charakteristisch für Lobärpneumonie, blutig - für Lungenentzündung, die durch Klebsiella (Fridlander-Bazillus) und Viruspneumonie verursacht wird; eitriger blutiger Auswurf weist auf eine Streptokokken-Pneumonie hin. Anhaltender Husten mit einer kleinen Menge mukopurulenten Auswurfs wird bei Mykoplasmenpneumonie beobachtet, die auch durch ein Gefühl von Halsschmerzen gekennzeichnet ist. Schmerzen in der Seite, die durch tiefes Atmen und Husten verstärkt werden, sind charakteristisch für eine Lobär-Pneumokokken-Pneumonie sowie eine Beteiligung der Pleura am pathologischen Prozess. Mit der Lokalisation einer Lungenentzündung in den unteren Lungenabschnitten und der Beteiligung des Zwerchfellfells kann der Schmerz in die Bauchhöhle ausstrahlen und das Bild eines akuten Abdomens vortäuschen. Ist der obere oder untere Schilfabschnitt der linken Lunge daran beteiligt, sind die Schmerzen im Bereich des Herzens lokalisiert. Bei 25% der Patienten ist die Beschwerde über Atemnot eine der Hauptbeschwerden, insbesondere bei einer Lungenentzündung, die sich vor dem Hintergrund chronischer Atemwegserkrankungen und Herzinsuffizienz entwickelt hat. Die Schwere der Atemnot nimmt parallel mit der Beeinträchtigung des allgemeinen Wohlbefindens zu. Die Symptome einer schweren Vergiftung sind am charakteristischsten für Cornitosis und Mykoplasmen-Pneumonie und werden auch bei Staphylokokken-, Influenza- und Pneumokokken-Pneumonie (croupöse) beobachtet. Der Patient kann durch Schüttelfrost und einen Anstieg der Körpertemperatur bis hin zu Fieber gestört werden. Vor dem allgemeinen Hintergrund von Intoxikation und fieberhafter Temperatur treten lokale Symptome auf. Diagnostik. Для постановки этиологического диагноза имеет значение правильная оценка симптомов заболевания в самом его начале. Осиплость голоса или невозможность разговаривать характерны для пневмоний, вызванных вирусом парагриппа. Tränenfluss, Augenschmerzen, Halsschmerzen beim Schlucken, reichlicher Nasenausfluss ohne Veränderung anderer Teile der Atemwege treten bei einer durch Adenovirus verursachten Lungenentzündung auf. Am bedeutsamsten für die Diagnose ist das Vorhandensein eines Syndroms entzündlicher Veränderungen im Lungengewebe. Dieses Syndrom besteht aus den folgenden Symptomen: 1) Atemverzögerung der betroffenen Brustseite; 2) mehr oder weniger starke Verkürzung des Perkussionsklangs im Bereich der Projektion der Läsion; 3) verstärktes Zittern der Stimme und Bronchophonie im selben Bereich; 4) Veränderung in der Art der Atmung (hart, bronchial, geschwächt usw.); 5) das Auftreten pathologischer Atemgeräusche (feuchtes, stimmhaftes, fein sprudelndes Rasseln und Crepitation). Die Art der Atmung kann sich auf unterschiedliche Weise verändern. Im Anfangsstadium einer croupösen Pneumonie kann die Atmung mit verlängerter Ausatmung geschwächt sein; in der Hepatisierungsphase ist zusammen mit einer Zunahme der Dumpfheit des Perkussionsklangs eine Bronchialatmung zu hören; Mit der Auflösung des pneumonischen Fokus mit einer Abnahme der Dumpfheit der Perkussion wird die Atmung schwer. Bei einer fokalen Lungenentzündung sind die beständigsten Symptome schweres Atmen und feuchte, klingelnde, fein blubbernde Rasselgeräusche. Bei einer zentralen Hiluspneumonie sind die körperlichen Daten jedoch sehr schlecht dargestellt, und die Erkennung einer Lungenentzündung ist nur nach einer Röntgenuntersuchung möglich. Mycoplasma-Pneumonien zeichnen sich durch den Mangel an physikalischen Daten aus. Bei einer durch Klebsiella-Pneumonie verursachten Lungenentzündung wird eine schwere Intoxikation, kombiniert mit einer sehr geringen Anzahl von Keuchen, beobachtet. In einigen Fällen kann während der Auskultation eine große Anzahl von trockenen Rasseln im Bass und in den Höhen auftreten, die für das entzündliche Infiltrationssyndrom uncharakteristisch sind. Dies tritt bei einer Lungenentzündung auf, die sich vor dem Hintergrund einer chronischen Bronchitis entwickelt hat; Lungenentzündung, verursacht durch Pfeiffers Stock; im Falle des Beitritts zur Lungenentzündung einer allergischen Komponente. Symptome helfen, eine ätiologische Diagnose zu stellen: 1) der Nachweis eines kleinfleckigen Hautausschlags wie bei Röteln in Kombination mit einer Lymphadenopathie ist charakteristisch für eine Adenovirusinfektion; 2) lokale Vergrößerung der Lymphknoten weist auf perifokale Pneumonie hin; 3) Pilzpneumonie kombiniert mit Läsionen der Schleimhäute, Haut und Nägel; 4) hepatolienales Syndrom und leichter Ikterus werden bei kornitischen und Curickettsial-Pneumonien gefunden; 5) Bei einer typischen croupösen Lungenentzündung ist das Aussehen des Patienten charakteristisch: ein blasses Gesicht mit fiebriger Rötung an der Seite der Läsion, herpetische Eruptionen, Schwellung der Nasenflügel beim Atmen. Die wichtigste Methode, um das Vorliegen einer Lungenentzündung und den Grad der Beteiligung des Lungengewebes am Prozess abzuklären, ist die großformatige Fluorographie und Röntgenuntersuchung der Brustorgane. Staphylokokken-Pneumonien zeichnen sich durch eine klare Segmentierung der Lungenläsionen mit Beteiligung mehrerer Segmente am Prozess aus. Ihr charakteristisches radiologisches Zeichen ist die Bildung mehrerer Hohlräume in der Lunge vom Pneumozele-Typ am 5. bis 7. Tag nach Beginn der Krankheit und später - nekrotische Hohlräume mit Vorhandensein von Flüssigkeit. Im Gegensatz zu echten Abszessen ändern sich die Konfiguration und Anzahl der Hohlräume schnell. Lobärläsion ist eine Manifestation einer Lobärpneumonie oder einer durch Klebsiella verursachten Lungenentzündung. Am häufigsten ist der Oberlappen, hauptsächlich die rechte Lunge, betroffen. Die Röntgenuntersuchung zeigt einen Erguss in der Pleurahöhle. Häufig tritt ein solcher Erguss bei einer Streptokokken-Pneumonie auf, bei einer durch Pfeiffer-Stick verursachten Lungenentzündung, die im Unterlappen lokalisiert ist und bei 2/3 der Patienten mehr als einen Lungenlappen erfasst. Röntgenuntersuchungsdaten sind besonders wichtig, um eine Lungenentzündung mit leichten auskultatorischen Veränderungen (interstitielle und hiläre Pneumonie) zu erkennen. In einigen Fällen sind zur Klärung der Diagnose eine Tomographie und eine Bronchographie indiziert, die bei verzögerter Rückbildung infiltrativer Veränderungen mit kompliziertem Verlauf (Abszess, Erguss in der Pleurahöhle) zur Klärung der Diagnose beitragen. Sie werden verwendet, um andere pathologische Prozesse mit ähnlichen klinischen und radiologischen Präsentationen auszuschließen. Die Bronchographie zeigt Karieshöhlen im Lungengewebe sowie das Vorhandensein von Bronchiektasen, um die herum bei Exazerbation infiltrative Veränderungen (perifokale Pneumonie) möglich sind. Bei der Diagnose einer Infarktpneumonie spielt eine Radionuklidstudie des Lungenblutflusses eine gewisse Rolle, die ihre Verletzungen aufdeckt. Bakteriologische Untersuchung von Sputum (oder Bronchialspülungen) vor der Ernennung von Antibiotika hilft, den Erreger zu erkennen und seine Empfindlichkeit gegenüber Antibiotika zu bestimmen. Nicht immer identifizierter Mikroorganismus ist der Erreger der Lungenentzündung. Eine genauere ätiologische Diagnose kann durch immunologische Untersuchungen erfolgen: Komplementfixationsreaktion (RCC) und Hämagglutinationshemmreaktion (HITA) mit viralen und bakteriellen Antigenen. Bei der Diagnose einer viralen und viral-bakteriellen Lungenentzündung sind virologische und serologische Studien wichtig (die Ergebnisse einer Kulturstudie von Sputum, einschließlich eines biologischen Tests an Mäusen, einer Methode zur Kultivierung von Viren in einem sich entwickelnden Hühnerembryo, einer Immunfluoreszenzmethode, a serologische Methode mit gepaarten Seren gegen Viren, legen Wert auf nur 4-fachen Anstieg des Antikörpertiters). Die Sputumuntersuchung hilft, die Art der Lungenentzündung zu klären. Eine große Anzahl von Eosinophilen weist auf allergische Prozesse hin, das Vorhandensein atypischer Zellen weist auf eine Lungenentzündung krebsartigen Ursprungs hin; Mycobacterium tuberculosis kommt bei Tuberkulose vor; elastische Fasern - Beweis für den Zusammenbruch des Lungengewebes. Bei Mykosepneumonie wird neben dem Nachweis von Pilzen das Fehlen einer pyogenen Flora aufgrund der hemmenden Wirkung der Abfallprodukte von Pilzen festgestellt. Nach der Mikroskopie von gramgefärbten Sputumabstrichen kann man bereits am ersten Tag des Krankenhausaufenthaltes des Patienten von gramnegativen oder grampositiven Mikroorganismen sprechen, die in den Bronchien leben. Die Schwere des Entzündungsprozesses wird anhand der Schwere der Blutparameter in der akuten Phase und ihrer Dynamik (Leukozytose mit einer Verschiebung der Leukozytenformel, einer Erhöhung der ESR, einem erhöhten Gehalt an α2-Globuline, Fibrinogen, das Auftreten von SRV, eine Erhöhung des Sialinsäurespiegels). Bei längerem Verlauf einer Lungenentzündung und der Entwicklung von Komplikationen wird die immunologische Reaktivität des Körpers untersucht. Eine Abnahme der humoralen (IgM) und zellulären (verzögerte Migration von Leukozyten, Veränderungen in Tests, die das T-Lymphozyten-System charakterisieren) Immunität erfordert eine immunmodulatorische Therapie. Behandlung. Непосредственно после постановки диагноза необходимо приступать к этиотропной терапии пневмонии. Большое значение приобретают эмпирические представления о возможном возбудителе, поскольку бактериологическое исследование мокроты проводится в течение достаточно длительного времени и у большинства больных даже при современном подходе к данному исследованию дает неопределенные, а иногда ошибочные результаты. Penicilline haben derzeit ihre Bedeutung als Mittel der Wahl bei der Behandlung von Lungenentzündungen verloren. Dies liegt daran, dass neben Pneumokokken und Haemophilus influenzae obligate intrazelluläre Mikroorganismen - Mycoplasma pneumoniae und Chlamydia pneumoniae - ursächlich für die Entwicklung einer Lungenentzündung von Bedeutung sind, die gegen die bakterizide Wirkung von Antibiotika der β-Lactam-Gruppe resistent sind. Es ist nicht zu übersehen, dass sich bei Patienten schnell eine Überempfindlichkeit gegen diese Medikamente entwickelt. Im Zusammenhang mit dem Obigen wird bei der Behandlung von Lungenentzündung Makroliden viel Aufmerksamkeit geschenkt, die sich nicht nur gegen Pneumokokken, sondern auch gegen Mycoplasma pneumoniae, Chlarnydia pneumoniae als wirksam erwiesen haben. Es ist jedoch wichtig, die Tatsache nicht aus den Augen zu verlieren, dass Erythromycin, das aufgrund seiner geringen Stabilität in saurem Milieu (und damit geringer Bioverfügbarkeit) sowie der weit verbreiteten Prävalenz von Pneumokokken-Stämmen, der Standard dieser Arzneimittelgruppe ist, resistent ist B. gegenüber Erythromycin, verliert seinen klinischen Wert. Als Arzneimittel der Wahl wurde es durch andere Arzneimittel der Makrolidklasse ersetzt - Azithromycin, Roxithromycin, Rovamycin usw. Eine Reihe von Makroliden wird auch zur oralen und parenteralen Anwendung verwendet (z. B. Rovamycin). Infolgedessen ist ihre Verwendung im schweren Verlauf des Entzündungsprozesses in der Lunge gerechtfertigt (z. B. wird Rovamycin zunächst 2-3 Tage lang intravenös verabreicht, und anschließend wechselt der Patient bei positiver Dynamik des pathologischen Prozesses zu Einnahme dieses Medikaments im Inneren). Der Vorteil von Rovamycin ist unbestreitbar, da es nicht mit Theophyllinen interagiert und gleichzeitig die Möglichkeit einer Überdosierung dieser Arzneimittel verhindert, da Theophylline und Rovamycin zusammen bei der Behandlung von Patienten mit chronisch obstruktiven Lungenerkrankungen eingesetzt werden. Es ist auch bekannt, dass diese Untergruppe von Makroliden (16-gliedrige Makrolide) Arzneimittel mit einem Minimum an Nebenwirkungen sind. Bei Patienten über 65 Jahren können aufgrund der Heterogenität des ätiologischen Spektrums der Pneumonie und bei begleitenden chronisch obstruktiven Lungenerkrankungen halbsynthetische Penicilline zur initialen Antibiotikatherapie und bei fehlender positiver Wirkung nach dieser Therapie eingesetzt werden 3-4 Tagen ist der Einsatz von Cephalosporinen gerechtfertigt. Es ist wichtig, sich daran zu erinnern, dass das Wirkungsspektrum von Cephalosporinen der I. und einiger II. Generation grampositive und gramnegative Mikroorganismen umfasst und Cephalosporine der III. Generation hauptsächlich auf gramnegative Krankheitserreger wirken. Cephalosporine der I. Generation sind Cephalothin (Keflin), Cefazolin (Kefzol) usw. Medikamente der II. Generation umfassen Cefuroxim (Ketocef), Cefoxitin (Boncefin) und andere Cephalosporine der III. Generation: Cefotaxim (Claforan), Cefoperazon (Cefobid), Ceftriaxon ( longacef). Aspirationspneumonie ist mit einer anaeroben oder gramnegativen Mikroflora verbunden, die die Verwendung von Aminoglykosiden oder Cephalosporinen der III. Generation in Kombination mit Metronidazol-Semisuccinat (500 mg intravenös 2-3 mal täglich) bestimmt. Immunschwächezustände beeinflussen auch die Art der ausgewählten Medikamente, die in diesem Fall von der Art des Erregers abhängt. In solchen Fällen besteht das angewandte Schema aus Aminoglykosiden und modernen Cephalosporinen. Die Dauer einer wirksamen Antibiotikatherapie bei einem Patienten mit Lungenentzündung beträgt 7-10 Tage. Bei der Verschreibung einer Behandlung sollte berücksichtigt werden, dass diese Therapie in 7-15 % der Fälle möglicherweise keine Wirkung zeigt. Basierend auf den Ergebnissen einer mikrobiologischen Studie weist dies auf die Notwendigkeit hin, Antibiotika zu ersetzen. Eine weitere Möglichkeit ist der Einsatz alternativer Medikamente, der sogenannten Second-Choice-Antibiotika: moderne Cephalosporine, Imipenem, Monobactame, Fluorchinolone. Fluorchinolone (Ofloxacin, Pefloxacin, Ciprofloxacin) sind wirksam gegen gramnegative Pathogene, einschließlich Pseudomonas aeruginosa, und einige grampositive Kokken (Staphylococcus aureus), sind jedoch inaktiv, wenn sie Anaerobiern ausgesetzt sind. Fluorchinolone können mit Recht als Alternative zu Makroliden bei Chlamydien-, Legionellen- und Mykoplasmeninfektionen in Betracht gezogen werden. Monobactam-Antibiotika in ihrer modernen Form sind vertreten durch Aztreonam (Azactam), das hauptsächlich gegen gramnegative Aerobier (Salmonella, Shigella, Proteus, Escherichia coli, Klebsiella usw.) aktiv ist; und ist auch unter Einwirkung von β-Lactamasen stabil. Imipenem - ein antibakterielles Medikament der Carbapenem-Gruppe, wird nur in Kombination mit Cilastatin verschrieben, das den Metabolismus von Imipenem hemmt. Das Medikament ist hochwirksam gegen viele Anaerobier, grampositive Kokken und gramnegative Stäbchen. Dosierung von Antibiotika zur Behandlung von Lungenentzündungen. 1) Penicilline: Benzylpenicillin (500–000 Einheiten intravenös alle 1–000 Stunden oder 000–6 Einheiten intramuskulär alle 8 Stunden), Ampicillin (500–000–1 g intramuskulär alle 000–000 Stunden oder 4 g alle 0,5 Stunden intravenös), Amoxicillin (1,0-2,0 g alle 6 Stunden oral oder 8-0,5 g alle 6-0,5 Stunden intramuskulär, intravenös), Oxacillin (1,0 g alle 8-0,5 Stunden oral, intramuskulär, intravenös). 2) Cephalosporine: I. Generation - Cephalothin (Keflin) (0,5-2,0 g alle 4-6 Stunden intramuskulär, intravenös), Cefazolin (Kefzol) (0,5-2,0 g, alle 8 Stunden intramuskulär, intravenös ), II. Generation - Cefuroxim (Zinacef , Ketocef) (0,75-1,5 g alle 6-8 Stunden intramuskulär, intravenös), III. Generation - Cefotaxim (Claforan) (1,0-2,0 g, maximal bis zu 12 g / Tag alle 12 Stunden intramuskulär, intravenös), Ceftriaxon (Longacef, Rocefin) (1,0-2,0-4,0 g alle 24 Stunden intramuskulär, intravenös). 3) Aminoglykoside: Genetamycin (80 mg alle 12 Stunden intramuskulär, intravenös), Amikacin (10-15 mg/kg alle 12 Stunden intramuskulär, intravenös), Tobramycin (Brulamycin) (3-5 mg/kg alle 8 Stunden intramuskulär, intravenös) . 4) Макролиды: эритромицин (0,5 г каждые 6-8 ч перорально или 0,5-1,0 г каждые 6-8 ч внутривенно), ровамицин (3,0 млн. МЕ каждые 8-12 ч перорально или 1,5-3,0 млн. ME каждые 8-12 ч внутривенно). 5) Fluorchinolone: Pefloxacin (Leflacin) (400 mg alle 12 Stunden oral, IV), Ciprofloxacin (Cyprobay) (500 mg alle 12 Stunden oral oder 200-400 mg alle 12 Stunden intravenös), Ofloxacin (Zanocin, Tarivid) (200 mg alle 12 Stunden oral). 6) Tetracycline: Doxycyclin (Vibramycin) (200 mg am Tag 1, an den folgenden Tagen – 100 mg alle 24 Stunden oral), Minocyclin (Minocin) (200 mg am Tag 1, an den folgenden Tagen – 100 mg alle 12 Stunden oral), Aztreonam (Azactam) (1,0–2,0 g alle 8–12 Stunden), Imipenem/Cilstatin (Thienam) (500 mg alle 6–8 Stunden intramuskulär). Von Bedeutung ist auch, dass ein protrahierter oder progredienter Krankheitsverlauf in der Regel auf eine unzureichende antibiotische Initialtherapie zurückzuführen ist. Daneben gibt es jedoch eine Reihe von lokalen und systemischen Ursachen, die zu einem langen und anhaltenden Entzündungsverlauf in der Lunge führen: Dies sind lokale Atemwegsobstruktion (Krebs, Adenom, Schleimhautverschluss etc.); Bronchiektasen (angeboren, erworben); Mukoviszidose; Immunsystemdefekte (erworben); wiederkehrende Aspiration (Achalasie, Speiseröhrenkrebs usw.); Aktivierung einer latenten Tuberkuloseinfektion; sich entwickelnder Lungenabszess; unzureichende Antibiotikatherapie. VORTRAG Nr. 9. Erkrankungen des Verdauungstraktes. Erkrankungen der Speiseröhre. Ösophagitis und Magengeschwür der Speiseröhre 1. Akute Ösophagitis Akute Ösophagitis ist eine entzündliche Läsion der Schleimhaut der Speiseröhre, die mehrere Tage bis 2-3 Monate dauert. Ätiologie und Pathogenese. Ätiologische Faktoren: Infektionskrankheiten, Verletzungen, Verbrennungen, Vergiftungen, allergische Reaktionen, Ernährungsfehler. Von den Infektionserregern sind Diphtherie, Scharlach, Typhus und Typhus, Influenza, Parainfluenza, Adenovirus-Infektion, Mumps die charakteristischsten für akute Ösophagitis. Physikalische und chemische Schädigungsfaktoren werden durch ionisierende Strahlung, Verätzungen, heiße und sehr kalte Speisen sowie Gewürze repräsentiert. Einstufung. Es gibt keine einheitliche Klassifizierung. Es ist möglich, eine Arbeitsklassifikation der akuten Ösophagitis zu verwenden. Morphologisch werden die aufgeführten Arten der akuten Ösophagitis unterschieden: katarrhalisch, ödematös, erosiv, pseudomembranös, hämorrhagisch, exfoliativ, nekrotisch, phlegmonös. Nach Ätiologie: infektiös, chemisch, physikalisch, alimentär. Durch endoskopische Stadien: 1. - Ödem und Hyperämie der Schleimhaut, 2. - das Auftreten einzelner Erosionen auf den Spitzen der ödematösen Schleimhautfalten, 3. - signifikantes Ödem und Hyperämie der Schleimhaut mit Herden erodierter und blutender Schleimhäute, 4. - " Weinen "- diffus erodierte Schleimhaut, blutet bei der geringsten Berührung des Endoskops. Klinisches Bild. Die katarrhalische Ösophagitis ist die häufigste Form der akuten Ösophagitis. Es tritt vor dem Hintergrund von Ernährungsfehlern auf: Beim Verzehr scharfer, kalter, heißer Speisen, bei leichten Verletzungen, Alkoholverbrennungen. Es äußert sich klinisch durch Brennen und Schmerzen hinter dem Brustbein, was die Patienten dazu zwingt, mehrere Tage lang Nahrung zu verweigern. Endoskopisch festgestellte Ösophagitis I-II Grad, Röntgen - Hyperkinesie der Speiseröhre. Erosive Ösophagitis tritt bei Infektionskrankheiten (Finne, Typhus, Sepsis, Pilzprozesse) und Allergien auf. Es tritt auch bei Verätzungen und Verletzungen der Speiseröhre auf. Tatsächlich ist diese Form der Ösophagitis eine Phase der Entwicklung der katarrhalischen Ösophagitis. Das hauptsächliche Krankheitsbild besteht aus den Symptomen der Grunderkrankung. Die klinischen Symptome ähneln denen einer katarrhalischen Ösophagitis: deutliche Schmerzen in der Brust während der Nahrungspassage; Sodbrennen, Aufstoßen, Hypersalivation, fauliger Geruch aus dem Mund (Kakosmie). Endoskopisch Anzeichen einer Ösophagitis II-III feststellen. Die histologische Untersuchung ergab Hyperämie, Schleimhautödem, Blutung, Erosion. Eine Röntgenuntersuchung zeigt eine Fülle von Schleim in der Speiseröhre, eine Umstrukturierung des Reliefs mit der Bildung flacher Bariumdepots mit einer Längsform von bis zu 1 cm Länge und eine Hyperkinesie der Wände der Speiseröhre. Die hämorrhagische Ösophagitis ist eine seltene klinische Form der erosiven Ösophagitis. Die Ätiologie ist die gleiche wie bei der erosiven Ösophagitis. Klinisch typisch sind ein intensives Schmerzsyndrom und Hämatemesis. Die Endoskopie zeigt eine Entzündung Grad III-IV mit einer Dominanz der hämorrhagischen Komponente. Es kommt zu einer Ablösung der blutenden Schleimhaut in Form schmaler dünner Streifen. Fibrinöse (pseudomembranöse) Ösophagitis. Ätiologische Faktoren sind Scharlach, Diphtherie, Blutkrankheiten, Pilzkrankheiten, die Auswirkungen der Strahlentherapie. Die Klinik wird von Dysphagie und starken Schmerzen dominiert, die sich nach dem Essen, Übelkeit und Erbrechen verschlimmern. Beim Erbrechen werden Fibrinfilme freigesetzt, es kann zu Bluthusten kommen. Endoskopisch werden auf den betroffenen Bereichen der Schleimhaut graue und gelbgraue fibrinöse Plaques gefunden, die durch Schichten von Fibrin und Detritus gebildet werden, die die Oberfläche der Schleimhaut bedecken. Mit der Abstoßung von Pseudomembranen bilden sich flache, langsam heilende Erosionen, manchmal blutende Geschwüre. Nach einem schweren infektiösen Prozess verbleiben membranöse Stenosen in der Speiseröhre, die nach wiederholter Bougierung verschwinden. Die membranöse (exfoliative) Ösophagitis ist chemisch (Verbrennungen der Speiseröhre), infektiös (Ursachen sind Sepsis, Gürtelrose, Pocken, generalisierte Herpesinfektion). Die Klinik der Krankheit ist variabel - von leichten Formen, die endoskopisch diagnostiziert werden, bis zu schweren. In der Klinik der schweren membranösen Ösophagitis überwiegen Intoxikation, Dysphagie und Schmerzsyndrom. Mögliche Blutungen, Perforation der Speiseröhre, Mediastinitis, die in der Regel tödlich enden. Bei der endoskopischen Untersuchung wird eine Schädigung aller Schichten der Speiseröhre beobachtet, deren Epithel von Schichten abgestoßen wird. Nach Abklingen der Grunderkrankung verbleiben manchmal symmetrische und asymmetrische häutige oder derbe narbige Stenosen im Ösophagus. Die nekrotisierende Ösophagitis ist eine seltene Form der akuten Entzündung der Speiseröhre. Seine Entwicklung wird durch eine verringerte Immunität bei so schweren Krankheiten wie Sepsis, Typhus, Candidiasis und Nierenversagen im Endstadium erleichtert. Die Klinik ist gekennzeichnet durch schmerzhafte Dysphagie, Erbrechen, allgemeine Schwäche, Blutungen, häufige Entwicklung von Mediastinitis, Pleuritis, Lungenentzündung. Nach Behandlung der Grunderkrankung verbleiben Strikturen in der Speiseröhre, die als fakultative präkanzeröse Veränderungen diagnostiziert werden. Septische Ösophagitis ist eine seltene lokale oder diffuse Entzündung der Wände der Speiseröhre mit Streptokokken-Ätiologie oder tritt auf, wenn die Schleimhaut durch einen Fremdkörper beschädigt wird, mit Verbrennungen, Geschwüren und kann von benachbarten Organen ausgehen. Manchmal tritt eine akute phlegmonöse Ösophagitis als Komplikation einer akuten Ösophagitis auf, die zu einer eitrigen Verschmelzung der Wände der Speiseröhre führt. Der Zusammenbruch der Wände wird begleitet von einem Durchbruch von Eiter in das Gewebe des Mediastinums, der Entwicklung von Mediastinitis, Pleuritis, eitriger Bronchitis, Lungenentzündung, Spondylitis, Ruptur der Aorta oder anderer großer Gefäße. Der Beitritt einer anaeroben Infektion kann zu einem Mediastinalemphysem oder einem spontanen Pneumothorax führen. Das Krankheitsbild ist gekennzeichnet durch starke Vergiftung, hohes Fieber, Schmerzen hinter dem Brustbein und im Nacken, Erbrechen. Bei der Untersuchung ist der Hals geschwollen, die Beweglichkeit in diesem Teil der Wirbelsäule ist eingeschränkt. Die Position des Kopfes ist erzwungen, mit einer Neigung zur Seite. Die Krankheit geht oft in eine eitrige Mediastinitis über. In Bluttests - Hyperleukozytose, beschleunigte ESR. Eine instrumentelle Untersuchung (Röntgen, endoskopisch) im akuten Stadium ist nicht angezeigt. Während der Narbenbildung ist eine Röntgenuntersuchung wegen des Risikos der Entwicklung grober Deformitäten und narbiger Stenosen der Speiseröhre obligatorisch. Behandlung. Prinzipien der Behandlung der akuten Ösophagitis: etiotrop, pathogenetisch und symptomatisch. Ätiotrope Behandlung - Behandlung der Grunderkrankung. Bei Infektionskrankheiten, die durch eine akute Ösophagitis kompliziert werden, werden Antibiotika (parenteral) eingesetzt. Bei ausgeprägten nekrotischen und hämorrhagischen Veränderungen der Speiseröhre wird empfohlen, für 2-3 Wochen auf Nahrung zu verzichten. Während dieser Zeit sind eine parenterale Ernährung, die intravenöse Verabreichung von Proteinhydrolysaten, Mischungen von Aminosäuren, Intralipid, Vitaminen und eine Entgiftungstherapie indiziert. Nach der Reduzierung der Entzündung werden thermisch und chemisch schonende Lebensmittel verordnet: warme Milch, Sahne, Gemüsesuppen, flüssige Cerealien. Um lokale Entzündungssymptome zu reduzieren - in Lösungen von Tannin 1%, Collargol - 2%, Novocain - 1-2% vor den Mahlzeiten. Adstringenzien werden in horizontaler Position mit tief abgesenktem Kopfende des Bettes eingenommen. In Ermangelung der Wirkung der lokalen Verabreichung von adstringierenden Präparaten werden nicht-narkotische Analgetika parenteral verschrieben. Um die Auswirkungen der Ösophagusdyskinesie zu reduzieren, werden prokinetische Medikamente (Cerucal, Raglan, Cisaprid) oral vor den Mahlzeiten verwendet. Bei mehreren Erosionen sind Wismutpräparate (Denol, Vikair) und Solcoseryl-Injektionen angezeigt. Bei hämorrhagischer Ösophagitis, kompliziert durch Blutungen, werden Aminocapronsäurepräparate, Vikasol, Dicynon verwendet. Bei massiven Blutungen wird eine Blut- oder Plasmatransfusion verordnet. Bei einer eitrigen, nekrotischen Ösophagitis sollte der Patient lange parenteral ernährt, eine massive Therapie mit mehreren Antibiotika eingesetzt und der Abszess entleert werden. Ösophagusstrikturen werden durch Bougierung korrigiert. In seltenen Fällen wird eine Gastrostomie angelegt. Prognose. Die Prognose einer katarrhalischen und erosiven Ösophagitis ist günstig. Ein spontanes Verschwinden der Symptome einer Ösophagitis ist möglich, sofern die Grunderkrankung ausreichend behoben wird. Die Prognose einer pseudomembranösen, ekfoliativen und phlegmonösen Ösophagitis ist ernst. In allen Fällen, vorbehaltlich der Genesung der Grunderkrankung, endet die Ösophagitis mit der Bildung von Narbenstrikturen, die anschließend korrigiert werden müssen. Patienten mit schweren Formen der Ösophagitis, die durch Ösophagusstrikturen kompliziert werden, sind arbeitsunfähig. Die Prävention einer akuten Ösophagitis besteht in einer angemessenen und rechtzeitigen Diagnose und Behandlung der Grunderkrankung. 2. Chronische Ösophagitis Chronische Ösophagitis ist eine bis zu 6 Monate andauernde chronische Entzündung der Schleimhaut der Speiseröhre. Die häufigste Variante ist die Magen-Darm-Ösophagitis (Refluxösophagitis), die durch ein Magengeschwür der Speiseröhre erschwert werden kann. Ätiologie und Pathogenese. Die Hauptursache der Krankheit ist der ständige Rückfluss von Mageninhalt in die Speiseröhre, manchmal auch Galle und Darminhalt, d. h. peptische Ösophagitis ist eine aseptische Verbrennung der Speiseröhre durch Magensäure. Bei der Pathogenese der Refluxösophagitis sind das Aufstoßen von saurem Inhalt und eine Verletzung der Reinigung und Entleerung der Speiseröhre von Bedeutung. Die Clearance-Rate der Speiseröhre durch chemische Reizung wird als ösophageale Clearance bezeichnet. Bei normaler Clearance verursacht ein einmaliger Reflux aggressiver Sekrete keine Refluxösophagitis. Heißes Essen, Alkohol, Rauchen und andere exogene Faktoren verringern die Clearance der Speiseröhre. Zu diesen Faktoren gehört Fast Food, bei dem eine erhebliche Menge Luft zusammen mit der Nahrung geschluckt wird. Auch die Qualität der Nahrung spielt eine Rolle: fettes Fleisch, Schmalz, Nudeln und scharfe Gewürze helfen, die Evakuierung der Nahrung aus dem Magen zu verzögern, gefolgt vom Rückfluss des Inhalts in die Speiseröhre. Medikamente reduzieren den Tonus des unteren Ösophagussphinkters signifikant und fördern den Reflux: Calciumantagonisten, Nitrate, narkotische Analgetika, Anticholinergika, Theophyllin und seine Analoga, Medikamente aus der Prostaglandingruppe. Es gibt fünf Kriterien für die Pathogenität von Reflux bei der Genese der peptischen Ösophagitis: Häufigkeit, Volumen, Aufstoßen, chemische Zusammensetzung, Zustand der Speiseröhrenschleimhaut und Empfindlichkeit gegenüber einem chemischen Faktor (Entzündung der Wände verringert die Empfindlichkeit), Entleerungsrate (Clearance) , die hauptsächlich von aktiver Peristaltik, alkalisierendem Speichel und Schleim abhängt. Begünstigt wird das Auftreten einer Refluxösophagitis durch Hernien der ösophagealen Zwerchfellöffnung, Zwölffingerdarmgeschwür, postgastrische Resektionsstörungen und Allergien. Auch eine allergische Veranlagung spielt eine Rolle. Die morphologische Untersuchung von Patienten mit peptischer Ösophagitis zeigt Ödeme, Hyperämie der Schleimhaut, Infiltration der Submukosa des supradiaphragmatischen Segments der Speiseröhre. Es gibt zwei Möglichkeiten für die Ausbreitung einer chronischen Entzündung - totale und lokale Refluxösophagitis. Bei Beteiligung von mehr als 2/3 der Speiseröhrenschleimhaut ist die Entwicklung einer Refluxtracheitis, einer Refluxbronchitis möglich. Auf den Spitzen der Ösophagusfalten treten Erosionen und kleine Geschwüre auf (an Stellen maximaler Spülung mit Mageninhalt). Eine chronische Entzündung der Speiseröhre führt zu einer spastischen Kontraktur und Verkürzung des Organs. Klinisches Bild. Typische Anzeichen einer Refluxösophagitis sind ein brennendes Gefühl hinter dem Brustbein, Sodbrennen, Aufstoßen, das sich im Liegen verschlimmert, Schluckbeschwerden und die positive Wirkung der Einnahme von Antazida. Nach dem Essen können Schmerzen in der Brust auftreten, die an Angina pectoris erinnern. Das Auftreten von Schmerzen bei Refluxösophagitis ist mit einer peptischen Reizung der Speiseröhrenwand und ihren Krämpfen beim Aufstoßen von saurem Mageninhalt sowie mit einer Verletzung der vorgefallenen Schleimhaut verbunden. Besonderheiten dieses Schmerzes: sein langer, brennender Charakter, Lokalisation im Xiphoid-Prozess, Bestrahlung entlang der Speiseröhre, seltener in der linken Brusthälfte, keine merkliche Wirkung durch Einnahme von Antazida, Antispasmodika, verstärkt in horizontaler Position, besonders danach Essen. Besondere Aufmerksamkeit sollte bei der klinischen Diagnose geringfügigen Symptomen einer Dysphagie geschenkt werden, wie z. B. dem Gefühl eines Knotens hinter dem Brustbein oder dem Gefühl, dass heiße Nahrung durch die Speiseröhre gelangt. Ein Zeichen für eine allmählich beginnende Ösophagitis kann Speichelfluss und die Gewohnheit sein, Wasser mit Nahrung zu trinken. Die körperliche Untersuchung von Patienten mit Refluxösophagitis liefert keine diagnostisch signifikanten Informationen. Zu den Komplikationen der Refluxösophagitis gehören Blutungen, Ulzerationen, Strikturen, Verkürzung der Speiseröhre und Malignität. Eine chronische Refluxösophagitis kann zur Entwicklung einer axialen Hiatushernie führen. Diagnose und Differentialdiagnose. Die wertvollste Forschungsmethode für diese Pathologie ist die Endoskopie, bei der Hyperämie, Ödeme und Verdickung der Schleimhautfalten festgestellt werden. Zuverlässig ist ein weißlicher Belag auf der Schleimhaut, der im Anfangsstadium der Erkrankung dünn, kaum wahrnehmbar, aber mit einem langen Verlauf massiv weiß oder schmutzig grau sein kann. An manchen Stellen ist vor dem Hintergrund weißer Plaques oft die leuchtend rote Schleimhaut der Speiseröhre sichtbar. In einigen Fällen werden erosive und ulzerative Defekte in Form von Streifen festgestellt. Veränderungen der Schleimhaut können jedem der vier Stadien einer Ösophagitis entsprechen: von Hyperämie bis hin zu „weinender“ Schleimhaut. Bei einer schweren Ösophagitis sammelt sich viel Speichel und Schleim im Lumen an. Die pH-Metrie ermöglicht im Gegensatz zur Endoskopie eine objektivere Beurteilung der ösophagealen Clearance. Röntgenaufnahmen zeigen einen gastroösophagealen Reflux. Es ist notwendig, eine Refluxösophagitis mit Magen- und Zwölffingerdarmgeschwür, koronarer Herzkrankheit, chronischer Cholezystitis und Pankreatitis zu differenzieren. Leitsymptom in der Differentialdiagnose ist der Schmerz. Die Differenzierung mit Magengeschwüren wird durch das Fehlen von späten und "hungrigen" Schmerzen bei Ösophagitis sowie durch Daten aus der Endoskopie der Speiseröhre und des Magens unterstützt. Der Koronarschmerz ist im Gegensatz zur Ösophagitis gekennzeichnet durch einen Zusammenhang mit körperlicher und seelischer Belastung, der Wirkung von Nitraten, Ischämiezeichen im EKG, auch solche nach Fahrradergometrie. Ultraschalldaten der Bauchorgane helfen, die Pathologie der Gallenblase und der Bauchspeicheldrüse als Ursache des Schmerzsyndroms auszuschließen. Behandlung. Die Therapie der Refluxösophagitis umfasst die Behandlung der sie verursachenden Erkrankungen und die Verschreibung einer Antirefluxtherapie. Den Patienten wird empfohlen, das Heben von Gewichten und das Bücken zu vermeiden. Während der Ruhe und des Schlafes muss die richtige Position eingenommen werden (das Kopfteil wird um 15-20 cm in einem Winkel von 30-50 ° angehoben). Es wird empfohlen, das Körpergewicht zu normalisieren, fraktioniert zu essen (die letzte Mahlzeit - 3 Stunden vor dem Schlafengehen). Alkohol und stark gewürzte Speisen sind von der Diät ausgeschlossen. Weisen Sie Adsorptionsmittel und alkalisierende Medikamente zu, die eine schützende Wirkung auf die Schleimhaut haben. Zu diesen Substanzen gehört Venter, das oral 1 g (vorzugsweise in Form einer Suspension) 30-40 Minuten vor den Mahlzeiten 3-mal täglich und das 4. Mal - auf nüchternen Magen vor dem Schlafengehen - verabreicht wird. Die Behandlungsdauer beträgt 8-10 Wochen. Almagel, Phosphalugel, Maalox, Gastal haben eine ähnliche Wirkung. Diese Medikamente werden in der Zwischenverdauungsperiode (1/2-2 Stunden nach den Mahlzeiten und nachts) verwendet, bis eine vollständige Remission eintritt. Phosphalugel und Maalox werden 1-2 Packungen 2-3 mal täglich verschrieben, gastal - 2-3 Tabletten pro Tag. Tea Soda, eine Mischung aus Bourget und weißer Tonerde, ist aufgrund unzureichender Effizienz nicht ratsam. Umhüllende und adstringierende Wirkung hat Wismutnitrat 1 g 3-4 mal täglich. Eine hohe Antirefluxaktivität eines neuen Antazidums, Topalkan, wurde festgestellt. Mineralwasser - "Borjomi", "Essentuki Nr. 4", "Jermuk", "Smirnovskaya" wirken alkalisierend. Um die saure Magensekretion zu reduzieren, werden H-Blocker verschrieben.2Histaminrezeptoren (Cimetidin, Ranitidin, Famotidin), Ka-K-ATPase-Inhibitoren (Omeprazol), ein selektiver Blocker von M-cholinergen Rezeptoren von Belegzellen, sein Analogon Buscopan. Cimetidin wird 400 mg zweimal täglich, Ranitidin - 2 mg und Famotidin - 300 mg einmal abends nach dem Abendessen verschrieben. Omeprazol wird bei resistenten Formen der erosiven und ulzerativen Refluxösophagitis empfohlen. Es wird mit 40-30 mg pro Tag für 40-3 Wochen verschrieben. Zur Normalisierung von motorischen Evakuierungsstörungen bei Refluxkrankheit werden Metoclopramid (Cerucal, Raglan, Perinorm, Biomral), Prepulsid (Sizepride, Motilium, Domperidon, Coordinax) verschrieben. Metoclopramid und seine Analoga der 4. Generation erhöhen den Tonus des unteren Ösophagussphinkters, reduzieren den intragastrischen Druck und beschleunigen die Magenentleerung. Weisen Sie Metoclopramid 2 Tablette 1-3 mal täglich vor den Mahlzeiten oder 4 ml intramuskulär 2 mal täglich zu. Das Medikament wird in der Regel gut vertragen. Bei der Anwendung sind Mundtrockenheit, Schläfrigkeit und Tinnitus möglich, die nach dem Essen abnehmen. Sizepride ist ein neuartiges gastrointestinales Prokinetikum. Es erhöht den Tonus des unteren Ösophagussphinkters, verbessert die ösophageale Clearance, verbessert die motorische Evakuierungsfunktion des Verdauungstrakts und unterdrückt pathologische Refluxe (gastroösophageal und duodenogastral). Das Medikament blockiert im Gegensatz zu Metoclopramid nicht die Donaminrezeptoren, ist kein direktes Stimulans der anticholinergen Rezeptoren und weist keine Nebenwirkungen auf, die Cerucal und seinen Analoga inhärent sind. Es wird oral mit 5 oder 10 mg 2-3 mal täglich verschrieben. Der Behandlungsverlauf dauert 2-3 Wochen bis 2-3 Monate. Cesaprid kann bei Refluxösophagitis als Monotherapie eingesetzt werden. Prognose und Prävention. Die Prognose für Leben und Beruf ist günstig. In komplizierten Fällen wird die Prognose von der Aktualität und Qualität der medizinischen Versorgung bestimmt. Patienten mit schwerer Erkrankung werden einer Behinderungsgruppe zugeordnet. Patienten mit chronischer Refluxösophagitis sollten unter der Aufsicht eines Gastroenterologen stehen. Endoskopische und morphologische Untersuchungen sind aufgrund der Möglichkeit einer Malignität mindestens zweimal im Jahr angezeigt. 3. Magengeschwür der Speiseröhre Magengeschwür der Speiseröhre ist eine akute oder chronische Erkrankung, die durch Ulzeration der Schleimhaut der distalen Speiseröhre unter dem Einfluss von aktivem Magensaft gekennzeichnet ist. Ätiologie und Pathogenese. Chronische Magengeschwüre der Speiseröhre sind Komplikationen der Refluxösophagitis und der Hiatushernie. Ihr Auftreten wird durch eine innere kurze Speiseröhre, fokale Metaplasie der Schleimhaut, Heterotopie der Magenschleimhaut in die Speiseröhre, Refluxkrankheit mit Herzinsuffizienz, Erkrankungen mit häufigem Erbrechen (Postvagotomiesyndrom, afferentes Schleifensyndrom, chronischer Alkoholismus) begünstigt. Akute Geschwüre der Speiseröhre sind bei pathologischer Trockenheit der Speiseröhrenschleimhaut (Xerosis), Arzneimittelallergien, NSAR-Einnahme, Pilzinfektionen, Virusinfektionen, Hautverbrennungen und Erkrankungen des zentralen Nervensystems möglich. Diese Geschwüre gelten als symptomatisch. Klinisches Bild. Bei einigen Patienten kommt es zu einer kombinierten ulzerativen Läsion der Schleimhaut der Speiseröhre und der gastroduodenalen Zone. Die Symptome eines Magengeschwürs der Speiseröhre ähneln dem Krankheitsbild einer peptischen Ösophagitis: Es kommt zu anhaltendem Sodbrennen, Verschlimmerung nach dem Essen, beim Beugen des Körpers, im Liegen, Aufstoßen, Schmerzen beim Schlucken und einer gestörten Passage fester Nahrung. Für Ösophagusgeschwüre typische Komplikationen: Perforation, Blutung, Penetration, Striktur. Blutungen äußern sich in Hämatemesis, Meläna, hypochromer Anämie und einer Abnahme der Herzaktivität. Eine Perforation der Speiseröhre wird äußerst selten diagnostiziert. Die klinischen Symptome einer Perforation sind nicht von den Symptomen einer akuten penetrierenden und nicht penetrierenden mechanischen Verletzung durch Fremdkörper zu unterscheiden. Etwa 14 % der Speiseröhrengeschwüre dringen in das umgebende Gewebe ein. Diagnose und Differentialdiagnose. Aufgrund der klinischen Symptome ist es äußerst schwierig, ein Magengeschwür zu vermuten. Die Diagnose wird durch Instrumenten- und Laboruntersuchungen überprüft. Am informativsten ist die Röntgen- und endoskopische Untersuchung. Radiologisch erscheint das Ulkus als Nische im suprakardialen Ösophagus mit leichtem perifokalem Ödem der Schleimhaut. Die Speiseröhre im Bereich des Geschwürs ist spastisch verengt, darüber ist eine leichte suprastenotische Ausdehnung festzustellen. Das Geschwür wird von Anzeichen einer Hyperkinesie und einer Refluxösophagitis begleitet, und Symptome einer Hiatushernie sind sehr häufig. Manchmal ähnelt das Geschwür einem kleinen epiphrenischen Divertikel, das jedoch keinen typischen klinischen Verlauf aufweist und nicht mit einer Herzinsuffizienz, einem Leistenbruch oder einer Ösophagitis einhergeht. Es ist schwieriger, ein Magengeschwür der Speiseröhre von einem ulzerierten endophytischen Krebs zu unterscheiden, der durch radiologische Zeichen mit einer Steifigkeit der Wände und einer Entlastung der Schleimhaut und einem asymmetrischen Schaft einhergeht. Die zuverlässigsten Informationen bei der Überprüfung von Magengeschwüren der Speiseröhre liefern Endoskopie und multiple Biopsie von den Rändern des Geschwürs. Beim Vorschieben des Endoskops zum Magengeschwür zeigen sich Anzeichen einer Ösophagitis im Stadium I-IV, einer motorischen Dysfunktion der Speiseröhre, eines perifokalen Ödems und einer Hyperämie der Schleimhaut. Ein akutes Geschwür ist normalerweise rund oder oval, mit steilen Rändern, die mit einem weißlichen oder grünen Belag bedeckt sind. Ein chronisches Geschwür hat einen flachen Boden mit dichten und unebenen Wänden, sanften Rändern, eitrig-fibrinösen Ablagerungen, Granulationsherden und Narbenüberzügen. Um Malignität auszuschließen, werden 4-6 Biopsien von den Rändern des Geschwürs entnommen. Die endoskopische Untersuchung zeigt einzelne peptische Defekte, die entlang der Achse der Speiseröhre verlängert sind. Ihre Länge variiert zwischen 1 und 10 cm, überschreitet jedoch häufiger nicht 1 cm, das Geschwür ist oft flach, sein Boden ist mit einer weißlichen Beschichtung bedeckt. Hyperämie, Schleimhautödem und einzelne Erosionen spiegeln oft eine moderate perifokale Entzündungsreaktion wider. Nach Abheilung eines Magengeschwürs verbleibt in der Speiseröhre eine grobe lineare oder sternförmige Narbe oder eine grobe divertikelartige Deformation der Wand und Einengung des Lumens. Es ist notwendig, Magengeschwüre der Speiseröhre mit Ulzerationen bestimmter Art (mit Tuberkulose, Syphilis) zu differenzieren. In diesen Situationen helfen spezifische serologische Tests, die Ergebnisse histologischer und bakteriologischer Studien erheblich. Die Kombination der Pathologie der Speiseröhre mit Schädigungen der Lunge und anderer Organe macht es erforderlich, den Patienten gezielt auf einen bestimmten Prozess hin zu untersuchen. Behandlung. Zur Behandlung gehört eine Diät: Empfohlen wird mechanisch und chemisch schonende Kost, die 5-6 mal täglich in kleinen Portionen eingenommen wird. Um den Rückfluss von Mageninhalt in die Speiseröhre zu verhindern, sollte der Patient im Bett mit angehobenem Kopfende des Bettes liegen. Medikamente werden im Liegen eingenommen. Eine Monotherapie wird mit einem Medikament aus einer der folgenden pharmakologischen Gruppen verschrieben: antisekretorische Mittel, einschließlich Antazida und Adsorbentien, Stimulanzien der motorischen Evakuierungsfunktion des Magens (Prokinetika), Medikamente – Schleimsimulatoren. Die Therapie wird über einen langen Zeitraum durchgeführt - 1,5-3 Monate. Indikationen zur chirurgischen Behandlung - Ausbleibende Heilung innerhalb von 6-9 Monaten, komplizierter Verlauf (Perforation, Penetration, Stenose, Blutung). Prognose und Prävention. Der Krankheitsverlauf ist schubförmig. Die Prognose für Leben und Beruf ist günstig. Eine regelmäßige (1-2 mal im Jahr) ambulante Untersuchung durch einen Gastroenterologen mittels Endoskopie und Biopsie wird empfohlen. Saisonale (Frühling - Herbst) Prävention von Refluxösophagitis wird durchgeführt. VORTRAG Nr. 10. Erkrankungen des Verdauungstraktes. Erkrankungen des Magens. Chronische Gastritis Chronische Gastritis ist eine Krankheit, die klinisch durch Magendyspepsie und morphologisch durch entzündliche und degenerative Veränderungen der Magenschleimhaut, gestörte Zellerneuerungsprozesse und eine Zunahme der Anzahl von Plasmazellen und Lymphozyten in der schleimhauteigenen Membran gekennzeichnet ist. Ätiologie und Pathogenese. Im gegenwärtigen Entwicklungsstadium der Gastroenterologie wurde festgestellt, dass das Auftreten einer chronischen Gastritis durch die mikrobielle Ausbreitung von Helicobacter pylori (HP) begünstigt wird, die in 95 % der Fälle eine antrale Gastritis und in 56 % der Fälle eine Pangastritis verursacht. Die sogenannten ätiologischen Faktoren für das Auftreten einer chronischen Gastritis lassen sich wiederum mit hoher Sicherheit auf Risikofaktoren zurückführen (unregelmäßige einseitige Ernährung, Rauchen, Alkoholkonsum, Salzsäure- und Pepsinsekretion). Die führende Rolle bei der Entwicklung der Krankheit gehört auch zu Autoimmunmechanismen, begleitet von der Anhäufung von Antikörpern gegen die Belegzellen der Magenschleimhaut, einer verstärkten Vererbung sowie der Verwendung von Medikamenten, die eine schädigende Wirkung auf die Magenschleimhaut haben. Einstufung. Im Jahr 1990 wurde auf dem IX. Internationalen Kongress der Gastroenterologen in Australien eine neue Systematisierung der chronischen Gastritis, das sogenannte Sydney-System, verabschiedet. Histologische Grundlagen der Klassifikation. 1) Ätiologie: chronische Gastritis in Verbindung mit HP, autoimmune, idiopathische, akute arzneimittelinduzierte Gastritis. 2) Topographie: Antrum, Fundus, Pangastritis. 3) Morphologie: akute, chronische, Sonderformen. Endoskopische Klassifizierungsgrundlage: 1) Gastritis des Antrums des Magens; 2) Gastritis des Magenkörpers; 3) Pangastritis; 4) Veränderungen der Magenschleimhaut: Ödem, Erythem, Schleimhautanfälligkeit, Exsudat, flache Erosionen, erhabene Erosionen, Faltenhyperplasie, Faltenatrophie, Sichtbarkeit des Gefäßmusters, supramukosale Blutungen. Klinisches Bild. Chronische Gastritis ist eine der häufigsten Erkrankungen in der Klinik für Innere Medizin. Seine Häufigkeit unter der Weltbevölkerung liegt zwischen 28 und 75 %. Chronische Gastritis äußert sich häufiger in Symptomen von Magendyspepsie und Schmerzen in der Magengegend. Selten ist es asymptomatisch. Der Schmerz ist normalerweise in der Magengegend lokalisiert. Es besteht ein eindeutiger Zusammenhang zwischen dem Auftreten bei Nahrungsaufnahme und der Lokalisation des Entzündungsprozesses im Magen. Bei Patienten mit Gastritis des subkardialen und kardialen Magenabschnitts treten Schmerzen in der Magengegend 10-15 Minuten nach einer Mahlzeit auf, mit einer Pathologie des Magenkörpers - 40-50 Minuten nach einer Mahlzeit. "Spät", "hungrig", Schmerzen sind typisch für Gastritis des Ausgangsabschnitts des Magens oder Duodenitis. "Zwei-Wellen" -Schmerzen - nach dem Essen und auf nüchternen Magen - werden bei Gastritis des Subkardials und des Antrums beobachtet. Bei einem diffusen Prozess ist der Schmerz in der Magengegend lokalisiert, tritt nach dem Essen auf und ist drückender Natur. Sie sagen über den asymptomatischen Verlauf der Gastritis, wenn es nicht möglich ist, die Beziehung zwischen Schmerzen in der Magengegend und der Läsion herzustellen, die auftritt, wenn sie endogenen Ursprungs ist (Gastritis wird sekundär zur Pathologie anderer Organe und Systeme). Ein ebenso wichtiger Platz im Krankheitsbild der chronischen Gastritis ist das dyspeptische Syndrom: Übelkeit, Aufstoßen (sauer, bitter, faul), Sodbrennen, Verstopfung oder Durchfall, instabiler Stuhl. Bei isolierter antraler Gastritis stehen Beschwerden über Sodbrennen und Verstopfung im Vordergrund, die durch die Hypersekretion von Salzsäure und Pepsin entstehen. Bei Pangastritis mit Anzeichen schwerer Atrophie überwiegen Übelkeit, Aufstoßen "faul", instabiler Stuhl oder Durchfall, was typisch für die Hyposekretion von Salzsäure und Pepsin ist. Anhaltende Übelkeit ist charakteristisch für sekundäre Gastritis bei chronischer Pankreatitis, chronischer Cholezystitis, die bei hypomotorischer Dyskinesie der Gallenblase auftritt. Diagnostik. Eine chronische Gastritis dauert lange, wobei die Symptome mit der Zeit zunehmen. Exazerbationen werden durch Ernährungsstörungen hervorgerufen. Das körperliche Bild einer chronischen Gastritis ist eher schlecht. Bei 80-90% der Patienten während einer Exazerbation der Krankheit bestimmt eine objektive Studie nur lokale Schmerzen in der Magengegend. Wenn chronische Gastritis mit Duodenitis, Cholezystitis oder Pankreatitis kombiniert wird, kann eine für Gastritis nicht typische, aber für die Pathologie eines anderen Organs charakteristische Schmerzlokalisation bestimmt werden. Allgemeine Blut- und Urintests, biochemische Parameter des Blutes bei Patienten mit chronischer Gastritis unterscheiden sich nicht von den entsprechenden Parametern bei gesunden Personen. Bei einer koprologischen Untersuchung gibt es keine Veränderungen in den Analysen oder es können Anzeichen einer Verdauungsstörung vorliegen. Bei der Untersuchung des Mageninhalts der Säuresekretion durch pH-Metrie werden sowohl Anzeichen einer Säurehypersekretion als auch das Phänomen einer Abnahme der Säureproduktion festgestellt. Indikatoren für die Bildung von Pepsin bei chronischer Gastritis sind hartnäckiger und nehmen vor dem Hintergrund einer anhaltenden Anazidität bei diffusen Organschäden ab. Eine Röntgenuntersuchung kann eher andere Erkrankungen des Magens (Geschwür, Krebs) ausschließen und bei der Diagnose von Morbus Menetrier helfen als die Diagnose einer chronischen Gastritis zu bestätigen. Aufgrund des Mangels an klinischen Manifestationen der Krankheit sowie der Unspezifität von Labortests basiert die Diagnose einer chronischen Gastritis auf den Ergebnissen endoskopischer und morphologischer Studien. Die Endoskopie zeigt Veränderungen in der Schwere der Magenschleimhaut unterschiedlicher Schwere: Ödem, Erythem, Vulnerabilität der Schleimhaut, Exsudat, flache Erosionen, erhabene Erosionen, Hyperplasie oder Atrophie der Falten, Sichtbarkeit des Gefäßmusters, submuköse Blutungen. Sie sprechen von einer chronischen Gastritis mit einer Zunahme der Anzahl von Plasmazellen und Lymphozyten in der eigenen Membran der Schleimhaut (im Gegensatz zur akuten Gastritis, wenn polymorphkernige Leukozyten auftreten). Im Zusammenhang mit dem Vorstehenden stimmt die morphologische Identifizierung einer Entzündung bei Gastritis möglicherweise nicht mit der Interpretation der Daten des Klinikers überein. Die Aktivität entzündlicher Veränderungen der Magenschleimhaut wird morphologisch und morphometrisch nach dem Grad der Leukozyteninfiltration der Lamina propria oder des Epithels beurteilt. Wir dürfen nicht aus den Augen verlieren, dass die autoimmune Gastritis nicht aktiv ist. Morphologische Veränderungen (schwach, moderat und schwer) – Entzündung, Aktivität, Atrophie, Metaplasie – und der Grad der HP-Kontamination werden quantifiziert. Klinische Manifestationen, die für Gastritis charakteristisch sind, werden auch bei anderen Erkrankungen des Verdauungssystems beobachtet, daher sind im Diagnoseprozess Ultraschall der Bauchhöhle, eine gründliche endoskopische und morphologische Untersuchung der Verdauungsorgane erforderlich. Differenzialdiagnose. Am schwierigsten ist die Differentialdiagnose von Gastritis mit funktionellen Erkrankungen des Magens, Magen- und Zwölffingerdarmgeschwüren, chronischer Cholezystitis und Pankreatitis sowie Magenkrebs. Funktionelle Erkrankungen des Magens, ähnlich einer chronischen Gastritis, können latent auftreten oder mit Schmerzen und dyspeptischen Symptomen einhergehen. Sie sind durch eine kurze Dauer gekennzeichnet, das Vorhandensein allgemeiner neurotischer Symptome, die im klinischen Bild der Krankheit vorherrschen (wie Schwäche, Müdigkeit, Reizbarkeit, Kopfschmerzen, instabile Stimmung, Schwitzen). Bei Störungen der Magenfunktion hängen die Schmerzen nicht von der Qualität der Nahrung ab, oder sie treten nach der Einnahme eines genau definierten Produktes auf. Oft besteht ein Syndrom des Säureismus (Sodbrennen, saures Aufstoßen, saurer Geschmack im Mund), das im Gegensatz zu einer Gastritis mit erhöhter sekretorischer Funktion nicht nach dem Essen zunimmt, sondern bei Aufregung, langen Esspausen. Erbrechen bei funktionellen Pathologien des Magens entwickelt sich nach dem Mechanismus eines konditionierten Reflexes, bringt dem Patienten Erleichterung und führt nicht zu einer signifikanten Verschlechterung des Allgemeinzustandes. Bei einer chronischen Gastritis tritt sie meist während einer Exazerbation auf und bringt dem Patienten keine Linderung. Ein häufiges Symptom einer Funktionsstörung des Magens ist ein lautes Aufstoßen von Luft. Bei chronischer Gastritis ist sie mit einer gestörten Nahrungsverdauung oder Magenmotilität verbunden und kann sauer sein, wenn die Sekretion erhalten bleibt, oder mit dem Geruch fauler Eier, wenn sie reduziert ist. Bei der Untersuchung der Magensekretion bei Gastritis werden zu Beginn der Erkrankung normale Sekretionswerte und in Zukunft eine Tendenz zu einer Abnahme der Magensaftsekretion festgestellt. Bei funktionellen Erkrankungen des Magens wird häufig Heterochilien beobachtet. Die Röntgenuntersuchung des Magens ermöglicht die Bestätigung solcher Formen der Gastritis wie starr, angraal, riesenhyperplastisch, Polyposis und zeigt bei Verletzungen der motorischen Evakuierungsfunktion des Magens (Gastroptose, Hypotonie) die funktionelle Natur an die Krankheit. Die wertvollste Forschungsmethode zur Differentialdiagnose von chronischer Gastritis und funktionellen Erkrankungen des Magens ist die Gastroskopie, die es ermöglicht, in kontroversen Fällen Veränderungen der Magenschleimhaut festzustellen, die für Gastritis oder funktionelle Erkrankungen des Magens charakteristisch sind. Die Differentialdiagnose der chronischen Gastritis mit Magengeschwür wird in der nächsten Vorlesung beschrieben. Magenkrebs hat ein sehr ähnliches Bild wie Gastritis mit reduzierter sekretorischer Funktion. Eine frühzeitige Diagnose von Magenkrebs auf der Grundlage klinischer Symptome ist schwierig, insbesondere bei Patienten, die seit langem an Gastritis leiden. Von großer Bedeutung für die Diagnose einer Krebserkrankung sind das Auftreten anhaltender Dauerschmerzen, die wenig von der Nahrungsaufnahme abhängig sind, unmotivierte allgemeine Schwäche und Müdigkeit, Appetitlosigkeit sowie eine fortschreitende Abnahme des Körpergewichts des Patienten. Der Nachweis eines Tumors bei Palpation bezieht sich auf die späteren Stadien des Krebsprozesses. Symptome wie eine Veränderung des Wohlbefindens des Patienten, eine schnelle Abnahme des Säuregehalts des Magensafts, ein "Mangel" an Salzsäure, das Auftreten atypischer Zellen im Magensaft, eine positive Reaktion auf okkultes Blut im Kot sollten sein den Arzt auf Magenkrebs hinweisen. Differenzialdiagnostisch von entscheidender Bedeutung sind Röntgen- und Gastroskopieuntersuchungen mit gezielter Biopsie der Magenschleimhaut. Bei Patienten mit chronischer Gastritis mit reduzierter sekretorischer Funktion zeigt die Röntgenuntersuchung eine Atrophie der Schleimhaut, die auch durch Gastroskopie bestätigt wird. Bei einer gezielten Biopsie werden in solchen Fällen strukturelle Veränderungen und eine Atrophie der Schleimhaut aufgedeckt. Bei Magenkrebs ist die Röntgenuntersuchung durch das Vorhandensein eines Füllungsdefekts, das Fehlen von Schleimhautfalten oder einer Veränderung ihrer Beschaffenheit und das Fehlen von Peristaltik in bestimmten Bereichen gekennzeichnet. Die Endoskopie des Magens ermöglicht es, einen Tumor im frühesten Stadium seiner Entwicklung zu erkennen, wenn sich der Tumor noch in der Magenschleimhaut befindet, und eine chirurgische Behandlung führt in mehr als 90 % der Fälle zur Heilung. Chronische Cholezystitis. Bei der chronischen Cholezystitis ist der Schmerz im rechten Hypochondrium lokalisiert und von dumpfer Natur. Bei einer kalkhaltigen Cholezystitis ist der Schmerz akut, kolikartig und strahlt in die rechte Subskapulierregion aus. Das Auftreten von Schmerzen ist mit dem Verzehr von fetthaltigen Lebensmitteln oder ruckartigem Fahren verbunden. Bei chronischer Gastritis ist der Schmerz im Epigastrium diffus, dumpf, es gibt keine Bestrahlung, er tritt unmittelbar nach dem Verzehr von Trockenfutter oder bei Verletzung der Diät auf. Bei Gastritis und Cholezystitis wird der Schmerz von dyspeptischen Symptomen begleitet, aber ein Gefühl von Schwere im Epigastrium, Völlegefühl, Aufstoßen von Nahrung oder Luft, ein metallischer Geschmack im Mund sind charakteristischer für Gastritis. Erbrechen bei chronischer Gastritis ist selten. Objektiv bei chronischer Cholezystitis, insbesondere bei Kalk, erkennen sie Spannungen in der vorderen Bauchwand, Hauthyperästhesie im rechten Hypochondrium, was für chronische Gastritis nicht typisch ist. Bei der Palpation des Abdomens bei chronischer Cholezystitis werden Schmerzen in der Lokalisation der Gallenblase festgestellt. Chronische Gastritis ist durch diffuse Schmerzen gekennzeichnet. Bei Patienten mit chronischer Cholezystitis zeigt die Gallenuntersuchung eine Zunahme der Menge an Schleim und Leukozyten. Chronische Gastritis ist durch ein normales Bild der Galle vor dem Hintergrund von Veränderungen in der Sekretion und dem Säuregehalt von Magensaft sowie anderen Funktionen des Magens (Resorption, Motorik) gekennzeichnet. Eine Röntgenuntersuchung der Gallenblase bei Patienten mit chronischer Cholezystitis zeigt eine Veränderung ihrer Evakuierungsfunktion sowie Steine. Eine chronische Pankreatitis. Bei einer chronischen Pankreatitis ist der Schmerz in der linken Bauchhälfte lokalisiert und strahlt in die linke Subskapularregion, in den unteren Rücken und in die Umgebung aus. Das Auftreten von Schmerzen ist mit dem Verzehr reichlicher, oft fetthaltiger Nahrungsmittel und Alkohol verbunden. Wenn die chronische Gastritis durch einen langen, monotonen Krankheitsverlauf gekennzeichnet ist, dann ist es bei der chronischen Pankreatitis schrittweise. Eine objektive Untersuchung bei chronischer Pankreatitis zeigt eine Hyperästhesie der Haut im linken Hypochondrium, Schmerzen entsprechen topographisch der Lage der Bauchspeicheldrüse. In einer Laborstudie von Pankreassaft bei chronischer Pankreatitis wird eine anhaltende Veränderung der Alkalinität und der Enzyme festgestellt: Der Diastasespiegel im Blut und Urin kann sich ändern, was bei chronischer Gastritis nicht der Fall ist. Radiologisch ist die chronische Pankreatitis durch eine verstärkte Umkehrung des Zwölffingerdarmrings, eine starke Zunahme ihrer Hauptpapille (Frostberg-Symptom) und manchmal durch das Vorhandensein von Verkalkungsbereichen der Bauchspeicheldrüse gekennzeichnet. Auch sollte eine intranosologische Diagnostik verschiedener Formen der chronischen Gastritis durchgeführt werden. Somit verläuft die mit HP assoziierte Erkrankung klinisch mit Symptomen von Zwölffingerdarmgeschwüren, und in einigen Fällen kann sie latent fortschreiten. Die endoskopische und morphologische Untersuchung zeigt eine Antropylorhoduodenitis. Erosionen bei Helicobacter-pylori-Gastritis sind normalerweise im Bereich schwerer Entzündungen (anthropylorische Zone des Magens) lokalisiert. Die autoimmune chronische Gastritis ist klinisch gekennzeichnet durch ein Schweregefühl in der Magengegend, einen unangenehmen Nachgeschmack im Mund, faules Aufstoßen und Übelkeit. Aufgrund der unzureichenden Produktion von Salzsäure tritt Durchfall auf. In 10% der Fälle werden vor dem Hintergrund einer Autoimmungastritis Symptome gefunden B12- Mangelanämie: Schwäche, Blässe der Haut und Schleimhäute, brüchige Nägel, bei Blutuntersuchungen - hyperchrome Megaloblastenanämie. Sonderformen der Erkrankung sind granulomatöse, eosinophile, hypertrophe (Morbus Menetrier), lymphozytäre Gastritis. Granulomatöse Gastritis wirkt als eigenständige Form der Krankheit oder häufiger - eine der Komponenten einer schwerwiegenderen Pathologie (Morbus Crohn, Tuberkulose, Sarkoidose). Die Diagnose wird immer durch die Ergebnisse der histologischen Untersuchung von Biopsieproben der Magenschleimhaut bestätigt. Eosinophile Gastritis ist extrem selten und wird durch systemische Vaskulitis verursacht. Eine Anamnese allergischer Reaktionen ist obligatorisch. Die histologische Untersuchung zeigt eine eosinophile Infiltration der Magenschleimhaut. Die hypertrophe Gastritis (Morbus Menetrier) äußert sich klinisch durch Schmerzen im Oberbauch und Übelkeit. Bei einigen Patienten kann es aufgrund von Durchfall zu Gewichtsverlust kommen. In endoskopischen, radiologischen und morphologischen Studien werden riesige hypertrophierte Schleimhautfalten gefunden, die den Windungen des Gehirns ähneln. Lymphozytäre Gastritis ist klinisch asymptomatisch; morphologisch ist diese Form durch eine ausgeprägte Lymphozyteninfiltration der Magenschleimhaut gekennzeichnet. Behandlung. Patienten mit Gastritis benötigen allgemeinmedizinische Maßnahmen: regelmäßige ausgewogene Ernährung, Normalisierung von Arbeits- und Ruhezeiten, Ausgleich von Stresssituationen im Alltag und Beruf. Eine medikamentöse Therapie ist nur bei klinischen Manifestationen einer chronischen Gastritis angezeigt. Patienten mit HP-assoziierter Gastritis werden mit einem Magengeschwür-Programm behandelt (siehe nächste Vorlesung). Personen mit Autoimmungastritis benötigen eine Vitamin-B-Ergänzung12 (500 mcg einmal täglich subkutan für 1 Tage, gefolgt von einer Wiederholung der Behandlungszyklen), Folsäure (30 mg pro Tag), Ascorbinsäure (bis zu 5 g pro Tag). Bei Bedarf wird eine Ersatztherapie mit Enzympräparaten (Mezim-Forte, Festal, Enzistal, Kreon, Pancitrat, Acidin-Pepsin) durchgeführt. Das Schmerzsyndrom wird normalerweise durch die Ernennung von Antazida (Maalox, Almagel, Gastal) oder H-Histaminrezeptorblockern (Ranitidin, Famotidin) in mittleren therapeutischen Dosen gestoppt. Bei besonderen Formen der Gastritis ist eine Behandlung der Grunderkrankung notwendig. Prognose und Prävention. Die Prognose für Leben und Beruf ist günstig. Patienten mit chronischer Gastritis sollten bei einem Gastroenterologen registriert werden. Sie werden mindestens einmal im Jahr klinisch und endoskopisch mit einer Biopsie untersucht, um eine Tumortransformation auszuschließen. Am gefährlichsten im Hinblick auf eine krebsartige Entartung sind hypertrophe, diffuse atrophische Gastritis mit epithelialer Dysplasie. Bei erosiven Formen der durch Blutungen komplizierten Krankheit sowie bei der dekompensierten Form des Morbus Menetrier wird die Prognose durch die Rechtzeitigkeit und Angemessenheit der chirurgischen Behandlung bestimmt. Die Vorbeugung von Gastritis wird auf eine rationelle Ernährung, die Einhaltung des Arbeits- und Ruheregimes und die Begrenzung der Einnahme von NSAIDs reduziert. VORTRAG Nr. 11. Erkrankungen des Verdauungstraktes. Erkrankungen des Magens. Magengeschwür Magengeschwür (Magengeschwür) ist eine chronische, rezidivierende Krankheit, die sich klinisch durch eine funktionelle Pathologie der gastroduodenalen Zone und morphologisch manifestiert - durch eine Verletzung der Integrität ihrer Schleim- und Submukosaschichten, und daher heilt das Geschwür immer mit der Bildung von eine Narbe. Ätiologie. Der wichtigste ätiologische Faktor der Magengeschwürerkrankung ist die mikrobielle Ausbreitung von HP auf der Oberfläche des Magenepithels. Die Bedeutung der bakteriellen Aggression in der Ätiologie der Krankheit wurde seit 1983 untersucht, als J. Warren und B. Marshall über die Entdeckung einer großen Anzahl von S-Spiral-Bakterien auf der Oberfläche des Epithels des Antrums des Magens berichteten. Helicobakterien können aufgrund der Produktion des Urease-Enzyms, das Harnstoff (aus dem Blutkreislauf) in Ammoniak und Kohlendioxid umwandelt, in einer sauren Umgebung existieren. Die Produkte der enzymatischen Hydrolyse neutralisieren Salzsäure und schaffen Bedingungen für die Veränderung des pH-Werts der Umgebung um jede Bakterienzelle, wodurch günstige Bedingungen für die lebenswichtige Aktivität von Mikroorganismen geschaffen werden. Die vollständige Kolonisierung von HP erfolgt auf der Oberfläche von Magenepithelzellen, die von einer Schädigung des Epithels unter Einwirkung von Phospholipasen begleitet wird. Letztere sorgen für die Bildung von toxischen Lecithinen und Proteinasen aus der Galle, wodurch schützende Proteinkomplexe und Schleim zerstört werden. Vor dem Hintergrund der "Alkalinisierung" der Membranen von Epithelzellen mit Ammoniak ändert sich das Membranpotential der Zellen, die umgekehrte Diffusion von Wasserstoffionen nimmt zu, der Tod und die Abschuppung des Epithels der Magenschleimhaut. All diese Veränderungen führen zum Eindringen von HP in die Tiefe der Magenschleimhaut. Nicht weniger wichtig für die Entstehung von Magengeschwüren sind neuropsychische Effekte, erbliche Veranlagung, Infektionserreger, Ernährungsfehler und die Einnahme bestimmter Medikamente sowie schlechte Angewohnheiten. Das neurogene Konzept des Krankheitsbeginns wurde erstmals von Bergman formuliert, der argumentierte, dass erblich-konstitutionelle Störungen des autonomen Nervensystems zu Spasmen der Muskeln und Blutgefäße in der Magenwand, Ischämie und einer Abnahme führen in der Resistenz der Schleimhaut gegen die aggressive Wirkung von Magensaft. Diese Theorie wurde von K. N. Bykov und I. T. Kurtsin (1952) weiterentwickelt. Sie untermauerten die kortikoviszerale Theorie der Ulzerogenese, die auf Daten über Veränderungen der höheren Nervenaktivität als Folge chronischer neuropsychischer Traumatisierung basiert. Ergänzt und detailliert durch die Lehre von den biochemischen und hormonellen Zusammenhängen bei der Regulation der Magensekretion, -motilität und -trophie hat diese Theorie der Ulzerogenese in den letzten Jahren wieder viele Anhänger gewonnen. Erbliche Faktoren sind bei Forschern beliebt: Trägheit der wichtigsten Nervenprozesse, gruppenspezifische Eigenschaften des Blutes, immunologische und biochemische Merkmale, erbliches Belastungssyndrom. Beim Auftreten von Magengeschwüren wurde den Ernährungsstörungen eine wesentliche Bedeutung beigemessen. Klinische und experimentelle Studien, die in den letzten zwei Jahrzehnten durchgeführt wurden, zeigten jedoch in den meisten Fällen nicht die schädigende Wirkung von Nahrungsmitteln auf die gastroduodenale Schleimhaut. Die Prävalenz der peptischen Ulkuskrankheit unter erheblichen Kontingenten von Menschen mit unterschiedlichen Ernährungsgewohnheiten spricht ebenfalls gegen die führende Bedeutung von Ernährungsfaktoren. Störungen im Rhythmus und der Regelmäßigkeit der Ernährung, lange Pausen zwischen den Mahlzeiten, vorzeitiges Essen sind wesentlich für das Auftreten von Magengeschwüren. Forscher haben relativ widersprüchliche Ansichten über die Rolle von Alkohol bei der Ulkusentstehung geäußert. Es ist bekannt, dass Alkohol atrophische Veränderungen der Magenschleimhaut verursacht. Diese Beobachtungen stehen im Widerspruch zum allgemeinen Konzept der Ulzeration. Der häufige Alkoholkonsum geht jedoch mit Verstößen gegen die Ernährung und qualitativen Veränderungen in der Zusammensetzung der Nahrung einher, die letztendlich zu Magen- und Zwölffingerdarmgeschwüren führen können. Die Rolle medizinischer Wirkungen bei der Ulzerogenese wird aktiv untersucht. Die in der Literatur veröffentlichten Studienergebnisse und eigene Daten weisen darauf hin, dass nichtsteroidale Antirheumatika und Glukokortikoidhormone die ausgeprägtesten ulzerogenen Eigenschaften besitzen. Pathogenese. Die Pathogenese der Magengeschwürerkrankung ist noch nicht vollständig geklärt. Bei der Betrachtung der Prozesse der Ulzerogenese müssen eine Reihe von Postulaten hervorgehoben werden: 1) gekennzeichnet durch saisonale Exazerbationen von Magengeschwüren; 2) Es gibt eine vorherrschende Lokalisation von Magengeschwüren in der antropyloroduodenalen Zone; 3) das Vorhandensein von Salzsäure und Pepsin im Magensaft wurde festgestellt; 4) eine hohe Häufigkeit (bis zu 70%) der spontanen Heilung von Magen- und Zwölffingerdarmgeschwüren ist erkennbar; 5) es gibt eine mit HP assoziierte chronische antrale Gastritis; 6) der anthropylorische Teil des Magens und der Anfangsteil des Zwölffingerdarms sind der "Hypothalamus" des Gastrointestinaltrakts; 7) es besteht eine erbliche Veranlagung zum Auftreten von Magengeschwüren; 8) Das Auftreten eines Geschwürs, sein Wiederauftreten und seine Remission sind bei Vorhandensein aller oben genannten Faktoren möglich. Somit lautet das einheitliche Konzept der Ulzerogenese wie folgt. Bei einem Patienten mit einer erblichen Veranlagung zu Magengeschwüren bei chronischer bakterieller Gastritis während der Herbst- oder Frühlings-Dishormonose werden nur Hyperplasie und Überfunktion endokriner Zellen festgestellt, die Gastrin, Histamin, Melatonin und Serotonin sezernieren. Die wichtigsten Hormone und biogenen Amine, die von der Anthropylorudodenalzone produziert werden, sind sowohl an der Stimulierung der Magensekretion als auch an der Veränderung des Trophismus und der Zellproliferation, hauptsächlich in dieser Zone, beteiligt. Vor dem Hintergrund einer aktiven bakteriellen Gastritis und Duodenitis ergeben sich günstige Bedingungen für die Ulkusbildung. Mit der Bildung eines peptischen Defekts nimmt die funktionelle Aktivität endokriner Zellen ab. Dies führt zu einer Abnahme der säure-peptischen Aggression, einer Verbesserung des Gewebetrophismus in der Anthropyloroduodenalzone und der Schaffung von Bedingungen für die Heilung von Magen- und Zwölffingerdarmgeschwüren auch vor dem Hintergrund der anhaltenden mikrobiellen Expansion von HP. In der akuten Phase des Magengeschwürs wird eine Hyperplasie von α-Endorphin-produzierenden Zellen festgestellt, die universelle Zytoprotektoren sind. Sie wirken als Hauptschutzmechanismen bei Magengeschwüren und sorgen für den Prozess der Selbstbegrenzung des Geschwürs und seiner Heilung, sowohl direkt als auch durch Stimulierung des Immunsystems. Gleichzeitig binden Antikörper gegen HP, die in der Submukosa des Magens und Zwölffingerdarms synthetisiert werden, effektiv an Bakterienzellen und neutralisieren HP-Toxine und tragen zu ihrem Tod bei. All dies trägt zur Schaffung eines Gleichgewichts zwischen den sogenannten Aggressionsfaktoren und Schutzfaktoren und zur Heilung eines Magendefekts in der gastroduodenalen Zone bei. Einstufung. Klassifikation (Panfilov Yu. A., Osadchuk M. A., 1991) Lokalisation des Magen-Darm-Defekts: 1) Magengeschwür (subkardiale und kardiale Abschnitte, Pylorusteil und Pyloruskanal, kleinere und größere Krümmung); 2) Zwölffingerdarmgeschwür (bulbärer und postbulbärer Abschnitt); 3) Magen- und Zwölffingerdarmgeschwüre. Der Verlauf des Magengeschwürs. 1. Einfach. Die Exazerbation des Geschwürs ist nicht mehr als 1 Mal in 1-3 Jahren, die Heilung des peptischen Defekts endet in der 5-6. Woche nach Beginn der Therapie, die Schwere der Schmerzen und dyspeptischen Syndrome ist mäßig. 2. Moderat. Wiederholung mindestens 2 mal im Jahr, Ulkusepithelisierung - innerhalb von 7-12 Wochen, die Schwere der Schmerzen und dyspeptischen Syndrome. 3. Schwer. Die Remissionsperioden überschreiten 3-4 Monate nicht. Neben starken Schmerzen treten Komplikationen auf. Krankheitsphasen: 1) Verschlimmerung des Wiederauftretens von Geschwüren oder Funktionsstörungen des gastroduodenalen Systems; 2) vollständige Remission (in klinischer, radiologischer, endoskopischer und funktioneller Hinsicht); 3) unvollständig (unter Beibehaltung funktioneller oder struktureller Störungen in der gastroduodenalen Zone). Der Zustand der Schleimhaut des Magens und Zwölffingerdarms: 1) chronische Gastritis; 2) chronische Zwölffingerdarmentzündung. Funktionszustand des gastroduodenalen Systems Sekretion: normal, erhöht, reduziert. Beweglichkeit: normal, beschleunigt, langsam; Evakuierung: normal, beschleunigt, verzögert, Duodenostase. Komplikationen: Blutung, Perforation, Penetration, Perigastritis, Periduodenitis, Narbenverformung des Magens und Zwölffingerdarms. Klinisches Bild. Das klinische Bild eines Magengeschwürs ist polymorph. Die Symptome hängen vom Geschlecht und Alter des Patienten, der Jahreszeit, dem Ort und der Größe des Geschwürs, den persönlichen und sozialen Merkmalen des Patienten sowie seinen beruflichen Qualitäten ab. Die Klinik wird durch eine Kombination von Symptomen bestimmt: chronischer Krankheitsverlauf ab dem Zeitpunkt ihres Ausbruchs, Vorhandensein von Anzeichen einer Verschlimmerung und Remission der Krankheit, Heilung des Defekts in der Magen- und Zwölffingerdarmschleimhaut mit Bildung von a Narbe. Magengeschwür wird durch zwei klinische und morphologische Varianten dargestellt: Magengeschwür und Zwölffingerdarmgeschwür. Traditionell werden Schmerz- und dyspeptische Syndrome unterschieden. Das führende klinische Zeichen sind Schmerzen im Oberbauch. Aufgrund der Natur des Schmerzsyndroms ist es fast unmöglich, zwischen chronischer bakterieller Gastritis und Magengeschwüren zu unterscheiden. Schmerzen in der Magengegend, auf nüchternen Magen, hauptsächlich im Frühjahr und Herbst, sind sowohl bei Magengeschwüren als auch bei chronischer bakterieller Gastritis gleich häufig. Eine Linderung des Schmerzsyndroms mit Nahrungsmitteln und medizinischen Antazida wird sowohl bei chronischer bakterieller Gastritis als auch bei Magengeschwüren erreicht. Charakteristisch für das Zwölffingerdarmgeschwür ist nur das Vorhandensein von Schmerzen in der Magengegend in der Nacht. Erbrechen mit Magengeschwür ist selten. Übelkeit tritt viel häufiger bei Magengeschwüren und Zwölffingerdarmgeschwüren auf. Verstopfung begleitet chronisches Zwölffingerdarmgeschwür. Die Symptome der Magengeschwüre werden durch die Anzahl der ulzerativen Defekte und deren Lokalisation bestimmt. Multiple Magengeschwüre sind bei Männern dreimal häufiger. Das klinische Bild hängt in diesem Fall von der Lokalisation von Magendefekten ab. Bei Geschwüren im Magenkörper werden dumpfe Schmerzen im Epigastrium ohne Bestrahlung, die 3-20 Minuten nach dem Essen auftreten, und Übelkeit festgestellt. Bei Geschwüren der subkardialen Region sind dumpfe Schmerzen unter dem Xiphoid-Prozess charakteristisch, die in die linke Brusthälfte ausstrahlen. Kombinierte Magengeschwüre und Zwölffingerdarmgeschwüre sind eine Kombination aus einem aktiven Magengeschwür und einem ausgeheilten Zwölffingerdarmgeschwür. Sie zeichnen sich durch einen langfristigen Erhalt des Schmerzsyndroms, anhaltenden Krankheitsverlauf, häufige Rückfälle der Krankheit, langsame Vernarbung des Ulkus und häufige Komplikationen aus. Extrabulböse Geschwüre schließen Geschwüre ein, die im Bereich des bulboduodenalen Sphinkters und distal davon lokalisiert sind. Ihr Krankheitsbild ist charakteristisch und hat viele Gemeinsamkeiten mit Zwölffingerdarmgeschwüren. Sie treten hauptsächlich bei Patienten im Alter von 40-60 Jahren auf. Postbulbäre Ulzera sind schwerwiegend und neigen zu häufigen Exazerbationen, begleitet von massiven Blutungen. Schmerzen, die im rechten Oberbauch lokalisiert sind und in den Rücken oder unter das rechte Schulterblatt ausstrahlen, treten in 100% der Fälle auf. Die Intensität, Schwere der Schmerzen, die erst nach Einnahme von narkotischen Analgetika abklingen, bringt Patienten zu schwerer Neurasthenie. Die Saisonabhängigkeit von Exazerbationen bei extrabulben Geschwüren wird bei fast 90 % der Patienten festgestellt. Bei vielen Patienten werden gastrointestinale Blutungen zu einem Leitsymptom. Geschwüre des Pyloruskanals sind durch einen Symptomkomplex gekennzeichnet, der als Pylorussyndrom bezeichnet wird: epigastrische Schmerzen, Übelkeit, Erbrechen und erheblicher Gewichtsverlust. Die Exazerbation der Krankheit ist sehr lang. Vor dem Hintergrund einer intensiven Therapie gegen Geschwüre vernarbt das Geschwür innerhalb von 3 Monaten. Reichliche Blutversorgung des Pyloruskanals verursacht massive Magenblutungen. Diagnostik. Im unkomplizierten Verlauf eines Magengeschwürs sind keine Veränderungen im allgemeinen Bluttest möglich, ein leichter Abfall der BSG und eine leichte Erythrozytose sind möglich. Wenn bei Blutuntersuchungen Komplikationen auftreten, treten Anämie und Leukozytose auf – wenn das Peritoneum am pathologischen Prozess beteiligt ist. Es gibt keine Änderungen in der allgemeinen Analyse des Urins. Bei der biochemischen Analyse von Blut bei kompliziertem Magengeschwürverlauf sind Veränderungen der Parameter Sialinsäuretest, C-reaktives Protein, DPA-Reaktion möglich. Die traditionelle Untersuchungsmethode in der Pathologie des Magens ist die Bestimmung des Säuregehalts des Mageninhalts. Verschiedene Indikatoren sind möglich: erhöht und normal, in einigen Fällen sogar reduziert. Ein Zwölffingerdarmgeschwür tritt bei hohem Säuregehalt des Magensaftes auf. Bei der Röntgenuntersuchung ist ein Magengeschwür eine "Nische" - ein Depot von Bariumsuspension. Neben einem solchen direkten röntgenologischen Symptom sind indirekte Zeichen eines peptischen Defekts wichtig für die Diagnose: Hypersekretion des Mageninhalts auf nüchternen Magen, Entleerungsstörungen, Zwölffingerdarmreflux, Kardiadysfunktion, lokale Krämpfe, Konvergenz von Schleimhautfalten, narbige Deformität des Magens und Zwölffingerdarms. Die Gastroduodenoskopie mit Biopsie ist die zuverlässigste Methode zur Diagnose von Magengeschwüren. Es ermöglicht Ihnen, die Art der Veränderungen der Schleimhaut am Rand des Geschwürs in der periulzerösen Zone zu beurteilen und garantiert die Genauigkeit der Diagnose auf morphologischer Ebene. In endoskopischen und morphologischen Studien wurde festgestellt, dass sich die meisten Magengeschwüre im Bereich der kleineren Krümmung und des Antrums befinden, viel seltener - auf der größeren Krümmung und im Bereich des Pyloruskanals. 90 % der Zwölffingerdarmgeschwüre befinden sich in der bulbären Region. Ein Magengeschwür hat typischerweise eine runde oder ovale Form. Sein Boden besteht aus nekrotischen Massen, unter denen sich Granulationsgewebe befindet. Das Vorhandensein dunkler Flecken auf der Unterseite weist auf eine Blutung hin. Die Ulkusheilungsphase ist durch eine Abnahme der Hyperämie der Schleimhaut und einen Entzündungsschacht in der periulzerösen Zone gekennzeichnet. Der Defekt wird weniger tief und wird allmählich von fibrinöser Plaque befreit. Die Narbe sieht aus wie ein hyperämischer Bereich der Schleimhaut mit linearen oder sternförmigen Einziehungen der Wand. In Zukunft werden bei der endoskopischen Untersuchung an der Stelle des ehemaligen Geschwürs verschiedene Verletzungen der Schleimhautentlastung festgestellt: Deformationen, Narben, Verengung. Bei der Endoskopie sieht eine reife Narbe aufgrund des Ersatzes eines Defekts durch Granulationsgewebe weißlich aus, es gibt keine Anzeichen einer aktiven Entzündung. Eine morphologische Untersuchung einer Biopsieprobe, die aus dem Boden und den Rändern des Geschwürs entnommen wurde, zeigt Zelldetritus in Form einer Schleimansammlung mit einer Beimischung von zerfallenden Leukozyten, Erythrozyten und abgestoßenen Epithelzellen mit darunter befindlichen Kollagenfasern. Differenzialdiagnose. Mit der weit verbreiteten Anwendung der Endoskopie kommt der Differenzialdiagnose von Magen- und Zwölffingerdarmgeschwüren (symptomatische Geschwüre, spezifische Geschwüre bei Tuberkulose, Syphilis, Morbus Crohn, primärer Geschwürkrebs, sekundäre bösartige Geschwüre) eine besondere Bedeutung zu. Bei symptomatischen Geschwüren muss es eine Ursache geben, die sie verursacht hat (extreme Exposition, klinische und morphologische Anzeichen von endokrinen Erkrankungen, Herz-Kreislauf- und Atemwegserkrankungen, rheumatische Erkrankungen). Mehr als Magengeschwüre sind sie durch eine Vielzahl von Läsionen, eine überwiegende Lokalisation im Magen und eine erhebliche Größe gekennzeichnet. Bei Magengeschwüren überwiegt das Schmerzsyndrom und bei chronischer Gastritis - dyspeptische Phänomene. Bei chronischer Gastritis ist der Schmerz gering oder fehlt, es gibt keine Saisonabhängigkeit der Krankheit und begrenzte Schmerzen bei der Palpation; die Verschlimmerung der Krankheit hängt oft von der Art der Nahrung ab. Der Zustand der sekretorischen Funktion des Magens mit Gastritis kann unterschiedlich sein. Von entscheidender Bedeutung sind Gastroskopie und Gastrobiopsie, bei denen für Gastritis charakteristische Schleimhautveränderungen und ein Ulkus bei Magengeschwüren nachgewiesen werden. Auch die Hiatushernie (HH) wird oft von Schmerzen im Oberbauch begleitet. Im Gegensatz zu Magengeschwüren ist diese Krankheit jedoch hauptsächlich durch das höhere Alter der Patienten und die Beziehung des Schmerzes zur Körperposition gekennzeichnet (der Schmerz nimmt in Rückenlage zu, schwächt sich in aufrechter Position ab). Die Diagnose von HH wird durch die Ergebnisse der Röntgenuntersuchung bestätigt. Die chronische Cholezystitis ist durch Schmerzen im rechten Hypochondrium und Epigastrium gekennzeichnet, die häufig auf das rechte Schulterblatt, die Schulter und den rechten Unterkieferwinkel ausstrahlen. Bei einer kalkulösen Cholezystitis haben sie einen dumpfen, monotonen, drückenden Charakter und bei einer kalkulösen Cholezystitis nehmen sie den Charakter einer Kolik an. Übelkeit, Verstopfung, Blähungen werden festgestellt. Anhaltende subfebrile Zustände sind möglich. Bei längerer Verstopfung der Gallenwege kann sich Gelbsucht anschließen. Die Diagnose einer Schädigung des Gallensystems wird durch die Daten des Ultraschalls des Abdomens, der Röntgenuntersuchung (Cholezystographie), der endoskopischen retrograden Cholepankreatographie (ERCP) sowie der Ergebnisse der Zwölffingerdarmsondierung bestätigt, die nur für einen steinlosen Prozess indiziert ist. Bei akuter Pankreatitis und Verschlimmerung chronischer Schmerzen ist der Schmerz in der linken Hälfte der Magengegend lokalisiert, hat einen Gürtelrose-Charakter und wird durch die Aufnahme jeglicher Nahrung hervorgerufen. In der Anamnese - Pathologie des Gallensystems, Alkoholmissbrauch, Langzeitanwendung von Pankreasmedikamenten. Zeigen Sie objektiv Gewichtsverlust, Polyfäkale, Steatorrhoe, Creatorrhoe auf. Die Diagnose wird durch die Ergebnisse eines biochemischen Bluttests für Pankreasenzyme, Kot - für die Verdaulichkeit sowie instrumentelle Daten bestätigt. Behandlung. Eine rationale Therapie von Magengeschwüren sollte eine Kur, geeignete Ernährung, medikamentöse Behandlung, Psychotherapie sowie physikalische und Spa-Behandlungsmethoden umfassen. Während der Verschlimmerung der Magengeschwürerkrankung ist eine strikte Einhaltung einer fraktionierten Diät erforderlich (4 bis 6 Mal am Tag, wobei zu bestimmten Zeiten eine kleine Menge jeder Nahrungsportion eingenommen wird). Lebensmittel müssen gute Puffereigenschaften haben und eine ausreichende Proteinmenge (120-140 g) enthalten. Psychotherapie ist unerlässlich, um psychoneurotische Reaktionen zu stoppen oder zu reduzieren, die aus dem anhaltenden Schmerzsyndrom und seiner Erwartung resultieren. Arzneimittel zur Behandlung von Magengeschwüren werden in 5 Gruppen eingeteilt: 1) Medikamente, die den Säure-Peptic-Faktor beeinflussen (Antazida und H2Histaminblocker, andere antisekretorische Mittel); 2) Medikamente, die die Barriere der Magenschleimhaut verbessern; 3) Medikamente, die die Synthese von endogenen Prostaglandinen erhöhen; 4) antibakterielle und antiseptische Mittel; 5) Medikamente, die motorische Evakuierungsstörungen des Magens und Zwölffingerdarms normalisieren. Antazida: 1) löslich (resorbierbar) - Natriumbicarbonat, Calciumcarbonat (Kreide) und Magnesiumoxid (gebrannte Magnesia); 2) unlöslich (nicht resorbierbar): Magnesiumtrisilikat und Aluminiumhydroxid. Lösliche Antazida haben eine schnelle, energetische, aber kurzfristige alkalisierende Wirkung, verursachen jedoch häufig Nebenwirkungen, weshalb sie nicht zur Behandlung von Magengeschwüren eingesetzt werden. Unlösliche Antazida auf Basis von Aluminiumhydroxid und Magnesiumhydroxid (Almagel, Phosphalugel, Gelusillac, Topaal, Maalox usw.) sorgen für eine langfristige Neutralisierung von Salzsäure, umhüllen die Schleimhaut und schützen sie vor den schädlichen Auswirkungen von Säure und Nahrungsmitteln. Neben der Neutralisierung von Salzsäure tragen sie dazu bei, die proteolytische Aktivität des Magensaftes zu reduzieren, Lysolecithin und Gallensäuren zu binden und haben eine universelle zytoprotektive Wirkung. Antazida sollten 1-2 Stunden nach den Mahlzeiten und nachts eingenommen werden. Maalox wird in Suspension (15 ml 4-mal täglich) oder Tabletten (1-2 Tabletten 4-mal täglich), Phosphalugel - in Form eines Gels (16 g 3-4-mal täglich) verschrieben. Eine der Hauptnebenwirkungen von nicht resorbierbaren Antazida sind Stuhlstörungen. Aluminiumhydroxid-Präparate verursachen Obstipation und Magnesiumhydroxid-Präparate (Maalox) wirken dosisabhängig abführend. Eine neue Ära in der Behandlung von Magengeschwüren begann mit dem Aufkommen von H2- Histaminblocker. Unter physiologischen Bedingungen vermittelt Histamin extragastrische Nerven- und humorale Reize, die eine Säureproduktion verursachen. Die Stimulierung der Salzsäureproduktion durch Histamin beruht auf einer Erhöhung der Aktivität von cAMP, das auf das Enzym Adenylcyclase einwirkt, das in der säureproduzierenden Region des Magens enthalten ist und die Sekretion von Wasserstoffionen verstärkt. Die erhaltenen Daten waren die Grundlage für die Synthese von Arzneimitteln, die die Beteiligung von Histamin am sekretorischen Prozess auf zellulärer Ebene unterbrechen, wie Cimetidin, Ranitidin, Famotidin, Nizatidin usw. Darüber hinaus wurde H2Histaminrezeptoren beugen Mikrozirkulationsstörungen in der Magenschleimhaut vor und beugen so der Entstehung von Geschwüren vor. Darüber hinaus reduzieren sie die Produktion von Pepsin, erhöhen die Sekretion von Bicarbonaten, normalisieren die gastroduodenale Motilität, erhöhen die Anzahl der DNA-synthetisierenden Epithelzellen, stimulieren Reparaturprozesse und beschleunigen die Heilung von chronischen Magen- und Zwölffingerdarmgeschwüren. Medikamente der 1. Generation (Cimetidin, Cinamet, Belomet, Tagamet) können jedoch Veränderungen im Nervensystem, toxische Hepatitis, Rhythmus- und Erregungsstörungen im Herz-Kreislauf-System und Veränderungen der blutbildenden Organe verursachen. H-Blocker2nachfolgende Generationen von Histaminrezeptoren - Ranitidin (Zantac, Ranisan, Gistak), Famotidin (Kvamatel, Lecedil, Gastrosidin), Nizatidin (Roxatidin) unterscheiden sich von Cimetidin in guter Verträglichkeit. Ranitidin wird in einer Dosis von 150 mg zweimal täglich, Famotidin - 2 mg zweimal täglich für 20-2 Wochen verschrieben. Um ein Entzugssyndrom nach Heilung des Geschwürs zu verhindern, wird empfohlen, Ranitidin (4 mg) oder Famotidin (6 mg) nachts für 150-20 Monate einzunehmen. In den letzten Jahren ist ein neues antisekretorisches Medikament Omeprazol (Omenrol, Omez, Losek) erschienen, das zu den Benzimidazolderivaten gehört. Es blockiert das Enzym H+-K+-ATPase der Protonenpumpe der Belegzelle. Die kurze Halbwertszeit (ca. 1 Stunde) und die lange Wirkungsdauer (18-24 Stunden) machen es möglich, dieses Medikament einmal einzunehmen. Omeprazol wird 20-1 Wochen lang 2 mg nachts 3 Mal pro Tag verschrieben. Unter den modernen Antiulkus-Medikamenten rangiert Omeprazol hinsichtlich der Stärke der antisekretorischen Wirkung an erster Stelle, Nebenwirkungen des Medikaments sind nicht sehr ausgeprägt. Weit verbreitete Anwendung bei der Behandlung von Magengeschwüren hat Gastrocepin (Nirenzepin, Gastrozepin) gefunden, das zu den Anticholinergika gehört. Das Medikament blockiert selektiv muskarinische Acetylcholinrezeptoren in den Zellen der Magenschleimhaut, die Salzsäure und Pepsin produzieren. Gastrocepin hat eine hemmende Wirkung auf die basale und stimulierte Magensekretion, hemmt die Produktion von Pepsin, verlangsamt die Entleerung aus dem Magen, bewirkt eine Hemmung der Gastrinproduktion, reduziert den Spiegel des Pankreaspolypeptids, hat eine zytoprotektive Wirkung, indem es die Produktion von Magenschleim-Glykoproteinen erhöht , sowie durch Verbesserung der Durchblutung der Schleimhaut der gastroduodenalen Region . Weisen Sie es 50 mg 2 mal täglich 30 Minuten vor den Mahlzeiten zu. Die Behandlungsdauer beträgt durchschnittlich 4 Wochen. Zu den Arzneimitteln, die die Schleimbarriere des Magens stärken, gehören Zubereitungen aus kolloidalem Wismut (Denol), das einen Schutzfilm auf der Schleimhaut bildet, die peptische Aktivität des Magens verringert, mit Pepsin eine unlösliche Verbindung bildet, die Schleimbildung fördert und zytoprotektiv wirkt Wirkung, die den Gehalt an Prostaglandinen in der Magenwand erhöht. Denol hat die Fähigkeit, die Aktivität von HP in der Magenschleimhaut zu hemmen. Dem Medikament werden 2 Tabletten (240 mg) 2-mal täglich eine halbe Stunde vor den Mahlzeiten oder 2 Stunden nach den Mahlzeiten verschrieben. Um die Anreicherung von Wismutsalzen im Körper zu vermeiden, wird eine Therapie mit diesen Arzneimitteln nicht länger als 8 Wochen empfohlen. Zur antibakteriellen Therapie von Magen- und Zwölffingerdarmgeschwüren werden Tetracyclin, Amoxicillin und Clarithromycin eingesetzt. Sie werden in Kombination mit anderen Arzneimitteln gegen Geschwüre eingesetzt. Es wurden mehrere Schemata der Kombinationstherapie (Zwei-, Drei-, Vierkomponenten) vorgeschlagen. Zweikomponententherapie: Amoxicillin 1000 mg 2 mal täglich für 2 Wochen; Omeprazol 40 mg zweimal täglich. Das Drei-Komponenten-Schema umfasst die Zubereitung von kolloidalem Wismut 2 mg 120-mal täglich; Tetracyclin 4 mg 250-mal täglich; Metronidazol 4 mg 250-mal täglich. Der Therapiezyklus beträgt 4 Tage. Das Vier-Komponenten-Schema beinhaltet Omeprazol 20 mg 2-mal täglich vom 1. bis zum 10. Tag; de-nol 120 mg 4-mal täglich vom 4. bis zum 10. Tag; Tetracyclin 500 mg 4-mal täglich vom 4. bis zum 10. Tag; Metronidazol 500 mg 3-mal täglich vom 4. bis zum 10. Tag. Das Vier-Komponenten-Schema zur Behandlung von Magen- und Zwölffingerdarmgeschwüren gilt als das wirksamste. 6 Wochen nach dem Eingriff wird die Heilung des Magen-Darm-Defekts bei 93-96% der Patienten beobachtet. Nach Vernarbung eines Magen- und Zwölffingerdarmgeschwürs werden traditionell zwei Arten der Behandlung angewendet. 1) Eine kontinuierliche Erhaltungstherapie wird mit antisekretorischen Medikamenten in halber Tagesdosis über einen Zeitraum von bis zu einem Jahr durchgeführt. 2) Therapie „nach Bedarf“ beinhaltet die Anwendung eines der antisekretorischen Mittel in der halben Tagesdosis für zwei Wochen, wenn Symptome von Magengeschwüren auftreten. Prognose und Prävention. Unkomplizierte Formen der Erkrankung haben eine günstige Prognose für Leben und Beruf. Bei Komplikationen einer Magengeschwürerkrankung wird die Prognose durch die Rechtzeitigkeit der chirurgischen Versorgung bestimmt. Die Prävention des Wiederauftretens von Magengeschwüren umfasst eine dynamische Überwachung mit obligatorischen Nachuntersuchungen durch einen Arzt 2 Mal im Jahr. Die Untersuchungen sollten eine klinische und endoskopische sowie gegebenenfalls eine morphologische Untersuchung umfassen. Als vorbeugende Maßnahme wird empfohlen, Schlaf und Ruhe zu normalisieren, schlechte Gewohnheiten aufzugeben, die Einnahme von ulzerogenen Medikamenten zu begrenzen, fünf Mahlzeiten am Tag zu rationalisieren und alle 3 Monate eine Woche lang eine Zwei- oder Dreikomponententherapie anzuwenden. VORTRAG Nr. 12. Erkrankungen des Verdauungstraktes. Erkrankungen des Darms. Erkrankungen des Dünndarms. Chronische Enteritis Chronische Enteritis ist eine Erkrankung des Dünndarms, gekennzeichnet durch eine Verletzung seiner Funktionen (Verdauung und Resorption) vor dem Hintergrund dystrophischer und dysregenerativer Veränderungen, die in der Entwicklung von Entzündungen, Atrophie und Sklerose der Schleimhaut des Dünndarms gipfeln. Ätiologie und Pathogenese. Dabei handelt es sich um eine polyätiologische Erkrankung, die Folge einer akuten Dünndarmentzündung oder eines primär chronischen Prozesses sein kann. Yersinia, Helicobacteria, Proteus, Pseudomonas aeruginosa, Rotaviren, zahlreiche Vertreter von Protozoen und Helminthen (Giardia, Ascaris, Bandwürmer, Opisthorchia, Cryptosporidium) haben in den letzten Jahren große Bedeutung als ätiologischer Faktor der chronischen Enteritis erhalten. Von großer Bedeutung für das Auftreten einer chronischen Enteritis sind Ernährungsfaktoren - übermäßiges Essen, Essen von Trockenfutter, unausgewogene, überwiegend kohlenhydrathaltige Lebensmittel, Missbrauch von Gewürzen. Enteritis wird durch ionisierende Strahlung, Exposition gegenüber toxischen Substanzen und Medikamenten verursacht. Zu den gemeinsamen pathogenetischen Mechanismen chronischer Erkrankungen des Dünndarms gehören Veränderungen der Darmflora vor dem Hintergrund einer Abnahme der lokalen und allgemeinen Immunität. Änderungen des Immunstatus - eine Abnahme des Gehalts an sekretorischem IgA, eine Erhöhung des IgE-Spiegels, eine Abnahme der Blastentransformation von Lymphozyten und eine Hemmung der Leukozytenmigration - führen zur Besiedlung des Dünndarms durch Vertreter der opportunistischen Mikroflora und a Abnahme der normalen anaeroben Flora. Die bakterielle Besiedelung des Dünndarms verstärkt die Darmsekretion aufgrund der Aktivierung von Epithelzellen-cAMP, das die Darmpermeabilität erhöht und die Produktion von Elektrolyten und Wasser durch die Zellen erhöht. Die Sekretion von Wasser und Elektrolyten führt zu einer Verletzung des Wasser-Salz-Stoffwechsels. Unter dem Einfluss der mikrobiellen Flora wird der enterohepatische Kreislauf der Galle gestört. Fettsäuren binden Calciumionen und bilden schwerlösliche Seifen, die mit dem Kot ausgeschieden werden. Eine Verletzung des Calciumstoffwechsels wird durch Veränderungen im Vitamin-D-Stoffwechsel gefördert, wodurch die Calciumaufnahme verringert wird. Unter dem Einfluss von Stoffwechselstörungen fettlöslicher Vitamine nimmt der Gehalt an Spurenelementen im Blut ab. Längere Dysbiose fördert die Sensibilisierung gegen mikrobielle und Lebensmittelantigene, verursacht eine Immunentzündung der Schleimhaut, die zur Bildung von Gewebeantigenen führt. Die erhöhte Permeabilität der Schleimbarriere wird begleitet von der Resorption von ungespaltenen Proteinmakromolekülen, die zu Allergenen werden, und die immunologische Reaktivität wird beeinträchtigt. Bei Allergien werden biologisch aktive Substanzen freigesetzt, die die Durchlässigkeit der Darmwand erhöhen, die funktionellen Eigenschaften von Enterozyten verändern. Verletzungen der Mikrostruktur der zytoplasmatischen Membran von Enterozyten führen zuerst zur Hemmung der Laktaseaktivität und dann zur Maltase- und Sucraseaktivität. Bei dystrophischen, dysregenerativen Veränderungen in Epitheliozyten werden die Synthese von Enzymen und ihre Sorption an den Membranen von Epitheliozyten - Disaccharidasen, Peptidasen, Enterokinase, alkalische Phosphatase - reduziert, was zu Störungen sowohl der Membran- als auch der Hohlraumverdauung führt. All dies wird zur Grundlage des Malabsorptionssyndroms. In den frühen Stadien der Krankheit entwickeln sich Fettstoffwechselstörungen aufgrund einer Abnahme der Fettaufnahme, ihres Verlusts mit Kot und Veränderungen in der intestinalen Phase des enterohepatischen Gallenkreislaufs. Eine Verletzung des Gallenstoffwechsels führt wiederum zu einer Verletzung des Fettstoffwechsels, der die Struktur und Funktion der Zellmembranen beeinflusst. Im Zusammenhang mit einer unzureichenden Fettaufnahme kommt es zu einer Verletzung der Steroidsynthese, was zu einer Verletzung der Funktionen der endokrinen Drüsen führt. Morphologisch äußert sich die chronische Enteritis durch entzündliche und dysregenerative Veränderungen der Schleimhaut des Dünndarms. Wenn der Prozess fortschreitet, werden seine Atrophie und Sklerose beobachtet. Einstufung (Zlatkina A. R., Frolkis A. V., 1985). 1) Ätiologie: Darminfektionen, helminthische Invasionen, alimentäre, physikalische und chemische Faktoren, Erkrankungen des Magens, der Bauchspeicheldrüse, der Gallenwege. 2) Krankheitsphasen: Exazerbation; Remission. 3) Schweregrad: leicht; mäßig; schwer. 4) Strom: monoton; wiederkehrend; ständig wiederkehrend; latent. 5) Charakter der morphologischen Veränderungen: Einheit ohne Atrophie; Jeunitis mit mäßiger partieller Zottenatrophie; Jeunitis mit partieller Zottenatrophie; eunit mit totaler Zottenatrophie. 6) Die Art der Funktionsstörungen: Störungen der Membranverdauung (Disaccharidasemangel), Malabsorption von Wasser, Elektrolyten, Spurenelementen, Vitaminen, Proteinen, Fetten, Kohlenhydraten. 7) Komplikationen: Solaritis, unspezifische Mesadenitis. Klinisches Bild. Das klinische Bild einer chronischen Enteritis besteht aus lokalen und allgemeinen enterischen Syndromen. Die erste wird durch eine Verletzung der Prozesse der parietalen (Membran) und Hohlraumverdauung (Maldigestion) verursacht. Die Patienten klagen über Blähungen, Schmerzen im paraumbilikalen Bereich, kappenförmige Blähungen, lautes Rumpeln, Durchfall und seltener Verstopfung. Die Palpation zeigt Schmerzen im Mesogastrium sowie links und oberhalb des Nabels (positives Porges-Zeichen) und Spritzgeräusche im Bereich des Blinddarms (Obraztsov-Zeichen). Der Kot nimmt ein lehmiges Aussehen an und es sind polyfäkale Bestandteile charakteristisch. Das allgemeine enterale Syndrom ist mit einer gestörten Aufnahme von Nahrungsbestandteilen (Malabsorption) verbunden, was zu Störungen aller Arten des Stoffwechsels und Veränderungen der Homöostase führt. Gekennzeichnet durch vielfältige Stoffwechselstörungen, vor allem Eiweiß, die sich durch einen fortschreitenden Verlust des Körpergewichts äußern. Veränderungen im Kohlenhydratstoffwechsel sind weniger stark ausgeprägt, was sich durch Blähungen, Bauchgrummeln und vermehrtem Durchfall bei der Einnahme von Milchprodukten äußert. Der Mangel an Körpergewicht bei Patienten ist zu einem großen Teil nicht nur auf Protein, sondern auch auf ein Ungleichgewicht der Lipide zurückzuführen. Veränderungen im Fettstoffwechsel stehen in engem Zusammenhang mit Stoffwechselstörungen fettlöslicher Vitamine und Mineralstoffe (Kalzium, Magnesium, Phosphor). Die charakteristischen Anzeichen eines Kalziummangels sind ein positives Symptom der Muskelrolle, Krämpfe, wiederkehrende "unmotivierte" Knochenbrüche, Osteoporose, Osteomalazie. Es gibt auch Schwellungen des Gesichts, Zyanose der Lippen, Glossitis, Reizbarkeit, Schlafstörungen. Störungen des Wasser- und Elektrolythaushalts äußern sich in allgemeiner Schwäche, körperlicher Inaktivität, Muskelhypotonie, Übelkeit, Erbrechen und Veränderungen des Zentralnervensystems. Die Symptome einer Polyhypovitaminose werden typisch für eine chronische Enteritis mittlerer und schwerer Schwere. Hypovitaminose C manifestiert sich klinisch durch Zahnfleischbluten, wiederholte Nasen- und Gebärmutterblutungen, Blutergüsse auf der Haut. Hypovitaminose B wird von Blässe der Haut, Glossitis, Winkelstomatitis (Cheilez) begleitet. Mangelerscheinungen an fettlöslichen Vitaminen (A, O, E, K): schlechtes Dämmerungssehen, trockene Haut und Schleimhäute, vermehrtes Zahnfleischbluten. Schwere Formen der chronischen Enteritis treten mit Symptomen einer endokrinen Dysfunktion (pluriglanduläre Insuffizienz) auf. Hypokortizismus äußert sich in arterieller Hypotonie, Herzrhythmusstörungen, Anorexie und Hautpigmentierung. Eine Abnahme der Aktivität der Gonaden wird begleitet von Funktionsstörungen der Eierstöcke, Menstruationsstörungen, bei Männern - Impotenz, Gynäkomastie, Haarausfall. Eine Schilddrüsenfunktionsstörung ist gekennzeichnet durch allgemeine Schwäche, trockene Haut, Bradykardie, verminderte Leistungsfähigkeit und intellektuell-mnestische Störungen. Diagnose und Differentialdiagnose. Ein allgemeiner Bluttest zeigt mikro- und makrozytäre Anämie, einen Anstieg der ESR und in schweren Fällen Lympho- und Eosinopenie. Wenn die Krankheit parasitären Ursprungs ist, können Lymphozytose und Eosinophilie im Blut beobachtet werden. Eine skatologische Untersuchung zeigt eine intestinale Art von Steatorrhoe aufgrund von Fettsäuren und Seifen, Creatorrhoe, Amylorrhoe. Der Gehalt an Enterokinase und alkalischer Phosphatase im Kot steigt an. Die tägliche Kotmasse nimmt deutlich zu. Die bakteriologische Analyse des Kots zeigt eine Dysbakteriose unterschiedlichen Ausmaßes. Es gibt eine Abnahme von Lacto- und Bifidobakterien, Enterokokken, Stämme von Escherichia coli mit veränderten enzymatischen Eigenschaften treten auf. Bei der allgemeinen Urinanalyse bei schwerer chronischer Enteritis werden Mikroalbuminurie und Migrohämaturie festgestellt. Bei einem biochemischen Bluttest werden Hypoproteinämie, Hypoalbuminämie, Hypoglobulinämie, Hypokalzämie, eine Abnahme des Magnesium-, Phosphor- und anderer Spurenelemente, Störungen des Elektrolytstoffwechsels in Form einer Abnahme des Natrium- und Kaliumspiegels festgestellt. Störungen des Fettstoffwechsels gehen mit Veränderungen des Lipidspektrums einher: Der Cholesterinspiegel, die Phospholipide sinken und auch das Spektrum der Gallensäuren, Phospholipide und Triglyceride verändert sich. Die Ergebnisse einer Röntgenuntersuchung ermöglichen es uns, die motorische Funktion des Dünndarms und die Linderung der Schleimhaut, dystonische und dyskinetische Veränderungen in Form einer Verlangsamung oder Beschleunigung des Durchgangs einer Suspension von Bariumsulfat durch den kleinen zu klären Darm, und die Entlastung der Schleimhaut verändert sich in Form von ungleichmäßiger Verdickung, Verformung und Glättung der Falten. Die Gastroduodenoskopie zeigt atrophische Gastritis und Duodenitis. Das morphologische Bild einer milden Form der chronischen Enteritis ist gekennzeichnet durch Verdickung der Zotten, deren Verformung, Abnahme der Tiefe der Kerben, Abnahme des Tonus der glatten Muskulatur, subepitheliales Ödem, degenerative Veränderungen der Epitheloberfläche , Ausdünnung des Bürstensaums der Zellen, Abnahme der Anzahl der Becherzellen im Bereich der Zotten, Zunahme der Anzahl der Krypten, Infiltration der Schleimhaut der eigenen Schicht mit lymphoplasmatischen Elementen, Abnahme der Paneth-Zellen im Bereich von der Unterseite der Krypten. Typisch für die mittelschwere Form sind eine partielle Atrophie der Zotten, eine Abnahme der Anzahl der Krypten, eine Verdünnung der Schleimhaut, eine Abnahme des Bürstensaums und eine lymphoplasmatische Infiltration der Submukosa- und Muskelschichten. Die schwere Form der Erkrankung ist durch eine fortschreitende Zottenatrophie gekennzeichnet, die anhand histologischer, histochemischer und morphometrischer Kriterien diagnostiziert wird. Der Prozess der Proliferation von Enterozyten überwiegt ihre Differenzierung, es erscheint eine Fülle unreifer, defekter Zellen. Die Differentialdiagnose bei chronischer Enteritis wird mit Zöliakie, Morbus Crohn, Morbus Whipple, intestinaler Amyloidose, Divertikulose, Lymphom, Tumoren des Dünndarms durchgeführt. Allen diesen Zuständen gemeinsam sind klinische Syndrome von Verdauungsstörungen, Resorption und Dysbakteriose. Die endgültige Diagnose wird durch eine morphologische Untersuchung der Schleimhaut des Dünndarms bestätigt. So ist für die Zöliakie-Enteropathie ein anamnestischer Hinweis auf den Zusammenhang von Exazerbationen der Erkrankung mit der Einnahme von Gliadin-haltigen Präparaten typisch. Die Klinik der Zöliakie-Enteropathie ähnelt der chronischen Enteritis. Am häufigsten sind die oberen Därme betroffen und es gibt keine Veränderungen im Ileum. Der optimale Ort für die Entnahme von Biopsieproben ist der Bereich der Schleimhaut in der Nähe des Treitz-Bandes. Die morphologische Untersuchung zeigt eine Abnahme der Anzahl der Becherzellen und eine Zunahme der Anzahl interepithelialer Lymphozyten, eine subtotale Zottenatrophie und eine entzündliche Zellinfiltration der eigenen Schicht. Bei der Zöliakie-Enteropathie sind morphologische Veränderungen vor dem Hintergrund einer glutenfreien Ernährung reversibel, im Gegensatz zur banalen chronischen Enteritis, bei der morphologische Veränderungen irreversibel sind. Bei Morbus Crohn wird aufgrund der autoimmunen Genese der Krankheit und ihrer charakteristischen systemischen Manifestationen (wie autoimmune Thyreoiditis, Polyarthritis, Iritis, Hepatitis, häufige Kombination von Enteritis und distaler Kolitis) ein klinischer Polymorphismus festgestellt. Endoskopische und morphologische Tests haben eine hohe Auflösung beim Nachweis von Morbus Crohn und zeigen die mosaikartige Natur der Darmläsion, typische Veränderungen vom Typ "Kopfsteinpflaster", die sich mit Bereichen intakter Schleimhaut abwechseln. Röntgen, endoskopische Untersuchung kann Darmstrikturen erkennen, manchmal bilden sich Darmfisteln. Die morphologische Diagnostik stellt eine entzündliche Zellinfiltration aller Schichten der Darmwand mit maximaler Schädigung der Submukosaschicht und minimalen Schleimhautveränderungen fest. In der submukösen Schicht finden sich lymphozytäre sarkoidartige Granulome, die für diese Krankheit pathognomonisch sind. Die Whipple-Krankheit ist zusätzlich zu Zeichen einer Enteritis durch extraintestinale Manifestationen in Form von Fieber, Arthritis, Lymphadenopathie, arterieller Hypotonie und Hautpigmentierung gekennzeichnet. Die informativsten morphologischen Kriterien der Krankheit. Aus dem Dünndarm entnommene Biopsien zeigen eine intrazelluläre und extrazelluläre Fettansammlung in der Dünndarmschleimhaut und den mesenterialen Lymphknoten; Infiltration der eigenen Schicht durch große Mikrophagen, die CHIC-positive fettfreie Granula enthalten, und das Vorhandensein von Bazillen in der Schleimhaut. Behandlung. Die Behandlung der chronischen Enteritis sollte umfassend sein und Mittel umfassen, die ätiologische Faktoren, pathogenetische Mechanismen sowie lokale und allgemeine Symptome der Krankheit beeinflussen. Grundlage ist die diätetische Ernährung, die hilft, den erhöhten osmotischen Druck in der Darmhöhle zu reduzieren, die Sekretion zu reduzieren und den Durchgang des Darminhalts zu normalisieren. Schließen Sie Produkte aus, die grobe Pflanzenfasern enthalten (rohes Gemüse, Obst, Roggenbrot, Nüsse, Gebäck, Konserven, Gewürze, scharfe Gerichte, Vollmilch, Bier, Kwas, kohlensäurehaltige und alkoholische Getränke). Die Verwendung von Kochsalz ist begrenzt. Teilweise Mahlzeiten sind erforderlich, bis zu 5-6 Mal am Tag. Während der Remissionszeit werden einige Gemüse- und Obstsorten in die Ernährung aufgenommen, bis zu 100-200 g pro Tag. Weisen Sie Salat, reife geschälte Tomaten, weiche Birnen, süße Äpfel, Orangen, Mandarinen, Himbeeren, Erdbeeren, Walderdbeeren zu. Lebensmittel sollten gekocht oder gedämpft werden. Die medikamentöse Therapie sollte etiotrop, pathogenetisch und symptomatisch sein. Etiotrope Behandlung: Bei Dysbiose Grad II-IV werden antibakterielle Medikamente verschrieben: Metronidazol (0,5 g 3-mal täglich), Clindamycin (0,5 g 4-mal täglich), Cephalexin (0,5 g 2-mal täglich), Biseptol (). 0,48 g 2-mal täglich), Sulgin (1 g 3-4-mal täglich), Furazolidon (0,1 g 4-mal täglich). Nach der Einnahme antibakterieller Medikamente werden Eubiotika verschrieben - Bifidumbacterin oder Bificol 5 Dosen dreimal täglich 3 Minuten vor den Mahlzeiten, Coli-Bacterin oder Lactobacterin 30 Dosen dreimal täglich vor den Mahlzeiten, Hilakforte 3 Tropfen dreimal täglich vor den Mahlzeiten. Die Behandlung mit Bakterienpräparaten wird über einen langen Zeitraum durchgeführt: 3 Zyklen à 40 Monate pro Jahr. Bei Staphylokokken-Dysbakteriose wird ein Antistaphylokokken-Bakteriophage verschrieben (3 ml 3-mal täglich für 3-20 Tage), bei Proteus-Dysbakteriose - Coliproteus-Bakteriophage oral, 3 ml 15-mal täglich, die Behandlungsdauer beträgt 20-20 Wochen. Als symptomatisches Mittel gegen Durchfall wird Imodium (Loperamid) 1 Kapsel 2-3 mal täglich vor den Mahlzeiten für 3-5 Tage verschrieben. Zur Verbesserung des Verdauungsprozesses werden Enzyme empfohlen: Pankreatin, Panzinorm forte, Festal, Digestal, Pankurmen, Mezim forte, Trienzym, deren Dosierung individuell ausgewählt wird (von 1 Tablette 3-mal täglich bis 3-4 Tabletten 4-mal täglich ) und die direkt vor oder während der Mahlzeiten für 2-3 Monate verschrieben werden. Falls erforderlich, wird die Enzymersatztherapie über einen längeren Zeitraum fortgesetzt. Um den Allgemeinzustand von Patienten mit Enteritis zu normalisieren und Stoffwechselstörungen zu beseitigen, ist eine Substitutionstherapie angezeigt. Um den Vitaminmangel auszugleichen, werden die Vitamine B und B für 4-5 Wochen verschrieben.6 50 mg jeweils, PP - 10-30 mg, C - jeweils 500 mg. Bei Steatorrhoe ist die parenterale Gabe von Vitamin B indiziert.2 (100-200 mcg) in Kombination mit fettlöslichen Vitaminen. Riboflavin 0,02 g, Folsäure 0,003 g einmal täglich, Vitamin E 3300 IE 2 mal täglich werden im Inneren verschrieben. Bei chronischer Enteritis, die bei schwerem Eiweißmangel auftritt, neben einer Diät, parenterale Gabe von Plasma, 150–200 ml Eiweißhydrolysaten und Mischungen von Aminosäuren (Aminopeptid, Alvesin, Polyamin, Intrafusin, 250–500 ml intravenös für 20 Tage). Kombination mit anabolen Hormonen (Retabolil 2,0 ml 1 Mal alle 7-10 Tage für 3-4 Wochen) und Fettmischungen wie Intralipid. Die Ernennung von Steroiden ist nur bei signifikantem Proteinmangel, Hypoproteinämie und Vorliegen einer Nebenniereninsuffizienz angezeigt. Um Wasser- und Elektrolytstörungen zu korrigieren, sind intravenöse Verabreichung von Panangin 20-30 ml, Calciumgluconat 10% 10-20 ml in 200-400 ml isotonischer Lösung oder Glucoselösung, polyionische Lösungen "Disol", "Trisol", "Quartasol". angegeben. Elektrolytlösungen werden intravenös für 10-20 Tage unter Kontrolle des Säure-Basen-Zustands und des Blutelektrolytspiegels verabreicht. Prognose und Prävention. Die Prognose für Leben und Erwerbsfähigkeit ist in den meisten Fällen günstig. Prognostisch ungünstige Anzeichen sind ein kontinuierlich rezidivierender Krankheitsverlauf, plötzlicher erheblicher Gewichtsverlust, Anämie, endokrines Störungssyndrom (verminderte Libido, Dysmenorrhoe, Unfruchtbarkeit). Die Prävention einer chronischen Enteritis besteht in der rechtzeitigen Behandlung akuter Darminfektionen und Begleiterkrankungen der gastroduodenalen Zone, in der Einhaltung der Diät, in der prophylaktischen Verabreichung von Bakterienpräparaten während der Röntgen- und Strahlentherapie. VORTRAG Nr. 13. Erkrankungen des Verdauungstraktes. Erkrankungen des Darms. Morbus Crohn Morbus Crohn ist eine chronische Darmerkrankung mit systemischen Manifestationen; deren morphologische Grundlage eine granulomatöse Autoimmunentzündung des Magen-Darm-Traktes ist. Ätiologie und Pathogenese. Этиология и патогенез заболевания изучены недостаточно. Наиболее популярными считаются инфекционная и иммунная концепции возникновения болезни. В последние годы появились сообщения об этиологической роли микроорганизмов рода иерсиний. Однако трудно установить, являются ли эти микробные агенты возбудителями или комменсалами. В то же время в патогенезе заболевания важная роль принадлежит изменениям в кишечной микрофлоре. Typischerweise eine Abnahme von Bakterien vom Bifidum-Typ bei gleichzeitiger Zunahme von Enterobakterien mit Anzeichen von Pathogenität. Autoimmunmechanismen spielen bei der Entstehung der Krankheit eine Rolle. Bei Morbus Crohn treten Autoantikörper (IgC, IgM) gegen Darmgewebe auf. Das morphologische Substrat der Krankheit ist ein autoimmuner Entzündungsprozess, der zunächst in der Submukosaschicht auftritt, sich auf die gesamte Dicke der Darmwand ausbreitet und durch das Vorhandensein granulomatöser Infiltrate gekennzeichnet ist, gefolgt von Ulzerationen der Schleimhaut, der Entwicklung von Abszessen und Fisteln, die unter Narbenbildung und Verengung des Darmlumens abheilen. Mit zunehmender Krankheitsdauer nimmt das Ausmaß der Läsion zu und es treten Symptome extraintestinaler Störungen auf. Einstufung. Классификация (Ф. И. Комаров, А. И. Казанов, 1992 г.). 1) Verlauf: akut; chronisch. 2) Merkmale des Prozesses: Läsion im Dünndarm; Läsion innerhalb der Ileozökalregion; Läsion innerhalb des Dickdarms. 3) Komplikationen: Verengung des Darms; toxische Dilatation des Dickdarms; Fisteln; Amyloidose; Nephrolithiasis, Cholelithiasis; BEI12- Mangelanämie. Klinisches Bild. Клиническая картина болезни Крона характеризуется значительным разнообразием, которое определяется локализацией и протяженностью патологического процесса в кишечнике, формой заболевания и присоединением осложнений. Der Beginn der Krankheit kann akut sein, wenn die Krankheit von Anfang an fortschreitet, und chronisch, wenn die Krankheit allmählich beginnt. Im ersten Fall wird die Diagnose häufig während einer Laparotomie gestellt, die bei Verdacht auf Blinddarmentzündung oder Darmverschluss, der sich bei jungen Menschen ohne ersichtlichen Grund entwickelt hat, durchgeführt wird. Gleichzeitig werden ein hyperämischer Bereich des Dünndarms, vergrößerte Lymphknoten der Mesenterialwurzel, die für Morbus Crohn charakteristisch sind, gefunden. Die Patienten klagen über Schmerzen im Unterleib ohne spezifische Lokalisation, Auflockerung des Stuhls ohne sichtbare pathologische Verunreinigungen, Gewichtsverlust, niedrige Körpertemperatur. Eine objektive Studie achtet auf die Blässe der Haut, die mit der Schwere der Anämie, Schwellungen in den Beinen aufgrund einer gestörten Resorption und des Proteinstoffwechsels korreliert. Beim Abtasten des Bauches werden Blähungen und Rumpeln festgestellt. Wenn der Prozess im Dickdarm lokalisiert ist, wechseln Verstopfung mit Durchfall, krampfartigen Bauchschmerzen, flüssigen oder halbgeformten Stühlen, die eine Beimischung von Blut enthalten. Wenn der obere Gastrointestinaltrakt betroffen ist, treten Symptome auf, die einer chronischen Ösophagitis, chronischen Gastritis und chronischen Duodenitis ähneln. Es können Schmerzen hinter dem Brustbein während der Nahrungspassage durch die Speiseröhre, nächtliche und "hungrige" Schmerzen im Epigastrium, Schmerzen beim Abtasten in der Pyloroduodenalzone auftreten. Bei der körperlichen Untersuchung des Patienten werden Blässe der Haut, subfebriler Zustand, Körpergewichtsmangel festgestellt, Palpation zeigt krampfhafte Darmschlingen, Schmerzen in der paraumbilikalen Zone, in der rechten Iliakalregion. Bei Morbus Crohn werden extraintestinale Anzeichen der Krankheit festgestellt: aphthöse Stomatitis, Phlegmone und Fisteln der Mundhöhle, Arthritis, ähnlich der rheumatoiden Arthritis in der Klinik, mit charakteristischen Symptomen symmetrischer Läsionen kleiner Gelenke, Steifheit am Morgen. Typische Veränderungen am Auge: Iritis, Iridozyklitis, Makulopathie. Die Haut kann Erythema nodosa und Pyoderma gangraenosum entwickeln. Durchfall ist gekennzeichnet durch eine Zunahme der Stuhlhäufigkeit bis zu 10 Mal am Tag oder mehr, polyfäkale Materie. Das Stuhlvolumen wird durch die anatomische Lokalisation des Prozesses bestimmt: Bei einer Schädigung des proximalen Dünndarms ist das Kotvolumen viel größer als bei einer Schädigung der distalen Teile. Gewichtsverlust wird bei allen Patienten festgestellt. Diagnose und Differentialdiagnose. В клиническом анализе крови в период обострения выявляют лейкоцитоз, анемию, повышение СОЭ. Изменения в общем анализе мочи появляются при тяжелой форме, характеризующейся присоединением амилоидоза почек (протеинурия). Ein biochemischer Bluttest zeigt Hypoproteinämie, Hypoalbuminämie, einen Anstieg der α-Globuline, eine Abnahme des Eisengehalts, Vitamin B12, Folsäure, Zink, Magnesium und Kalium. Die Daten der skatologischen Untersuchung erlauben eine indirekte Einschätzung der Läsionshöhe. Im Koprogramm mit Dünndarmlokalisierung des Prozesses werden polyfäkale Materie, Steatorrhoe, Creatorrhoe gefunden; mit dem Dickdarm - eine Beimischung von Schleim, Leukozyten, Erythrozyten. Mit der Röntgendiagnostik können Sie die Lokalisation und Prävalenz des pathologischen Prozesses im Darm feststellen. Bereiche des betroffenen Darms wechseln sich mit Bereichen des unveränderten Darms ab. Die veränderten Schlingen versteifen sich, das Bild ist mosaikartig mit kleinen Füllungsdefekten und mit dem Eindringen von Kontrastmittel über die Darmwand in Form von Taschen hinaus. Der Darm im betroffenen Bereich erhält den Charakter von fein gesäumten, mit der Bildung von Pseudodivertikeln. Die Kontraktionsfähigkeit der Darmwand wird reduziert oder geht ganz verloren, die Evakuierung von Barium verlangsamt sich. Es wird eine ungleichmäßige Verengung des Darmlumens beobachtet, wodurch es so eng wird, dass es die Form einer Spitze annimmt. Oberhalb der Verengungszone dehnt sich der Darm aus. Von entscheidender Bedeutung für die Diagnosesicherung ist die endoskopische Diagnostik. Am charakteristischsten für Morbus Crohn ist die Veränderung des Antrums des Magens und des Anfangsabschnitts des Zwölffingerdarms. Endoskopisch lässt sich eine kreisrunde Verengung des Antrums erkennen, die einer Tumorstenose ähnelt. Die Anfangsphase von Morbus Crohn ist durch schlechte endoskopische Daten gekennzeichnet: eine stumpfe Schleimhaut, an der Erosionen vom Typ Aphthen sichtbar sind, umgeben von weißlichen Granulationen. Das Gefäßmuster fehlt oder ist geglättet. Im Lumen des Darms und an seinen Wänden wird eitriger Schleim bestimmt. Bei klinischer Remission können die beschriebenen Veränderungen vollständig verschwinden. Mit fortschreitender Krankheit verdickt sich die Schleimhaut ungleichmäßig, hat eine weißliche Farbe und es werden große oberflächliche oder tiefe Risse festgestellt. Das Darmlumen verengt sich, was das Vorschieben des Koloskops erschwert. Die Koloskopie ermöglicht eine gezielte Biopsie der Schleimhaut in allen Teilen des Dickdarms und im terminalen Ileum. Bei Morbus Crohn beginnt der pathologische Prozess in der Submukosaschicht, daher sollte die Biopsie so durchgeführt werden, dass ein Teil der Submukosaschicht in das Biopsiematerial gelangt. Im Zusammenhang damit wird in 54% der Fälle das morphologische Substrat der Krankheit nicht erkannt. Es ist notwendig, Morbus Crohn von unspezifischer Colitis ulcerosa, gastrointestinaler Tuberkulose, ischämischer Colitis, Morbus Whipple, Divertikulose, pseudomembranöser Colitis, Lymphogranulomatose, primärer Dünndarm-Amyloidose, chronischer Enteritis zu unterscheiden. Allen diesen Krankheiten gemeinsam sind das Syndrom der intestinalen Dyspepsie und einige systemische Läsionen. Die Colitis ulcerosa ist jedoch durch eine Veränderung der distalen Teile des Dickdarms mit obligatorischer Beteiligung des Rektums und des Sigmas gekennzeichnet. Bei unspezifischer Colitis ulcerosa gibt es keine Segmentierung der Läsion; seltener als bei Morbus Crohn werden systemische Manifestationen festgestellt und das Malabsorptionssyndrom ist weniger ausgeprägt. Die genaueste Diagnose von Morbus Crohn wird jedoch durch Endoskopie mit gezielter Biopsie bestätigt. Die gastrointestinale Form der Tuberkulose unterscheidet sich von Morbus Crohn durch häufige Lokalisation im Ileum, endoskopische Befunde, die den Nachweis von Geschwüren mit erhabenen, exfolierten Rändern ermöglichen, die mit gräulichem Inhalt gefüllt sind. Solche Geschwüre heilen unter Bildung einer kurzen Narbe, die bei Morbus Crohn nicht beobachtet wird. Bei älteren Menschen muss zwischen Morbus Crohn und ischämischer Kolitis unterschieden werden. Typisch für letztere sind heftige Schmerzattacken im Unterleib nach dem Essen, irrigoskopisch nachweisbare Colitis-Veränderungen an Milzbeuge, Colon descendens und Sigma. Das wichtigste röntgenologische Zeichen der ischämischen Kolitis ist das „Daumenabdruck“-Symptom. Die endoskopische und morphologische Untersuchung zeigt die für die ischämische Kolitis typischen hämosiderinhaltigen Zellen und Fibrose im Biopsiematerial. Die Diagnose einer Lymphogranulomatose und einer primären intestinalen Amyloidose wird anhand der histologischen Untersuchung gestellt. Im ersten Fall finden sich in der Biopsie aus dem Mesenteriallymphknoten Berezovsky-Sternberg-Zellen, im zweiten Fall Ablagerungen von Amyloid in der Rektumschleimhaut. Behandlung. Назначают механически и химически щадящую диету с повышенным содержанием белков, витаминов, микроэлементов, с исключением молока при его непереносимости, ограничением грубой растительной клетчатки. Показано применение жидких энтеральных гидролизатов. Salazopräparate und Kortikosteroide bilden die Grundlage der pathogenetischen medikamentösen Therapie. Die tägliche Dosis von Medikamenten beträgt 3-6 g.Mit der Lokalisierung des pathologischen Prozesses im Dickdarm übersteigt die Aktivität von Sulfasalazin die Aktivität von Prednisolon. In Abwesenheit der Wirkung der Anwendung von Sulfasalazin, bei Läsionen überwiegend des Dünndarms und ausgeprägten Anzeichen einer Immunentzündung sowie bei Vorliegen systemischer Manifestationen der Krankheit ist die Anwendung von Kortikosteroiden angezeigt. Die Wirkung ihrer Anwendung wird in den ersten 8 Wochen nach Beginn der Behandlung festgestellt. Prednisolon wird nach folgendem Schema verschrieben: Auf dem Höhepunkt einer Exazerbation 60 mg pro Tag, dann wird die Dosis schrittweise reduziert und in der 6. bis 10. Woche auf eine Erhaltungsdosis von 5 bis 10 mg pro Tag eingestellt. Bei Erreichen einer klinischen Remission wird das Medikament schrittweise abgesetzt. Wenn keine Remission erreicht wird, wird die Behandlung mit Prednisolon ambulant bis zur 52. Woche fortgesetzt. Bei schwerem Krankheitsverlauf, bei Komplikationen in Form von trägen rektovaginalen, hautenterischen, enteroenterischen Fisteln, ist die Ernennung von 6-Mercaptopurin oral zu 0,05 g 2-3 mal täglich für 10-tägige Kurse mit angezeigt ein Intervall von 3 Tagen bis zum Erreichen einer klinischen Remission. Anschließend wechseln sie zur Einnahme von Erhaltungsdosen des Medikaments im Laufe des Jahres. Die Dosis von 6-Mercaptopurin beträgt in diesem Fall 75 mg pro Tag. Die Wirkung der Behandlung mit Immunsuppressiva kann frühestens nach 3-4 Monaten festgestellt werden. Breiten Einsatz bei der Behandlung von Morbus Crohn fand Metronidazol, dessen Hauptindikationen perianale Fisteln und Fissuren, die fehlende Wirkung von Salazopräparaten und Glukokortikoiden sowie Krankheitsschübe nach Proktektomie sind. Das Medikament wird in einer Dosis von 500-1000 mg pro Tag verschrieben. Die Dauer des kontinuierlichen Kurses sollte 4 Wochen nicht überschreiten. Die symptomatische Therapie von Morbus Crohn wird auf die Ernennung von kurzen Kursen (jeweils 2-3 Tage) von Antidiarrhoika (Imodium, Loperamid) reduziert. Die Dosen werden individuell nach der klinischen Wirkung ausgewählt. Verschreiben Sie keine Antidiarrhoika für längere Zeit (mehr als 5 Tage). Aufgrund des Malabsorptionssyndroms bei Morbus Crohn werden Enzympräparate, die keine Gallensäuren enthalten (Pankreatin, Mesimforte, Solizim, Somilase), in einer Dosis von 2 bis 6 Tabletten zu jeder Mahlzeit verwendet. Je nach Indikation werden Anämie und Hypoalbuminämie durch die Verordnung von Eisenpräparaten (parenteral) und die Verabreichung von Alvezin, Proteinhydrolysatoren, Aminopeptiden, Aminoblut korrigiert. Weisen Sie Multivitamine in Pillen, Essentiale in Kapseln zu. Die Behandlung der Dysbakteriose erfolgt nach allgemeinen Regeln. Prognose und Prävention. При болезни Крона прогноз для жизни при своевременной диагностике и эффективном динамическом наблюдении благоприятный, для трудовой деятельности - неопределенный. У пациентов с тяжелым течением заболевания, при наличии осложнений и системных проявлений, устанавливается I или II группа инвалидности. Болезнь Крона относится к предраковым заболеваниям. Пациента нужно подробно ознакомить с особенностями течения заболевания и предупредить о возможных осложнениях, описав в доступной форме их клинические проявления. VORTRAG Nr. 14. Erkrankungen des Verdauungstraktes. Erkrankungen des Dickdarms. Unspezifische Colitis ulcerosa Die unspezifische Colitis ulcerosa ist eine entzündliche Erkrankung der Dickdarmschleimhaut mit ulzerativ-destruktiven Veränderungen, die einen chronisch rezidivierenden Verlauf hat, oft begleitet von der Entwicklung lebensbedrohlicher Komplikationen. Ätiologie und Pathogenese. Die unspezifische Colitis ulcerosa ist eine idiopathische Erkrankung. Die Gründe für sein Auftreten sind nicht bekannt. Von den vielen Theorien, die den Ursprung der Krankheit erklären (infektiös, enzymatisch, allergisch, immun, neurogen usw.), ist die Infektionstheorie von größtem Interesse, aber Versuche, den Erreger aus dem Inhalt des Dickdarms zu isolieren, waren erfolglos. Der pathologische Prozess bei chronischer Colitis ulcerosa beginnt im Rektum und breitet sich in proximaler Richtung aus, wobei die darüber liegenden Teile des Dickdarms erfasst werden. Die Entzündung kann auf das Rektum (Proktitis), Rektum und Sigma (Proktosigmoiditis) beschränkt sein, sich auf den gesamten linken Abschnitt ausbreiten (linksseitige Kolitis) oder den gesamten Dickdarm betreffen (totale Kolitis). Funktionell ist die Länge des Dickdarms bei unspezifischer Kolitis um etwa 1/3 verkürzt. Bei der Untersuchung von pathologischem Material zeigte sich eine diffuse Entzündung der Schleimhaut des Dickdarms (ausgeprägte Schwellung und Fülle, Verdickung der Falten). In der Schleimhaut bilden sich Geschwüre unterschiedlicher Größe mit unregelmäßiger Form, deren Boden sich in der Schleimhaut befindet, seltener in der submukösen Schicht, in den Muskel- und serösen Membranen. Morphologisch wird in der Anfangsphase ein Infiltrat in der Lamina propria der Schleimhaut festgestellt, bestehend aus Lymphozyten mit einer Beimischung von polymorphkernigen Leukozyten, Erweiterung der Blutgefäße und Schwellung des Endothels dieser Gefäße. Die Verletzung der Mikrozirkulation wird von der Entwicklung einer Hypoxie begleitet, die die Verletzungen der Struktur und Funktion des Schleimhautepithels verschlimmert. Das Stadium ausgeprägter klinischer Manifestationen wird begleitet von einer Leukozyteninfiltration der Oberflächenschicht des Epithels, der Entwicklung einer Kryptitis, bei der Ansammlungen von Neutrophilen im Lumen der Krypten auftreten. Die distalen Teile der Krypten sind ausgelöscht, es treten Kryptabszesse auf, bei deren Bildung eine gestörte Reifung der Epitheliozyten eine wichtige Rolle spielt. Bei Nekrose des Epithels, das die Krypten auskleidet, öffnen sich Kryptenabszesse, es bilden sich Geschwüre. Während der Remissionszeit wird die Schleimhaut wiederhergestellt, aber ihre Atrophie, Verformung der Krypten und ungleichmäßige Verdickung der Lamina propria bleiben bestehen. Einstufung (Yu. V. Baltaitis et al., 1986). Klinisches Merkmal. 1. Klinische Form: 1) akut; 2) chronisch. 2. Strom: 1) schnell fortschreitend; 2) kontinuierlich rezidivierend; 3) wiederkehrend; 4) latent. 3. Aktivitätsgrad: 1) Exazerbation; 2) Fading-Exazerbation; 3) Vergebung. 4. Schweregrad: 1) Licht; 2) moderat; 3) schwer. Anatomisches Merkmal. 1. Makroskopische Eigenschaft: 1) Proktitis: 2) Proktosigmoiditis; 3) Zwischensumme Läsion; 4) totale Niederlage. 2. Mikroskopische Eigenschaft: 1) das Vorherrschen destruktiver Entzündungsprozesse; 2) Reduzierung entzündlicher Prozesse mit Wiedergutmachungselementen; 3) Folgen des Entzündungsprozesses Komplikationen. 1. Lokal: 1) Darmblutung; 2) Perforation des Dickdarms; 3) Verengung des Dickdarms; 4) Pseudopolyposis; 5) sekundäre Darminfektion; 6) Verschwinden der Schleimhaut; 7) toxische Dilatation des Dickdarms; 8) Malignität. 2. Allgemeines: 1) funktioneller Hypokortizismus; 2) Sepsis; 3) systemische Manifestationen - Arthritis, Sakroiliitis, Hautläsionen, Iritis, Amyloidose, Phlebitis, sklerosierende Cholangitis, Leberdystrophie. Klinisches Bild. Das klinische Bild der Colitis ulcerosa ist polymorph und hängt von der Schwere des Verlaufs und der Schwere des Prozesses ab. Der Verlauf des Entzündungsprozesses, der oft als chronisch angesehen wird, nimmt in manchen Fällen einen akuten Verlauf an. Auch das Ausmaß der Schädigung des Dickdarms kann unterschiedlich sein. Die unspezifische Colitis ulcerosa ist durch drei Leitsymptome gekennzeichnet: scharlachroter Blutausfluss beim Stuhlgang, Darmfunktionsstörungen und Bauchschmerzen. Die Isolierung von Blut (von Streifen auf der Stuhloberfläche bis zu 300 ml oder mehr) während des Stuhlgangs ist das erste Anzeichen der Krankheit. In der akuten Form der Krankheit wird Blut durch einen Strahl abgesondert, was zu einer Blutdrucksenkung bis zur Entwicklung von Kollaps und hämorrhagischem Schock führt. Darmfunktionsstörungen äußern sich in Form von Beschwerden über wiederholt instabilen Stuhlgang, der Folge einer ausgedehnten Schädigung der Schleimhaut und einer verminderten Aufnahme von Wasser und Salzen ist. Am häufigsten tritt Durchfall bei schwerer Colitis ulcerosa auf. Durchfall ist jedoch kein zuverlässiger Indikator für die Schwere des Prozesses. Die Schwere des Durchfalls in Kombination mit dem Vorhandensein von rotem Blut im Stuhl ist von Bedeutung. Bei einer beträchtlichen Anzahl von Patienten mit Colitis ulcerosa finden sich periodisch Blut und Schleim auf der Oberfläche des gebildeten Stuhls, was oft fälschlicherweise als Manifestation von Hämorrhoiden angesehen wird. Die Patienten klagen über krampfartige oder anhaltende Schmerzen im Unterbauch, die häufiger im Hypogastrium oder in der linken Iliakalregion lokalisiert sind, vor dem Stuhlgang zunehmen und danach verschwinden. Tenesmus wird oft bemerkt. Wenn die submukosalen, muskulären und serösen Schichten des Darms an dem Prozess beteiligt sind, nehmen die Schmerzen zu; Palpation des Abdomens erscheint Verteidigung der Muskeln der vorderen Bauchwand. Der milde Verlauf der unspezifischen Colitis ulcerosa ist durch einen zufriedenstellenden Zustand der Patienten gekennzeichnet. Bauchschmerzen sind mäßig und kurzfristig. Der Stuhl wird bis zu 2-3 mal am Tag dekoriert, beschleunigt. Blut und Schleim finden sich im Stuhl. Der Prozess ist im Rektum und Sigma lokalisiert. Der klinische Verlauf ist rezidivierend. Die Wirkung der Behandlung mit Salazopräparaten ist zufriedenstellend. Rückfälle treten nicht öfter als 2 Mal im Jahr auf. Remissionen können lang sein (mehr als 2-3 Jahre). Der mittelschwere Krankheitsverlauf wird diagnostiziert, wenn der Patient Durchfall hat. Der Stuhl ist häufig (bis zu 6-8 Mal am Tag), in jeder Portion ist eine Beimischung von Blut und Schleim sichtbar. Krämpfe im Unterleib sind intensiver. Es gibt Wechselfieber mit einem Anstieg der Körpertemperatur bis zu 38 ° C, intensive allgemeine Schwäche. Es können auch extraintestinale Manifestationen der Krankheit auftreten (Arthritis, Uveitis, Erythema nodosum). Der Verlauf ist ständig wiederkehrend, die Wirkung von Salazopräparaten ist instabil, bei Exazerbationen werden Hormone verschrieben. Die schwere Form der Erkrankung ist durch einen akuten Beginn gekennzeichnet. Mit der Ausbreitung des pathologischen Prozesses tief in die Darmwand entwickelt sich schnell eine totale Läsion des Dickdarms. Der Zustand des Patienten verschlechtert sich rapide. Die Klinik ist gekennzeichnet durch einen plötzlichen Beginn, hohes Fieber, starken Durchfall bis zu 24 Mal am Tag, starke Darmblutungen und eine rasch zunehmende Dehydratation. Tachykardie tritt auf, der Blutdruck sinkt, extraintestinale Manifestationen einer unspezifischen Colitis ulcerosa nehmen zu. Eine konservative Behandlung ist nicht immer wirksam, und oft ist eine Notoperation erforderlich. Diagnose und Differentialdiagnose. Bei klinischen Bluttests bei milden Formen der Erkrankung werden eine leichte neutrophile Leukozytose, ein Anstieg der BSG und die Zahl der roten Blutkörperchen nicht verändert. Mit zunehmender Schwere des Verlaufs und zunehmender Dauer der Exazerbation kommt es zu einer Anämie gemischten Ursprungs (B12-Mangel und Eisenmangel), erhöhte ESR. Bei der biochemischen Analyse von Blut in mittelschweren und schweren Formen werden Dysproteinämie, Hypoalbuminämie, Hypergammaglobulinämie, Elektrolytstörungen und Säure-Basen-Zustand festgestellt. Bei der allgemeinen Urinanalyse treten Veränderungen nur auf, wenn Komplikationen in Form eines nephrotischen Syndroms vor dem Hintergrund einer Amyloidose auftreten, wenn charakteristische Veränderungen in Urintests festgestellt werden - Proteinurie, "totes" Harnsediment, es kommt auch zu einer Zunahme des Blutes und der Gehalt an Kreatinin, Harnstoff. Die Hauptrolle in der Diagnostik kommt der endoskopischen Untersuchung mit gezielter Biopsie zu, da bei der unspezifischen Colitis ulcerosa primär die Dickdarmschleimhaut betroffen ist. Am pathologischen Prozess ist immer das Rektum beteiligt, d. h. erosive und ulzerative Veränderungen werden bei der Endoskopie unmittelbar hinter dem Analsphinkter bei der Sigmoidoskopie nachgewiesen. Bei Colitis ulcerosa ist die Rektosigmoidbiegung aufgrund starker Spasmen nicht immer zu überwinden. Der Versuch, den Schlauch des Proktoskops zu halten, wird von starken Schmerzen begleitet. In dieser Situation sollte das Proktoskop nicht tiefer als 12-15 cm eingeführt werden. Die Koloskopie während einer schweren Exazerbation einer unspezifischen Colitis ulcerosa ist nicht sicher durchzuführen. Es sollte bei hohem Malignitätsrisiko eingesetzt werden. Hervorzuheben ist der hohe Informationsgehalt der Sigmoidoskopie. Das endoskopische Bild hängt von der Form der Erkrankung ab. Bei einer milden Form sind ödematöse, stumpfe Schleimhaut, dicke weißliche Schleimüberzüge an den Darmwänden und leichte Kontaktblutungen sichtbar. Das Gefäßmuster der Submukosaschicht wird nicht visuell bestimmt. Im mittelschweren Krankheitsverlauf zeigen sich Hyperämie und Ödeme der Schleimhaut, schwere Kontaktblutungen, Blutungen, Erosionen und unregelmäßig geformte Geschwüre, dicke Schleimschichten an den Darmwänden. Bei einem schweren Krankheitsverlauf wird die Schleimhaut des Dickdarms in erheblichem Umfang zerstört. Es finden sich eine körnige, blutende Innenfläche, ausgedehnte Ulzerationen mit fibrinösen Ablagerungen, Pseudopolypen unterschiedlicher Größe und Form, Eiter und Blut im Darmlumen. Kontraindikationen für die Koloskopie und die Sigmoidoskopie sind schwere Formen der Colitis ulcerosa im akuten Krankheitsstadium. Mit einer Röntgenuntersuchung können Sie das Ausmaß der Läsion bestimmen. Abklärung der Diagnose bei unzureichend aussagekräftigen Endoskopiedaten; Differentialdiagnose mit Morbus Crohn, Divertikulose, ischämische Kolitis; Malignitätszeichen rechtzeitig erkennen. Einfache Röntgenaufnahmen können Verkürzung des Darms, fehlende Haustration, toxische Dilatation, freies Gas unter der Kuppel des Zwerchfells während der Perforation zeigen. Die Irrigoskopie sollte mit großer Sorgfalt durchgeführt werden. Es kann eine Verschlechterung des Zustands des Patienten hervorrufen. In einigen Fällen muss die Vorbereitung des Patienten auf einen Bariumeinlauf mit Einläufen und Abführmitteln durch eine spezielle Diät ersetzt werden, die 2 Tage vor der Studie verschrieben wird. In einigen Fällen kann die Verwendung eines Kontrasteinlaufs die Perforation beschleunigen oder eine toxische Dilatation des Dickdarms verursachen. Daher wird die Irrigoskopie nach dem Abklingen akuter Phänomene durchgeführt. Diese Methode zeigt Unebenheiten und "Körnigkeit" der Schleimhaut, Verdickung der Darmwand, Ulzerationen, Pseudopolyposis, fehlende Haustration. Die Differentialdiagnose der unspezifischen Colitis ulcerosa erfolgt vor allem bei akuten Darminfektionen. Bei Vorliegen einer Epidemie von Darminfektionen lässt sich die Diagnose leicht stellen. Aber auch bei sporadischer Morbidität bei akuten Darminfektionen verläuft das Colitis-Syndrom ohne Schübe, während die Colitis ulcerosa einen rezidivierenden Verlauf hat. Die genauesten Methoden zur Identifizierung einer akuten Darminfektion umfassen bakteriologische und serologische. Colitis ulcerosa wird häufig von Morbus Crohn abgegrenzt. In typischen Fällen unterscheidet sich Morbus Crohn von einer unspezifischen Kolitis durch das Fehlen einer Schädigung des Rektums, eine häufige Beteiligung des Ileums am pathologischen Prozess und segmentale Läsionen der Darmwand. Die definitive Diagnose kann durch den Nachweis lymphoider Granulome gestellt werden, die spezifisch für Morbus Crohn in Biopsieproben sind. Bei granulomatöser Kolitis werden Paraproktitis und pararektale Fisteln häufiger nachgewiesen als bei unspezifischer Colitis ulcerosa. In manchen Fällen muss zwischen Colitis ulcerosa und Darmtuberkulose unterschieden werden. Für die Darmtuberkulose ist eine bestimmte Lokalisation des Prozesses charakteristisch (Ileum, Ileozökalregion), segmentale Darmschädigung. Aber manchmal sind bei Darmtuberkulose auch das Rektum und der gesamte Dickdarm betroffen. Das koloskopische Bild der Darmtuberkulose ist durch das Vorhandensein von Geschwüren mit erhabenen Rändern gekennzeichnet, die mit gräulichem Inhalt gefüllt sind. Tuberkulöse Geschwüre neigen dazu, sich in Querrichtung auszubreiten und kurze Narben zu hinterlassen, in denen erneut Geschwüre auftreten. Bei der unspezifischen Colitis ulcerosa bilden sich an der Stelle früherer Geschwüre keine Narben. Bei älteren und senilen Patienten sollte die Colitis ulcerosa von der ischämischen Colitis unterschieden werden. Letzteres ist gekennzeichnet durch starke, anfallsartige Bauchschmerzen 20-30 Minuten nach dem Essen, während bei Colitis ulcerosa Schmerzen vor dem Stuhlgang auftreten. Das wichtigste radiologische Zeichen ist das „Daumenabdruck“-Symptom. Das endoskopische Bild der ischämischen Kolitis ist gekennzeichnet durch scharf begrenzte Läsionsgrenzen, submuköse Blutungen, zyanotische pseudopolypöse Formationen, die in das Darmlumen hineinragen. Die histologische Untersuchung zeigt hämosiderinhaltige Zellen und Fibrose. Das Fehlen einer Kontaktblutung zum Zeitpunkt der Biopsie weist ebenfalls eher auf eine ischämische Kolitis hin. Behandlung. Das Fehlen eines einzigen ätiologischen Faktors und die Komplexität der Pathogenese der unspezifischen Colitis ulcerosa erschweren die Behandlung dieser Krankheit. Es werden Medikamente mit entzündungshemmender und antibakterieller Wirkung eingesetzt: Salazopyridazin, Sulfasalazin, Salazodimethoxin, Salofalk. Oral eingenommenes Sulfasalazin zerfällt unter Beteiligung der Darmflora in 5-Aminosalicylsäure und Sulfapyridin. Nicht absorbiertes Sulfapyridin hemmt das Wachstum der anaeroben Mikroflora im Darm, einschließlich Clostridien und Bakterioden. Und dank 5-Aminosalicylsäure verursacht das Medikament nicht nur Veränderungen in der Darmflora, sondern moduliert auch Immunreaktionen und blockiert Mediatoren des Entzündungsprozesses. Das Medikament wird für den gesamten Zeitraum der aktiven Entzündung in einer Dosis von 2-6 g pro Tag verschrieben. Wenn das Kolitissyndrom nachlässt, wird die Sulfasalazin-Dosis schrittweise reduziert, bis sie auf den Erhaltungszustand eingestellt ist (durchschnittlich 1–1,5 Tabletten pro Tag). Die Ernennung von 5-Aminosalicylsäure-Derivaten (Salofalk, Mesacol, Salosan, Tidikol) ist die Basismethode und kann als Monotherapie bei leichten und mittelschweren Formen der Colitis ulcerosa eingesetzt werden. Die Behandlung wird vor dem Hintergrund der Diättherapie mit Ausnahme von Milchprodukten bei einem ausgewogenen Gehalt an Proteinen, Fetten, Kohlenhydraten und Vitaminen in der Ernährung durchgeführt. Es ist ratsam, frisches Obst, Gemüse und Konserven auszuschließen. Lebensmittel sollten mechanisch und chemisch schonend sein. 4-5 mal täglich fraktioniert füttern. Vitaminungleichgewicht stört den Prozess der Aufnahme von Mikroelementen und wird durch die Ernennung komplexer Präparate in Tabletten ("Duovit", "Oligovit", "Unicap") ausgeglichen. Bei schwerem Durchfallsyndrom bei Personen mit leichtem und mittelschwerem Krankheitsverlauf ist die Ernennung von Sandostatin indiziert, das die Synthese von Magen-Darm-Hormonen und biogenen Aminen (vasoaktives intestinales Peptid, Gastrin, Serotonin) hemmt, deren Produktion stark erhöht ist Colitis ulcerosa und Morbus Crohn. Außerdem reduziert das Medikament die Sekretion und verbessert die Absorption im Darm, hemmt den viszeralen Blutfluss und verringert die Beweglichkeit. Bei der Anwendung von Sandostatin (innerhalb von 7 Tagen bei einer Dosis von 0,1 mg 2-mal subkutan) nimmt der Durchfall ab, der Tenesmus verschwindet praktisch und die Blutausscheidung mit Kot nimmt ab. Bei einer schweren Form der unspezifischen Colitis ulcerosa erfolgt die Behandlung vor dem Hintergrund der parenteralen Ernährung. Der Proteingehalt dieser Präparate sollte etwa 1,5-2,0 g/kg Körpergewicht betragen. Kortikosteroide, die parenteral verabreicht werden, sind eine pathogenetische Behandlung für eine schwere Form der Erkrankung: Am ersten Tag wird Prednison intravenös in Abständen von 12 Stunden (90-120 mg oder mehr) verabreicht, in den nächsten 5 Tagen - intramuskulär, Dosis schrittweise reduzieren. Mit positivem Effekt wechseln sie zu oralen Medikamenten (Prednisolon 40 mg pro Tag). Die langfristige Gabe von Hormonen während einer Phase stabiler Remission ist nicht praktikabel. Bei Patienten mit schwerem Krankheitsverlauf wurde ein positiver Effekt der hyperbaren Oxygenierung (HBO) festgestellt. Die Anwendung eines HBO-Kurses (7-10 Eingriffe) während der Remissionszeit kann die Häufigkeit von Rückfällen verringern. Indikationen für eine chirurgische Notfallbehandlung: Darmperforation, toxische Dilatation, starke Darmblutung, Malignität. Bei der mittelschweren Verlaufsform des unspezifischen Ulcus ulcerosa ist eine strenge Diät mit einer Einschränkung von Ballaststoffen, Milchprodukten und einem hohen Proteingehalt erforderlich. Prednisolon wird oral in einer Anfangsdosis von 20-40 mg pro Tag verabreicht. Die Behandlung kann mit Sulfasalazin und seinen Analoga ergänzt werden, die oral eingenommen oder in Microclysters und Zäpfchen in das Rektum verabreicht werden. Die Anfangsdosis von Sulfasalazin beträgt 1 g pro Tag, dann wird sie auf 4-6 g erhöht. Als zusätzliche Behandlungsmethode können Abkochungen von Kräutern mit entzündungshemmender und hämostatischer Wirkung (Wurzel, Brennnesselblätter, Flechten, Grauerlenzapfen, Süßholzwurzel) verwendet werden. In der Kräutermedizin können Sie häufig die Dosis von Salazopräparaten reduzieren und verlängern Remission. Prognose und Prävention. In schweren Fällen und bei Vorliegen systemischer und lokaler Komplikationen ist die Prognose ernst. Die Patienten sind völlig arbeitsunfähig. Bei leichten und mittelschweren Krankheitsformen ist die Lebensprognose günstig. Patienten müssen auf leichte Arbeit umgestellt werden. Während der Remission wird eine Erhaltungstherapie mit Salazopräparaten, bakteriellen Wirkstoffen, Psychotherapie und Diättherapie empfohlen. Patienten, die längere Zeit (mehr als 5-7 Jahre) an Colitis ulcerosa leiden, sollten der Risikogruppe für das Auftreten von Darmkrebs zugeordnet und apothekenpflichtig gemacht werden. Diesen Patienten wird einmal jährlich eine Koloskopie mit gezielter Biopsie gezeigt. VORTRAG Nr. 15. Erkrankungen der Nieren. Akute Glomerulonephritis Die akute Glomerulonephritis (AGN) ist eine akute diffuse Nierenerkrankung infektiös-allergischer Natur, die in den Glomeruli lokalisiert ist. AGN kann eine unabhängige Krankheit (primär) oder sekundär als Teil einer anderen Krankheit sein, was das klinische Bild und die Diagnose der letzteren erschwert. AGN betrifft in der Regel junge und Männer mittleren Alters. Ätiologie. ОГН возникает чаще всего после перенесенной кокковой инфекции (гриппа, острых ангин, фарингитов, вызванных так называемыми нефритогенными штаммами микроорганизмов). Bei 60-80% der Patienten werden β-hämolytische Streptokokken der Gruppe A nachgewiesen, in 1/3 der Fälle kann die Ätiologie von AGN nicht festgestellt werden. Längere Unterkühlung, insbesondere bei hoher Luftfeuchtigkeit, trägt zur Entwicklung von AGN bei. Auch die Impfung ist ein Faktor für den Ausbruch der Krankheit, und in 75 % der Fälle sind die Nieren nach der zweiten oder dritten Injektion betroffen. Pathogenese. Патогенез заболевания имеет иммунный механизм: при попадании в организм антигенов (стрептококковых, лекарственных, чужеродных белков) в ответ образуются антитела, связывающие эти антигены и вместе с 3-й фракцией комплемента образующие циркулирующие в сосудистом русле иммунные комплексы. Комплексы способны откладываться на наружной стороне базальной мембраны капилляров клубочков, вызывая их поражение посредством выделения продуктов расщепления комплемента, повышающих проницаемость капилляров и вызывающих локальные изменения в последних. К местам отложения иммунных комплексов устремляются нейтрофилы, лизосомальные ферменты которых усугубляют повреждение эндотелия и базальной мембраны, отделяя их друг от друга. Дегрануляция тромбоцитов вызывает освобождение серотонина, приводящего к гемокоагуляции и отложению фибрина на базальной мембране. Die Eliminierung von Immunkomplexen aus dem Körper wird durch eine Makrophagenreaktion in Form der Proliferation von Mesangial- und Endothelzellen erleichtert, mit der Wirksamkeit dieses Prozesses tritt eine Erholung ein. Klinisches Bild. Клиническая картина заболевания складывается из следующих синдромов. Harnsyndrom. 1. Proteinurie aufgrund des Durchgangs von Proteinmolekülen durch die Räume der Kapillarwand des Glomerulus, die während der Ablagerung von Immunkomplexen auf ihnen gebildet werden. Proteinurie ist von Natur aus selektiv, bei der überwiegend Albumine den glomerulären "Filter" passieren. 2. Hämaturie aufgrund der Beteiligung am pathologischen Prozess des Kapillarmesangiums und des interstitiellen Gewebes. Erythrozyten dringen durch kleinste Risse in der Basalmembran ein und verändern ihre Form. 3. Cylindrurie - Urinausscheidung von zylindrischen Zellen der Tubuli. Während dystrophischer Prozesse in den Tubuli der zerfallenen Zellen des Nierenepithels bilden sich körnige Zylinder, die aus einer dichten körnigen Masse bestehen; wachsartige Zylinder haben scharfe Konturen und eine homogene Struktur; hyaline Abgüsse sind proteinhaltige Formationen. Das hypertensive Syndrom wird beobachtet aufgrund von: 1) Natrium- und Wasserretention; 2) Aktivierung des Renin-Angiotensin-Aldosteron- und sympathoadrenalen Systems; 3) Abnahme der Funktion des Depressorsystems der Nieren. Das Ödemsyndrom ist mit folgenden Faktoren verbunden: 1) eine Abnahme der glomerulären Filtration aufgrund ihrer Niederlage; 2) eine Abnahme der Filtrationsladung von Natrium und eine Zunahme seiner Reabsorption; 3) Wassereinlagerungen aufgrund von Natriumeinlagerungen im Körper; 4) ein Anstieg des BCC; 5) sekundärer Hyperaldosteronismus; 6) eine Zunahme der Sekretion von ADH und eine Zunahme der Empfindlichkeit des distalen Nephrons dafür, was zu einer Flüssigkeitsretention führt; 7) eine Erhöhung der Permeabilität der Kapillarwände und die Freisetzung von Plasma in das Gewebe; 8) eine Abnahme des onkotischen Plasmadrucks mit massiver Proteinurie. Beschwerden, die in AGN präsentiert werden, sind nicht spezifisch und treten bei verschiedenen Krankheiten auf. Es ist sehr wichtig, in der Anamnese auf eine kürzlich aufgetretene Halsentzündung, eine Verschlimmerung einer chronischen Mandelentzündung, Unterkühlung usw. hinzuweisen. Einige Patienten bemerken eine Abnahme der Urinausscheidung, kombiniert mit einer leichten Schwellung (pastös) des Gesichts am Morgen. Bei 1/3-3/4 Patienten treten in den ersten Krankheitstagen nicht sehr starke, schmerzende Schmerzen in der Lendengegend auf, die mit einer Größenzunahme der Nieren verbunden sind. Hinzu kommen erhöhte Müdigkeit, Kopfschmerzen, Atemnot bei körperlicher Anstrengung, ein kurzzeitiger Anstieg der Körpertemperatur bis subfebril. Arterielle Hypertonie, die nur bei der Hälfte der Patienten festgestellt wird, ist durch einen Anstieg der Anzahl auf 140-160 / 85-90 mm Hg gekennzeichnet. Kunst. (selten - bis zu 180/100 mm Hg. Art.). Diagnostik. В 100 % случаев при исследовании мочи диагностируются протеинурия различной степени выраженности, цилиндрурия и, что имеет наибольшее значение для диагностики, гематурия различной степени выраженности - от микрогематурии (до 10 эритроцитов в поле зрения) до макрогематурии (хотя и достаточно редкой). Однако при подозрении на ОГН необходимо провести серию повторных исследований мочи или поставить пробу Нечипоренко (определение количества форменных элементов в 1 мкл), так как в однократной порции мочи эритроцитов можно не обнаружить. Bei der Untersuchung des Blutes werden Akute-Phase-Indikatoren nachgewiesen (Erhöhung des Gehalts an Fibrinogen und α2-Globulin, C-reaktives Protein, ESR-Beschleunigung), die Anzahl der Leukozyten ändert sich wenig, mäßige Anämie. Bei einem unkomplizierten AGN-Verlauf ändert sich der Gehalt an stickstoffhaltigen Substanzen (Kreatinin, Indikan, Harnstoff) im Blut nicht. In der Anfangsphase der Krankheit wird eine Veränderung des Reberg-Tests beobachtet - eine Abnahme der glomerulären Filtration und eine Zunahme der tubulären Reabsorption, die sich mit der Genesung normalisiert. Eine Röntgenuntersuchung bei Patienten mit schwerer arterieller Hypertonie kann eine mäßige Zunahme des linken Ventrikels zeigen, die die gleiche Größe annimmt, wenn sich der Patient erholt. Es gibt 3 klinische Varianten von AGN. 1) Monosymptomatische Variante: geringe Beschwerden, Fehlen von Ödemen und arterieller Hypertonie, es besteht nur ein Harnsyndrom; die häufigste Variante des Krankheitsverlaufs (86 % der Fälle). 2) Nephrotische Variante: Ödeme, Oligurie sind ausgeprägt, es ist möglich, den Blutdruck auf relativ niedrige Zahlen zu erhöhen, es wird bei 8% der Patienten festgestellt. 3) Erweiterte Version: Arterielle Hypertonie, Erreichen hoher Werte (180/100 mm Hg), mäßig ausgeprägte Ödeme, Kreislaufversagen, tritt in 6 % der Fälle auf. Differenzialdiagnose. ОГН необходимо отличать от хронического гломерулонефрита, что не представляет сложностей при остром начале ОГН и последующем полном обратном развитии симптомов. Однако при отсутствии острого начала, а также при длительном сохранении отдельных признаков болезни диагностика существенно осложняется. При сложностях дифференциации прибегают к пункционной биопсии почки. Es ist schwierig, AGN von Pyelonephritis zu unterscheiden, da bei beiden Erkrankungen eine Leukozyturie vorliegt. AGN wird jedoch von einer massiveren Proteinurie und in einigen Fällen von Ödemen begleitet. Differentialdiagnostisch hilfreich sind auch die klinischen Symptome einer Pyelonephritis in Form von stärkeren Schmerzen im unteren Rücken, begleitet von Fieber und Dysurie. Von diagnostischem Wert sind auch die Bestimmung der Bakteriurie bei Pyelonephritis, die Identifizierung "aktiver" Leukozyten sowie Röntgen- (Deformation der Becher) und Isotopen-Renographie (Asymmetrie der Nierenfunktion) Untersuchungen. AGN als eigenständige Erkrankung muss von chronischen diffusen Bindegewebserkrankungen abgegrenzt werden, bei denen AGN eine der Manifestationen der Erkrankung ist. Diese Situation tritt normalerweise bei der Schwere von Harn-, hypertensiven und ödematösen Syndromen und unzureichender Klarheit anderer Krankheitssymptome auf, häufiger bei SLE (systemischer Lupus erythematodes). Die korrekte Diagnose bei SLE kann unter Berücksichtigung des artikulären Syndroms, Schädigung der Haut und anderer Organe (Herz), ausgeprägter immunologischer Veränderungen (Nachweis von Anti-Organ-Antikörpern in hohen Titern, Lupus-erythematodes-Zellen, Antikörpern gegen DNA und RNA) gestellt werden ) sowie die Überwachung der Dynamik des Krankheitsbildes. Behandlung. Лечение при ОГН комплексное и включает в себя следующие мероприятия. 1. Modus. Bei Verdacht auf AGN oder unmittelbar nach Feststellung der Diagnose sollte der Patient sofort ins Krankenhaus eingeliefert werden. Strenge Bettruhe ist für ca. 2-4 Wochen bis zum Abklingen der Ödeme und Normalisierung des Blutdruckes einzuhalten. Das Liegenbleiben sorgt für eine gleichmäßige Erwärmung des Körpers, was zu einer Verringerung des Vasospasmus (daher zu einer Senkung des Blutdrucks) und zu einer Erhöhung der glomerulären Filtration und Diurese führt. Nach der Entlassung aus dem Krankenhaus ist eine Heimbehandlung für bis zu 4 Monate ab dem Datum des Ausbruchs der Krankheit indiziert, was die beste Vorbeugung gegen den Übergang von AGN in das chronische Stadium darstellt. 2. Ernährung. Abhängig von der Schwere der klinischen Symptome ist es sehr wichtig, Flüssigkeit und Natriumchlorid einzuschränken. Bei einer erweiterten und nephrotischen Form wird ein vollständiges Fasten für 1-2 Tage mit einer Flüssigkeitsaufnahme in einer Menge empfohlen, die der Diurese entspricht. Am 2-3. Tag wird der Verzehr von kaliumreichen Lebensmitteln (Reisbrei, Kartoffeln) gezeigt. Die Gesamtmenge an Wasser, die pro Tag getrunken wird, sollte gleich der für den Vortag zugeteilten Urinmenge plus 300-500 ml sein. Nach 3-4 Tagen wird der Patient auf eine Diät mit Proteinrestriktion (bis zu 60 g pro Tag) umgestellt, und die Gesamtsalzmenge beträgt nicht mehr als 3-5 g / Tag. Eine solche Diät wird bis zum Verschwinden aller extrarenalen Symptome und einer starken Verbesserung des Harnsediments empfohlen. 3. Die medikamentöse Therapie umfasst in erster Linie eine antibiotische Therapie, die jedoch nur durchgeführt werden sollte, wenn die infektiöse Natur der AGN gesichert ist (Erreger isoliert und seit Krankheitsbeginn nicht mehr als 3 Wochen vergangen). Üblicherweise verschriebenes Penicillin oder seine halbsynthetischen Analoga in üblichen Dosierungen. Das Vorhandensein offensichtlicher Herde einer chronischen Infektion (Tonsillitis, Sinusitis usw.) ist auch eine direkte Indikation für eine Antibiotikatherapie. Diuretika bei der Behandlung von AGN sind nur bei Flüssigkeitsretention, erhöhtem Blutdruck und dem Auftreten von Herzinsuffizienz indiziert. Das wirksamste Furosemid (40-80 mg), das bis zur Beseitigung von Ödemen und Bluthochdruck verwendet wird. Es besteht keine Notwendigkeit für eine langfristige Verschreibung dieser Medikamente, 3-4 Dosen sind ausreichend. Bei fehlendem Ödem, aber anhaltender Hypertonie oder bei unzureichender blutdrucksenkender Wirkung von Saluretika werden Antihypertensiva (Clophelin, Dopegyt) mit einer von der Persistenz der arteriellen Hypertonie abhängigen Anwendungsdauer verschrieben. In der nephrotischen Form von AGN wird eine immunsuppressive Therapie verschrieben (Kortikosteroide - Prednisolon 60-120 mg pro Tag, gefolgt von einer allmählichen Dosisreduktion, Anwendungsdauer für 4-8 Wochen). Im Fall von AGN mit schwerem Ödem und einer signifikanten Verringerung der Diurese wird Heparin mit 20-000 IE pro Tag für 30-000 Wochen verabreicht, wodurch eine Verlängerung der Blutgerinnungszeit um das 4-6-fache erreicht wird. Bei längerer Proteinurie wird Indomethacin oder Voltaren mit 75-150 mg pro Tag verschrieben (ohne Hypertonie und Oligurie). Die Prognose ist günstig, bei verlängerten Formen besteht jedoch die Möglichkeit, dass der Prozess chronisch wird. Die Prävention von AGN läuft auf eine wirksame Behandlung von Herdinfektionen und eine rationale Verhärtung hinaus. Um den Ausbruch der Krankheit nach der Impfung rechtzeitig zu erkennen, ist bei allen Patienten, die auf ARVI übertragen wurden, eine Untersuchung des Urins erforderlich. VORTRAG Nr. 16. Erkrankungen der Nieren. Pyelonephritis Die Pyelonephritis ist eine Infektionskrankheit, bei der das Nierenbecken, seine Kelche und die Nierensubstanz mit einer überwiegenden Läsion des interstitiellen Gewebes beteiligt sind. In dieser Hinsicht ist die Pyelonephritis eine interstitielle (interstitielle) Nephritis. Dies ist ein breiteres Konzept als Pyelonephritis. Es bezeichnet erstens eine Art von Nierenentzündung jeglicher Ätiologie mit überwiegender Beteiligung des Interstitiums und zweitens eine spezielle Krankheit, bei der diese Entzündung ihre einzige und hauptsächliche Ausprägung ist. In der Nähe der interstitiellen Nephritis liegt die sogenannte tubulo-interstitielle Nephritis, bei der eine freundliche Läsion der Tubuli und des Stromas der Nieren vorliegt. Einstufung. Basierend auf klinischen und morphologischen Daten wird zwischen akuter und chronischer Pyelonephritis unterschieden, die meist einen rezidivierenden Verlauf in Form von Anfällen einer akuten Pyelonephritis aufweist. Auch Pyelonephritis kann ein- und zweiseitig sein. Je nach Verlaufsform (bei chronischer Pyelonephritis): rezidivierende Form, latente chronische Pyelonephritis, pyelonephritische Faltenniere. Ätiologie und Pathogenese. Pyelonephritis ist eine Infektionskrankheit. Seine Erreger sind Infektionserreger unspezifischer Natur: E. coli, Enterokokken, Staphylokokken und andere Bakterien, aber in den meisten Fällen handelt es sich um E. coli (40 %) und Mischflora (38 %). Es wird auf die L-Formen von Bakterien, Protoplasten (Bakterienkörper ohne Membranen, die eine Infektion unterstützen können), Candida hingewiesen, die eine chronische Pyelonephritis verursachen können. Infektionsquellen können Tonsillen, Erkrankungen der Geschlechtsorgane und des Dickdarms sein, d. h. Infektionserreger können mit dem Blutstrom in die Niere einschließlich des Beckens eindringen (hämatogene absteigende Pyelonephritis), was bei vielen Infektionskrankheiten (Typhus, Influenza) beobachtet wird , Angina, Sepsis). Häufiger werden Mikroben auf einem aufsteigenden Weg aus den Harnleitern, der Blase und der Harnröhre (urogene aufsteigende Pyelonephritis) in die Nieren gebracht, was durch Dyskinesie der Harnleiter und des Beckens, erhöhten intrapelvinen Druck (vesikorenaler und pyelorenaler Reflux) sowie erleichtert wird Rückresorption des Beckeninhalts in die Venen des Nierenmarks ( pyelovenöser Reflux). Die aufsteigende Pyelonephritis erschwert in der Regel jene Erkrankungen des Urogenitalsystems, bei denen der Harnabfluss schwierig ist (Steine und Strikturen der Harnleiter, Strikturen der Harnröhre, Tumore des Urogenitalsystems), so dass sie sich häufig während der Schwangerschaft entwickelt. Eine lymphogene Infektion der Nieren (lymphogene Pyelonephritis) ist ebenfalls möglich, wenn der Dickdarm und die Geschlechtsorgane die Infektionsquelle darstellen. Für die Entwicklung einer Pyelonephritis sind neben dem Eindringen der Infektion in die Nieren die Reaktivität des Körpers und eine Reihe lokaler Ursachen, die zu einer Verletzung des Urinabflusses und einer Harnstauung führen, von großer Bedeutung. Die gleichen Gründe erklären die Möglichkeit eines rezidivierenden chronischen Krankheitsverlaufs. Infizierte Mikroorganismen mit funktionellen und morphologischen Veränderungen in den Harnwegen, die zu Harnstauung, Beeinträchtigung des venösen und lymphatischen Abflusses aus der Niere führen und zur Fixierung der Infektion in den Nieren beitragen, verursachen fokale und polymorphe Zonen entzündlicher Infiltrate und Eiterung des Interstitiums von einem oder beide Nieren. Das interstitielle Gewebe der Tubuli ist betroffen und dann die Nephrone. Es entwickeln sich produktive Endarteriitis, Hyperplasie der mittleren Gefäßschale, Hyalinoseerscheinungen, Arteriolosklerose bis hin zur sekundär faltigen Niere. In den letzten Jahren wird Autoimmunreaktionen eine gewisse Rolle bei der Entwicklung einer chronischen Pyelonephritis zugeschrieben: Unter dem Einfluss bakterieller Antigene lagern sich Immunglobulin G und Komplement auf der Basalmembran der glomerulären Kapillaren ab und verursachen deren Schädigung. Der Übergang von akuter zu chronischer Pyelonephritis wird erleichtert durch: verspätete Diagnose einer akuten Pyelonephritis, vorzeitige Krankenhauseinweisung, das Vorhandensein chronischer Infektionen, Diabetes, Gicht, Missbrauch von Analgetika - Phenacetin. Chronische Pyelonephritis tritt häufiger bei Frauen auf (50%), was durch Schwangerschaften, insbesondere wiederholte (Östrogene verursachen Atonie der glatten Muskulatur der Harnwege), in der Kindheit bei Mädchen erleichtert wird, was mit der Struktur der Harnwege zusammenhängt , ihre Anomalien. Klinisches Bild. Wie oben erwähnt, ist sowohl ein akuter als auch ein chronischer Verlauf einer Pyelonephritis möglich. Das Krankheitsbild der akuten Phase der Erkrankung ist gekennzeichnet durch einen plötzlichen, starken Anstieg der Körpertemperatur auf 39-40 ° C, das Auftreten von Schwäche, Kopfschmerzen, Schüttelfrost, kombiniert mit starkem Schwitzen, Übelkeit und Erbrechen kann auftreten. Zusammen mit dem Anstieg der Körpertemperatur treten Schmerzen in der Lendengegend auf, die in der Regel auf einer Seite bemerkt werden. Die Art der Schmerzen ist dumpf, ihre Intensität ist unterschiedlich. Im Falle der Entwicklung der Krankheit vor dem Hintergrund der Urolithiasis geht einem Anfall von Pyelonephritis ein Anfall von Nierenkoliken voraus. In Ermangelung einer adäquaten Therapie kann die Krankheit chronisch werden, oder dies führt zur Entwicklung von eitrigen Prozessen in der Niere, die sich klinisch durch eine Verschlechterung des Allgemeinzustandes des Patienten und plötzliche Temperaturschwankungen (von 35-36 ° C morgens bis 40-41 °C abends). Chronische Pyelonephritis ist in der Regel eine Folge einer unterbehandelten akuten Pyelonephritis, bei der es möglich war, eine akute Entzündung zu beseitigen, aber nicht alle Krankheitserreger in der Niere radikal zu zerstören oder den physiologischen Abfluss des Urins aus der Niere wiederherzustellen. Chronische Pyelonephritis sorgt sich um ständige dumpfe Schmerzen in der Lendengegend, die sich bei feuchtkaltem Wetter verschlimmern. Auch chronische Pyelonephritis neigt zu periodischen Exazerbationen, wenn der Patient alle Anzeichen eines akuten Prozesses aufweist. Diagnostik. Das Problem bei der Diagnose der Krankheit beruht auf der Tatsache, dass die Symptome einer Pyelonephritis den Symptomen anderer Krankheiten ähneln, die auf eine Entzündung der Harnwege zurückzuführen sind. Der diagnostische Untersuchungsplan umfasst Bluttests, Urintests sowie Studien, die den Zustand des Harnsystems zeigen: Ultraschall der Nieren, Röntgenuntersuchungen, PCR-Analyse auf einen Infektionserreger. Um die Art des Infektionserregers zu überprüfen, muss eine bakteriologische Kultur einer Urinprobe durchgeführt werden, und die Methode der Computertomographie wird verwendet, um Tumorprozesse auszuschließen. Daher sind Labor- und spezielle Forschungsmethoden für die Erkennung der Krankheit von großer Bedeutung. Und bei der chronischen Pyelonephritis sind die entscheidenden und manchmal einzigen Manifestationen Veränderungen in Urin, Blut und Harnwegen. Es ist notwendig, den Blutdruck und das Gewicht des Patienten dynamisch zu überwachen. Leukozytose, erhöhte ESR, neutrophile Verschiebung werden im Blut festgestellt, eine Erhöhung des Reststickstoffspiegels (bei einer Norm von 20-40 mg), Harnstoff (Norm von 40-60 mg), Kreatinin (Norm von 53-106 μmol / l), Indican (Norm 1,41, 3,76-180 µmol/l), Cholesterin (Norm 200-83 mg), Blutchloride (Norm XNUMX mmol/l). Wichtig für die Diagnose von Veränderungen im Urin: Abnahme des spezifischen Gewichts, Proteinurie (einschließlich täglich), Hämaturie und Cylindrurie. Methoden zur quantitativen Bestimmung der gebildeten Elemente des Urinsediments gewinnen jedoch zunehmend an diagnostischer Bedeutung: Kakovsky-Addis (normale Leukozyten bis zu 4 Millionen rote Blutkörperchen – bis zu 1 Million, Zylinder – bis zu 2 in 24 Stunden), Amburger (normale Leukozyten bis zu 2000, Erythrozyten – bis zu 1400, Zylinder – bis zu 20 pro 1 Minute), Nechiporenko (normalerweise Leukozyten bis zu 2500, Erythrozyten – bis zu 1000, Zylinder – bis zu 20 in 1 ml frisch ausgeschiedenem Urin) . Das Verhältnis der absoluten Anzahl von Erythrozyten und Leukozyten im Urinsediment bei Pyelonephritis ändert sich dramatisch in Richtung einer signifikanten Dominanz von Leukozyten um das 10- bis 20-fache. Bei chronischer Pyelonephritis treten Stenheimer-Malbin-Zellen im Urin auf: große Leukozyten mit Brown'scher Bewegung der zytoplasmatischen Granula, die mit einer Abnahme der osmotischen Eigenschaften des Urins auftreten (spezifisches Gewicht unter 10-14), blau gefärbt mit Enzianviolett und Safranin, "aktive" Leukozyten: Veränderte Leukozyten, die die Brownsche Bewegung des Protoplasmas besitzen, die bei Färbung mit einer 1%igen wässrigen Lösung von Methylenblau unter Zusatz von destilliertem Wasser sichtbar werden. Der diagnostische Wert einer Erhöhung der Anzahl "aktiver" Leukozyten und Stenheimer-Malbin-Zellen (bis zu 40%), Bakteriurie (Keimzahl mehr als 100 pro 1 ml Urin), Nitrittest (bei einer Keimzahl von mehr als 100 U, Mikroben zersetzen Urinnitrite) werden hervorgehoben. , bei Zugabe von Sulfanilsäure und L-Naphthylamin erscheint eine rote Farbe), ein kolorimetrischer TTX-Test (unter Einwirkung mikrobieller Dehydrogenasen wird Triphenyltetrazolytchlorid zu rotem Unlöslichem reduziert Triphenylformazan innerhalb von 4-10 Stunden bei einer Temperatur von -37 ° C), ein provokativer Prednisolon-Test (der Patient sammelt in einer sterilen Schale, die mittlere Urinportion ist die Kontrolle, dann 30 mg Prednisolon in 10 ml Kochsalzlösung langsam in die Vene injiziert und die mittlere Urinportion dreimal im Stundenabstand und nach 24 Stunden gesammelt; bei chronischer Pyelonephritis verdoppelt sich die Anzahl der Leukozyten, Bakterien, "aktive" Leukozyten treten zumindest in einer Portion auf), Antibiogramme. Besonderes Augenmerk sollte auf die Mikroskopie der Tuberkulose der Nieren gelegt werden (Mikroskopie von nach Tsil gefärbten Abstrichen, Aussaat von Urin auf Spezialmedien - die Methode von Preis und Shkolnikova, die biologische Methode). Wenn ein einseitiger Prozess vermutet wird, muss ein Urintest durchgeführt werden, der mit speziellen Kathetern separat von jeder Niere entnommen wird. Eine wichtige Rolle bei der Diagnose einer chronischen Pyelonephritis spielen radiologische Untersuchungsmethoden: Übersichtsradiographie und Tomographie (Charakterisierung der Position, Größe und Form der Nieren), Ausscheidungs- und retrograde Pyelographie (Abnahme der Konzentration und Ausscheidungsfähigkeit der Nieren, Krämpfe , Anomalien, Deformitäten des Beckens, Kelche), Pneumopyelographie (zur Erkennung von nicht kontrastierenden Steinen), Nierenangiographie (zeigt eine Verletzung der Gefäßarchitektur - Arterien und Venen). Um die Sicherheit der Funktion und des Parenchyms der Nieren zu bestimmen, insbesondere bei einem einseitigen Prozess, werden Radioindikationsmethoden verwendet - Renographie (Hippuran-Jod 131) und Scanographie (unter Verwendung von Neohydrid Hg 203). Eine Punktionsbiopsie bei Pyelonephritis aufgrund der Brennpunkte des Prozesses kann keine Informationen liefern. Eine Chromozystoskopie kann auf eine Nierenschädigung hinweisen. Behandlung. In den meisten Fällen erfolgt die Therapie der Pyelonephritis konservativ. Wenn die akute Pyelonephritis jedoch eitrig ist, kann ein chirurgischer Eingriff erforderlich sein. Die konservative Behandlung besteht aus einer Kur, einer Diät, dem Einsatz von Antibiotika sowie verschiedenen Medikamenten, die die Funktion der Nieren und des gesamten Körpers des Patienten stabilisieren. Bei akuter Pyelonephritis ist strikte Bettruhe angezeigt. Die Nahrung sollte aus Lebensmitteln konsumiert werden, die die optimale Menge an Proteinen, Fetten und Kohlenhydraten enthalten. In der akuten Phase ist es notwendig, Eiweiß und pflanzliche Lebensmittel abzuwechseln. Bei schwerer Vergiftung müssen Sie viel Wasser trinken. Die Behandlung der chronischen Pyelonephritis besteht aus der Beeinflussung der Infektion (etiotrop) bei der primären Pyelonephritis und der Beseitigung der einen oder anderen Ursache bei der sekundären Pyelonephritis, den pathogenetischen Mechanismen und der Behandlung von Komplikationen. Die wirksamste Behandlung erfolgt nach Bestimmung des Antibiogramms. Es wird eine kontinuierliche (mindestens 2 Monate) Behandlung mit antibakteriellen Medikamenten durchgeführt. Unmittelbar nach der Aufnahme wird ein Antibiotikum, Sulfanilamid oder Nitrofuran-Medikament verschrieben. Nach 1-10 Tagen werden die Medikamente gewechselt, die Behandlung wird bis zum anhaltenden Verschwinden von Leukozyturie und Bakteriurie durchgeführt. Sobald die Exazerbation beseitigt ist, wird eine intermittierende Behandlung mit einem der antibakteriellen Mittel für 4-5 Monate durchgeführt: Das Medikament wird 7 Tage lang verabreicht, dann wird eine Pause von 8-10 Tagen eingelegt oder das Medikament wird verabreicht 10 Tage mit einem Intervall von 15-20 Tagen oder das Medikament wird für 15 Tage verabreicht, das Intervall wird für 15 Tage gemacht, dann wird erneut eine antimikrobielle Therapie verschrieben. Die Dauer der Behandlung und die Intervalle werden durch klinische Symptome und Laborkontrolle bestimmt. Es ist darauf hinzuweisen, dass bei einer Pyelonephritis, die sich bei einem Patienten mit chronischer Mandelentzündung entwickelt hat, Antibiotika der Penicillin-Reihe am wirksamsten sind; bei Infektionen der Genitalien bei Männern und Frauen werden Breitbandantibiotika eingesetzt (siehe Tabelle 12). Bei Vorhandensein einer gramnegativen Flora führt die Behandlung mit Nalidixinsäure zu guten Ergebnissen (Schwarze, dh Vigramon - 1,0 g 4-mal täglich für 7 Tage, aber seine Präparate sollten seltener verschrieben werden als andere Medikamente (2-mal)). Aus Sulfanilamidpräparaten werden Etazol (1,0 g 4-mal - 10 Tage), Solafur (0,1 g 3-mal) lang wirkende Sulfonamide verwendet. Auch Kurse werden mit Furazolidon, Furadonin, Furagin (0,1 g 4 mal täglich) behandelt. Es muss betont werden, dass vor Beginn der Behandlung die Nierenfunktion bestimmt werden sollte. Eine antibiotische Langzeittherapie sollte mit einer glomerulären Filtrationsrate von mindestens 30 ml/min oder einem Reststickstoffgehalt im Blutserum von nicht mehr als 70 mg durchgeführt werden. Ein Indikator für die Wirksamkeit des Arzneimittels nach einer Behandlungswoche ist eine Abnahme der Keimzahl auf 10 in 000 ml Urin. Es ist möglich, die Virulenz der Mikroflora zu verringern und die Wirksamkeit antibakterieller Mittel zu erhöhen, indem die Reaktion des Urins alle 10-14 Tage geändert wird. Alkalisierende Lebensmittel, Natriumcitrat (10 g pro Tag), basisches Mineralwasser helfen, pH-Reaktionen zu reduzieren. Eine gewisse antibakterielle Wirkung hat Natriumbenzoat (4-6 g pro Tag), das in Preiselbeeren und Bärenbeeren reichlich vorhanden ist. Die pathogenetische Therapie sollte darauf abzielen, die Reaktionsfähigkeit des Körpers zu erhöhen, den Urinabfluss zu verbessern und den Blutdruck zu normalisieren. Zur Aktivierung der immunbiologischen Reaktivität werden α-Globulin, Autohemotherapie, Bluttransfusion, Impfstofftherapie (Autovakzinbehandlung wird 30-40 Tage lang durchgeführt, 0,1 ml subkutan oder 0,2-0,3 ml alle 2 Tage), Staphylokokken-Toxoid ( 0,1-0,3- 0,5-0,7-1,0-1,2-1,7-2,0 ml alle 3 Tage). Diuretische Kräuter (Bärentraube, Wacholderbeeren, Ackerschachtelhalm, Orthosiphonblatt - Nierentee, Preiselbeerblatt), Antispasmodika (Papaverin, No-Shpa usw.) helfen, den Harnabfluss zu normalisieren. Bei einer Behinderung des Harnabflusses ist eine chirurgische Behandlung indiziert. Bei gleichzeitiger Hypertonie sind Rauwolfia-Präparate indiziert - Isobarin, Dopegyt, Hemiton, Saluretika, Aldosteron-Antagonisten. Prävention und Prognose. Die Pyelonephritis-Prävention besteht aus primären und sekundären Maßnahmen. Die Primärprävention umfasst vor allem die Behandlung von Krankheiten, die zur Entwicklung einer Pyelonephritis führen können: Herdinfektionen, urologische Erkrankungen (wie Urolithiasis, Prostataadenom sowie alle Krankheiten, die mit einer Verletzung des Urinabflusses einhergehen Niere), Freizeitaktivitäten. Tabelle 12 Vergleichende Wirksamkeit antibakterieller Medikamente bei Pyelonephritis
Die Sekundärprävention umfasst den Nachweis einer Bakteriurie bei Vorsorgeuntersuchungen (z. B. sollten schwangere Frauen mindestens einmal im Monat eine bakteriologische Urinanalyse durchführen), die Ernennung einer Anti-Rückfall-Behandlung: die erste Woche eines jeden Monats - eine Behandlungspause: Hagebuttensud, die zweite, dritte Woche - pflanzliche Diuretika und Antiseptika, die vierte Woche - antibakterielle Mittel (Nitrofurane, Antibiotika, Antiseptika, einmal im Jahr - Nevigramon 1 g 1 mal während der Woche und 1,0 g - während der zweiten Woche oder 4 -NOC 2-5 mg 100-mal täglich 150-4 Tage). Die Anti-Rezidiv-Behandlung wird für 2-3 Jahre durchgeführt. Apothekenuntersuchungen mit Behandlung sollten 3-4 mal im Jahr oder 4-6 mal durchgeführt werden. Prognose. Die Prognose hängt vom Stadium der Erkrankung ab. Sanatorium Behandlung. Eine Sanatoriumsbehandlung ist während der Remissionsphase indiziert, insbesondere bei Patienten mit sekundärer kalkhaltiger Pyelonephritis nach urologischen Operationen (Truskavets, Sairme, Zheleznovodsk, Berezovsky Mineralwasser), wo Patienten schwach mineralisiertes Wasser einnehmen. Bei hohem Bluthochdruck, schwerer Anämie und offensichtlichem Nierenversagen ist die Behandlung in einem Sanatorium und Spa kontraindiziert. Komplikationen der Pyelonephritis sind vielfältig. Bei akuter Pyelonephritis führt das Fortschreiten des eitrigen Prozesses zur Verschmelzung großer Abszesse und zur Bildung eines Karbunkels der Niere, zur Kommunikation eitriger Hohlräume mit dem Becken (Pyonephrose), zum Übergang des Prozesses zu einer fibrösen Kapsel (Perinephritis ) und perinephrisches Gewebe (Paranephritis). Akute Pyelonephritis kann durch Nekrose der Pyramidenpapillen (Papillenekrose) kompliziert werden, die sich als Folge der direkten toxischen Wirkung von Bakterien bei Harnstauung entwickelt. Diese Komplikation der Pyelonephritis tritt in den meisten Fällen bei Patienten mit Diabetes auf. Selten wird eine Pyelonephritis zu einer Sepsisquelle. Mit der Einschränkung des eitrigen Prozesses während der Vernarbungsperiode können sich Abszesse bilden, die von einer pyogenen Membran umgeben sind (chronischer Nierenabszess). Bei chronischer Pyelonephritis, insbesondere einseitig, ist es möglich, eine nephrogene Hypertonie und Arteriolosklerose in der zweiten (intakten) Niere zu entwickeln. Bilaterale pyelonephritische Faltenbildung der Nieren führt zu chronischem Nierenversagen. Das Ergebnis einer akuten Pyelonephritis ist normalerweise eine Genesung, aber als Folge von Komplikationen (Pyonephrose, Sepsis, Papilonekrose) kann der Tod eintreten. Chronische Pyelonephritis mit Faltenbildung der Nieren endet oft mit Azotämie-Urämie. Mit der Entwicklung einer arteriellen Hypertonie renalen Ursprungs ist der tödliche Ausgang bei chronischer Pyelonephritis manchmal mit den Komplikationen verbunden, die bei Hypertonie auftreten (Hirnblutung, Myokardinfarkt usw.). Autor: Mostovaya O.S.
▪ Strategisches Management. Krippe
Energie aus dem Weltraum für Raumschiff
08.05.2024 Neue Methode zur Herstellung leistungsstarker Batterien
08.05.2024 Alkoholgehalt von warmem Bier
07.05.2024
▪ Der Philips Hue-Bewegungssensor steuert die Beleuchtung ▪ Babys sind resistent gegen visuelle Täuschungen
▪ Abschnitt der Website Audio- und Videoüberwachung. Artikelauswahl ▪ Artikel Opfer des öffentlichen Temperaments. Populärer Ausdruck ▪ Artikel guatemaltekisches Indigo. Legenden, Kultivierung, Anwendungsmethoden
Startseite | Bibliothek | Artikel | Sitemap | Site-Überprüfungen www.diagramm.com.ua |






 Arabic
Arabic Bengali
Bengali Chinese
Chinese English
English French
French German
German Hebrew
Hebrew Hindi
Hindi Italian
Italian Japanese
Japanese Korean
Korean Malay
Malay Polish
Polish Portuguese
Portuguese Spanish
Spanish Turkish
Turkish Ukrainian
Ukrainian Vietnamese
Vietnamese








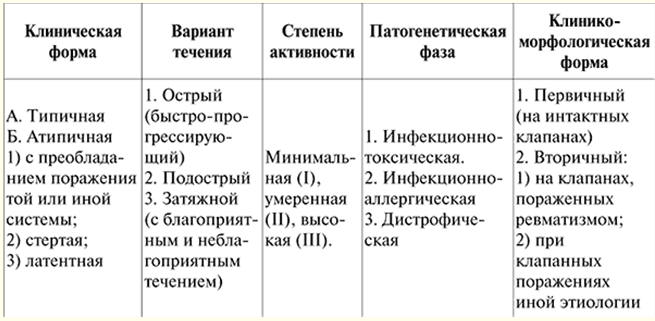








 Siehe andere Artikel Abschnitt
Siehe andere Artikel Abschnitt 